2. 福建医科大学附属第一医院病理科, 福建福州 350000
2. Department of Pathology, First Affiliated Hospital of Fujian Medical University, Fuzhou 350000, China
甲状腺癌发病率居头颈部恶性肿瘤的首位,目前已经成为国内最常见恶性肿瘤的第6位[1]。甲状腺乳头状癌(papillary thyroid cancer, PTC)是甲状腺癌中最常见的亚型,在沿海地区或高碘地区,其比例高达90%以上[2]。研究发现[3],PTC的发生、发展除了与基因的重排/突变有关,也与微小RNA(microRNA, miRNA)密切相关。
MiRNA如何调控甲状腺癌的发生、发展成为了近年的研究热点。但是到目前为止,只有少数的人miRNA被证明与侵袭性PTC相关,其中包括上调的miR-21,miR-146b-5p,miR-221/222,miR-2861,miR-451以及下调的miR-16,miR-613等[4-5]。但是,作为致癌miRNA的microRNA-155(miR-155)在PTC的发生、发展中所起的作用却报道很少。miR-155位于21号染色体非编码转录本BIC的第3个外显子内,是一个致癌miRNA,也参与了非可控性炎症的调控,是炎症信号通路的一个介质[6]。越来越多的证据强烈支持miR-155在肿瘤的发生,发展中起着相当大的作用。目前已经证实miR-155在许多人类癌症中过度表达,包括肺癌、乳腺癌、B细胞淋巴瘤、结肠癌、卵巢癌和脂肪肉瘤等[7-10]。但是迄今为止,尚鲜见有miR-155在PTC中的具体表达与临床病理特征的相关性研究。因此,本研究将通过对86例PTC患者的肿瘤组织及癌旁组织的miR-155表达水平进行检测,并结合患者的临床病理特点,探讨miR-155在PTC中的表达情况与临床意义的关系,探讨miR-155指导PTC预后的可行性。
1 对象和方法 1.1 研究对象2013年4月~5月在福建医科大学附属第一医院甲状腺乳腺外科接受首次甲状腺手术、既往无颈部手术史、病灶>5 mm的86例PTC患者,其中男性16例,女性70例;中位年龄40岁,平均年龄40.4岁(22~65岁)。所有患者均进行全甲状腺切除+患侧中央区淋巴结清扫,其中16例还进行颈侧区淋巴结清扫。本实验流程经福建医科大学附属第一医院伦理委员会批准,所有入组患者均签署了知情同意书。
1.2 标本处理新鲜标本组织一经离体,立刻戴无菌手套,先距肿瘤外2 cm处留取正常甲状腺组织0.5 cm大小,再视肿瘤大小留取单纯癌组织0.3~0.5 cm,标本迅速放入无RNase的冻存管(Corning,USA)并保存于液氮中,整个留取标本过程均控制在3 min内完成,并注意避免交叉污染。
1.3 荧光定量PCR分析参照miRcutemiRNA提取分离试剂盒(天跟公司,中国)进行标本的总RNA抽提,并去除基因组DNA。应用RNA反转录试剂盒(Thermo,USA)将总RNA反转录为互补DNA(cDNA)。由上海翰宇生物科技有限公司设计并合成引物,并经Genebank验证,Has-mir-155引物序列为:上游5-GGCGGCGGTTAATGCTAAT-3,下游5-TGGTGTCGTGGAGTCGGC-3;内参基因为M16,引物序列为:上游5-CGCGTAGCAGCACGTAA ATA-3,下游5-GCAGGGTCCGAGGTATTC-3。应用荧光定量预混试剂增强版试剂盒(天跟公司,中国)进行实时定量分析。每次定量扩增均分析熔解曲线以检测扩增特异性,每个检测均设置3个重复检测孔,同时设立PCR阳性对照(混合cDNA)、阴性对照(以2 μL ddH2O代替模板cDNA),以及空白对照(没有添加ddH2O和模板cDNA)。每个样本的miR-155相对表达量(ΔCT)用内参基因M16去归一,此外还用2指扩增效率(2-ΔΔCT)计算同一个患者癌/癌旁miR-155表达上调或下调的倍数。
1.4 统计学方法所有数据采用SPSS 21.0统计软件包进行分析。用均数±标准差来描述计量资料。用率来描述计数资料;显著性检验计量资料采用独立样本t检验,计数资料采用χ2检验或Fisher确切概率法;以P < 0.05为差异有统计学意义。
2 结果 2.1 病理结果本组患者的病理特征均由病理科两位主治医师进行独立阅片确定,意见不同时由第3个上级医师来确定。所有患者均为PTC,无合并其他类型的甲状腺癌,如滤泡癌、髓样癌、未分化癌等。肿瘤病灶最大径平均大小为1.58±0.93 cm,46.5%(40/86)有甲状腺外侵犯,62.8%(54/86)存在颈部淋巴结转移。按照2010年美国癌症联合会(AmericanJoint Committee on Cancer, AJCC)/UICC中分化型甲状腺癌的TNM分期标准[11],其中Ⅰ期74例、Ⅱ期0例、Ⅲ期6例、Ⅳ期6例。
2.2 PCR扩增结果荧光定量PCR扩增每一条目的基因与内参,均获得单一尖锐熔解曲线峰,PCR扩增特异性较好,3次重复实验数据的重复性较好。PCR扩增结果见图 1。
|
图 1 PCR扩增曲线图 Figure 1 PCR amplification curve of miR-155 (A) and miR-16 (B). |
与癌旁正常组织相比,miR-155在PTC癌组织中相对表达上调为69.8%(60/86),平均相对上调倍数为2.63±2.73倍;而在相对表达上调组中,PTC原发灶更大(1.66±0.96)cm vs(1.19±0.52)cm,t=-2.343,P=0.021;更容易出现甲状腺包膜外侵犯,56.7% vs 23.1%,χ2=8.227,P=0.004;淋巴结转移率更高,70% vs 46.2%,χ2=4.415,P=0.036;具有更晚的TNM分期,Ⅲ~Ⅳ期的比例为20% vs 0%,P=0.014,而在性别、年龄上的差异与表达是否上调不具备统计学意义(P>0.05,表 1)。
| 表 1 MicroRNA-155的表达与甲状腺乳头状癌临床病理特征的关系 Table 1 Correlation of miR-155 expression with clinicopathological features of patients with papillary thyroid carcinoma |
用内参基因M16进行归一的PTC癌组织中miR-155相对表达量(ΔCT)高低与淋巴结转移个数具备一定的相关性,但与肿瘤原发灶大小、甲状腺包膜外侵犯、肿瘤TNM分期不具备相关性(图 2)。
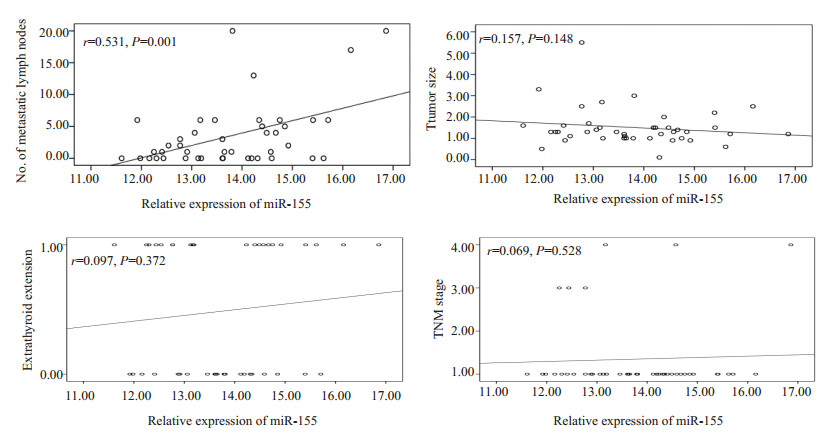
|
图 2 MiR-155相对表达量与PTC的临床病理特征的相关性 Figure 2 Correlation of miR-155 expression level with metastatic lymph node mestastasis, tumor size, extrathyroid involvement, and TNM stage of the tumor in patients with papillary thyroid carcinoma. |
MiRNA是一类广泛存在于真核细胞中的短小单链、非蛋白编码RNA,与人类疾病关系密切。MiR-155是一种致癌miRNA,已经证实其不仅参加非可控性炎症的调控,还参与对甲状腺癌的调控。Nikiforova等[12]通过对甲状腺组织中miR-155的检测发现,与甲状腺增生结节相比,miR-155在甲状腺癌组织中是过度表达的;而Agretti等[13]则通过对甲状腺结节细针穿刺的标本中的miR-146b,miR-155,和miR-221表达情况来区分是良性结节还是PTC。Yu等[14]则对血浆中的miR-155进行检测发现,与存在甲状腺良性结节的患者或者健康人群对比,PTC患者血浆中的miR-155表达是上调的;这与Lee等[15]的研究结论相似。
我们研究发现,与癌旁正常组织相比,69.8%的miR-155在PTC癌组织中相对表达量是上调的。并且在相对表达上调组中,PTC原发灶更大[(1.66±0.96)cm vs(1.19±0.52)cm],更容易出现甲状腺包膜外侵犯(56.7% vs 23.1%),淋巴结转移率更高(70% vs 46.2%),具有更晚的TNM分期,Ⅲ~Ⅳ期的比例更高(20% vs 0%)。Linwah等[16]研究亦发现,相对于低侵袭性PTC,miR-155在具有高侵袭特征如局部复发或远处转移的PTC中有更明显的表达上调,提示miR-155可能在PTC的持续进展中起重要作用。国内学者金臻等[17]则发现miR-155在PTC癌组织及血浆中的表达均高于结节性甲状腺肿相对应的标本,但表达量高低与病理参数无明显相关性。由于本研究中miR-155是否上调的参照物选择的是癌旁组织,金臻等[17]的研究则选择内参为参照物,可能这直接导致了结果的差异性。而采用自身相同器官的正常组织进行对照得到的结果应该更具代表性。因此,我们进一步分析了PTC癌组织中miR-155相对表达量(ΔCT)高低与临床病理参数的相关性,发现仅颈部淋巴结转移个数与miR-155相对表达量存在线性相关,而肿瘤原发灶大小、是否存在包膜外侵犯, 以及TNM分期高低与miR-155相对表达量不存在线性相关。这提示只有综合分析癌、癌旁miR-155表达情况才能合理评估患者的病情。
Zhang等[18]对miR-155在PTC中的功能进行了体外细胞学研究,发现过表达miR-155可提高PTC细胞的活力和促进细胞集落的形成,而抑制miR-155的表达则降低PTC细胞这些生物学行为。我们的研究结果刚好补充了miR-155在PTC的体内功能研究数据,过表达miR-155可以在体内促进PTC的生长,表现为过表达组具有更大的肿瘤病灶;此外,更多的甲状腺外侵犯,更高的淋巴结转移率,更晚的TNM分期,均提示着过表达miR-155可能在PTC的持续进展中起重要作用。有趣的是,我们的数据还提示PTC癌组织中miR-155相对表达量(ΔCT)高低与颈部淋巴结转移个数具备一定的相关性(r=0.531,P=0.001),而颈部淋巴结转移个数多少是PTC的一个不良预后指标[19-20],预示着更多的颈侧区淋巴结转移率和远处转移概率,在一定程度上也支持了Linwah等[16]研究结果。目前MiR-155应用于临床上甲状腺肿瘤良恶性鉴别的研究较多[21],但是MiR-155如何促进PTC发生、发展的机制研究较少。研究认为,一方面miR-155可通过抑制促凋亡基因TP53INP1的表达,减少细胞凋亡,进而促进肿瘤的进展[22];另一方面,在对白血病的研究中发现,miR-155可以负调控Src同源2结构域肌醇5 -磷酸酶(SHIP1),进而活化PI3K/Akt信号通路[23],PI3K/Akt信号转导通路则在甲状腺癌细胞的增殖、分化、生存和凋亡过程中起重要调节作用[24-25]。此外,miR-155可能通过对腺瘤性结肠息肉病(APC)基因的表达调控并激活Wnt/β-catenin信号而发挥癌基因的作用[18]。
综上所述,PTC中miR-155表达水平的高低与PTC的侵袭性、不良预后相关,使其具备成为新的PTC预后标志物的可能性。后续我们将进一步对PTC中miR-155的相关基因、信号通路进行研究,提高我们对PTC肿瘤侵袭性的分子机制的认识,寻找PTC潜在的诊断、治疗或预后的指标。
| [1] | Zheng R, Zeng H, Zhang S, et al. National estimates of cancer prevalence in China, 2011[J]. Cancer Lett,2016, 370 (1) : 33-8. DOI: 10.1016/j.canlet.2015.10.003. |
| [2] | 朱有志, 陈祥锦, 张惠灏, 等. 不同碘营养水平地区分化型甲状腺癌的流行病学研究[J]. 中国普通外科杂志,2013, 22 (11) : 1450-5. |
| [3] | Omur O, Baran Y. An update on molecular biology of thyroid cancers[J]. Crit Rev Oncol Hematol,2014, 90 (3) : 233-52. DOI: 10.1016/j.critrevonc.2013.12.007. |
| [4] | Yang Z, Yuan Z, Fan Y, et al. Integrated analyses of microRNA and mRNA expression profiles in aggressive papillary thyroid carcinoma[J]. Mol Med Rep,2013, 8 (5) : 1353-8. |
| [5] | Wang Z, Zhang H, Zhang P, et al. Upregulation of miR-2861 and miR-451 expression in papillary thyroid carcinoma with lymph node metastasis[J]. Med Oncol,2013, 30 (2) : 577. DOI: 10.1007/s12032-013-0577-9. |
| [6] | Cardoso AL, Guedes JR, Pereira De Almeida L, et al. miR-155 modulates microglia-mediated immune response by downregulating SOCS-1 and promoting cytokine and nitric oxide production[J]. Immunology,2012, 135 (1) : 73-88. DOI: 10.1111/j.1365-2567.2011.03514.x. |
| [7] | Volinia S, Calin GA, Liu CG, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci USA,2006, 103 (7) : 2257-61. DOI: 10.1073/pnas.0510565103. |
| [8] | Yang H, Kong W, He L, et al. MicroRNA expression profiling in human ovarian cancer:miR-214 induces cell survival and cisplatin resistance by targeting PTEN[J]. Cancer Res,2008, 68 (2) : 425-33. DOI: 10.1158/0008-5472.CAN-07-2488. |
| [9] | Jiang S, Zhang HW, Lu MH, et al. MicroRNA-155 functions as an OncomiR in breast cancer by targeting the suppressor of cytokine signaling 1 gene[J]. Cancer Res,2010, 70 (8) : 3119-27. DOI: 10.1158/0008-5472.CAN-09-4250. |
| [10] | Zhang P, Bill K, Liu J, et al. MiR-155 is a liposarcoma oncogene that targets casein kinase-1α and enhances β-catenin signaling[J]. Cancer Res,2012, 72 (7) : 1751-62. DOI: 10.1158/0008-5472.CAN-11-3027. |
| [11] | Edge SB, Compton CC. The American joint committee on cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol,2010, 17 (6) : 1471-4. DOI: 10.1245/s10434-010-0985-4. |
| [12] | Nikiforova MN, Tseng GC, Steward D, et al. MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J]. J Clin Endocrinol Metab,2008, 93 (5) : 1600-8. DOI: 10.1210/jc.2007-2696. |
| [13] | Agretti P, Ferrarini E, Rago T, et al. MicroRNA expression profile helps to distinguish benign nodules from papillary thyroid carcinomas starting from cells of fine-needle aspiration[J]. Eur J Endocrinol,2012, 167 (3) : 393-400. DOI: 10.1530/EJE-12-0400. |
| [14] | Yu S, Liu Y, Wang J, et al. Circulating microRNA profiles as potential biomarkers for diagnosis of papillary thyroid carcinoma[J]. J Clin Endocrinol Metab,2012, 97 (6) : 2084-92. DOI: 10.1210/jc.2011-3059. |
| [15] | Lee YS, Lim YS, Lee JC, et al. Differential expression levels of plasma-derived miR-146b and miR-155 in papillary thyroid cancer[J]. Oral Oncol,2015, 51 (1) : 77-83. DOI: 10.1016/j.oraloncology.2014.10.006. |
| [16] | Yip L, Kelly L, Shuai Y, et al. MicroRNA signature distinguishes the degree of aggressiveness of papillary thyroid carcinoma[J]. Ann Surg Oncol,2011, 18 (7) : 2035-41. DOI: 10.1245/s10434-011-1733-0. |
| [17] | 金臻, 斯岩, 陆婉, 等. miR-155在甲状腺乳头状癌组织及血浆中的表达[J]. 南京医科大学学报:自然科学版,2015 (7) : 999-1003. |
| [18] | Zhang X, Li M, Zuo K, et al. Upregulated miR-155 in papillary thyroid carcinoma promotes tumor growth by targeting APC and activating Wnt/β-catenin signaling[J]. J Clin Endocrinol Metab,2013, 98 (8) : E1305-13. DOI: 10.1210/jc.2012-3602. |
| [19] | Cho SY, Lee TH, Ku YH, et al. Central lymph node metastasis in papillary thyroid microcarcinoma can be stratified according to the number, the size of metastatic foci, and the presence of desmoplasia[J]. Surgery,2015, 157 (1) : 111-8. DOI: 10.1016/j.surg.2014.05.023. |
| [20] | Zhu Y, Zheng K, Zhang H, et al. The clinicopathologic differences of central lymph node metastasis in predicting lateral lymph node metastasis and prognosis in papillary thyroid cancer associated with or without Hashimoto's thyroiditis[J]. Tumour Biol,2016, 37 (6) : 8037-45. DOI: 10.1007/s13277-015-4706-2. |
| [21] | Lodewijk L, Prins AM, Kist JW, et al. The value of miRNA in diagnosing thyroid cancer:a systematic review[J]. Cancer Biomark,2012, 11 (6) : 229-38. |
| [22] | Liu F, Kong X, Lv L, et al. TGF-β1 acts through miR-155 to down-regulate TP53INP1 in promoting epithelial-mesenchymal transition and cancer stem cell phenotypes[J]. Cancer Lett,2015, 359 (2) : 288-98. DOI: 10.1016/j.canlet.2015.01.030. |
| [23] | Costinean S, Sandhu SK, Pedersen IM, et al. Src homology 2 domain-containing inositol-5-phosphatase and CCAAT enhancerbinding protein beta are targeted by miR-155 in B cells of Emicro-MiR-155 transgenic mice[J]. Blood,2009, 114 (7) : 1374-82. DOI: 10.1182/blood-2009-05-220814. |
| [24] | Saji M, Ringel MD. The PI3K-Akt-mTOR pathway in initiation and progression of thyroid tumors[J]. Mol Cell Endocrinol,2010, 321 (1) : 20-8. DOI: 10.1016/j.mce.2009.10.016. |
| [25] | Kandil E, Tsumagari K, Ma J, et al. Synergistic inhibition of thyroid cancer by suppressing MAPK/PI3K/AKT pathways[J]. J Surg Res,2013, 184 (2) : 898-906. DOI: 10.1016/j.jss.2013.03.052. |
 2016, Vol. 36
2016, Vol. 36
