巨噬细胞是一种重要的免疫细胞,由骨髓中造血干细胞来源的单核细胞分化而来。巨噬细胞根据激活方式区分有两种,分别是经典途径激活的巨噬细胞(M1)和非经典途径激活的巨噬细胞(M2)。M1/M2比例及M2的绝对数量对许多疾病的病情和愈后有很大的预测作用[1],因此,若能完全了解巨噬细胞的极化过程及其影响因素,在关键环节进行调控,扭转疾病中已经发生的极化失衡,不失为治疗多种免疫相关疾病的新思路。但有关硒对巨噬细胞极化作用尚不全面,研究低硒对巨噬细胞极化过程影响,并进一步探讨其免疫机制将对理解众多免疫相关疾病的发生发展规律和治疗都有重要意义。
然而在这方面,有关硒对巨噬细胞极化尚不全面。有研究表明,使用活性维生素D调节糖尿病大鼠巨噬细胞极化来保护足细胞治疗肾病[2],并取得了良好的效果,而巨噬细胞表面分子表达也与肝癌患者疾病严重程度与预后有关[3]。M1型巨噬细胞活化后,其表面分子CCR7、CD80、CD86表达增加,M2型巨噬细胞激活后其表面分子CD206、CD163表达增加[4-5]。微量硒可能诱导巨噬细胞活化表型开关可选择地从经典激活M1朝向激活M2表型[6],但当前低硒与肝肾巨噬细胞极化的机制并不清楚。
在人体内,硒参与构成谷胱甘肽过氧化物酶,谷胱甘肽过氧化物酶参与众多的生化反应,主要处理亲水性过氧化物,防止脂质过氧化,从而起到保护生物膜,抗氧化的作用。缺硒会使细胞氧化还原电位失衡,导致人体内氧化自由基过多而造成细胞组织损伤。糖尿病、动脉粥样硬化、白内障、克山病等许多与氧化应激相关疾病都与缺硒密切相关。本课题组筛选出具有特异性的巨噬细胞表面分子CD163、CD206、CCR7,旨在通过建立动物模型,研究这些巨噬细胞表面分子表达的差异性进而推测低硒对巨噬细胞极化方式的影响,并判断低硒与大鼠肝肾纤维化的关系。对揭示硒对人体免疫过程的影响有重要意义。
1 材料和方法本研究通过使用不同含硒量的饲料饲养SD大鼠来构建动物模型。实验分为两组:分别是喂食低硒饲料的实验组和喂食标准饲料的对照组。通过病理切片染色观察低硒组肝脏和肾脏损伤和纤维化情况。免疫组化实验分别选取CCR7作为M1型巨噬细胞的特异标记物,CD163和CD206作为M2型巨噬细胞的特异性标记物。通过SP法免疫组化染色测定CCR7、CD206、CD163在所有大鼠肝肾中的表达情况,根据标记的M1、M2数量差别,探讨硒对巨噬细胞极化过程的影响,及其在缺硒引起的肝肾纤维化中的作用
1.1 组织来源及处理出生18 d SD大鼠24只(西安交通大学动物实验中心提供),体质量30.09±3.04 g,雌雄各半。大鼠在25 ℃,相对湿度65%,12 h光/暗周期下饲养。在实验开始前,所有大鼠均健康,无疾病和损伤,采用随机数字表法将大鼠分成2组(雌雄各6只)。Z组使用标准饲料喂养(含0.18 mg/kg硒)作为对照,S组使用低硒饲料喂养(0.02 mg/kg硒),饮用水为去离子水。所有大鼠饲养109 d后取材:大鼠按1 g/100 g体质量用10%水和氯醛麻醉后,取肾脏和肝脏置于4%多聚甲醛,然后进行常规石蜡包埋。包埋后置于-20 ℃冰箱。使用Leica RM 2235切片机手动切片,切片厚度6 μm。切下的组织切片用毛笔带至37 ℃水浴箱,用平轻轻展开,载玻片捞起,置于60 ℃烘箱烘烤1 h,烘箱内冷却过夜待用。
1.2 HE染色取低硒组与对照组大鼠肝脏和肾脏切片,二甲苯脱蜡,苏木素染色8~10 min,2%盐酸酒精,2%伊红染色1~2 min,80%、90%、100%酒精逐级脱水各2 min,100%二甲苯洗3次,5 min/次,塑胶封片固定。
1.3 免疫组化染色取低硒组与对照组大鼠肝脏和肾脏切片,二甲苯常规脱蜡,梯度酒精脱水,0.3%过氧化氢冲洗,磷酸盐缓冲液(PBS)振洗5 min×3次。滴加封闭血清A,置于37 ℃孵育20 min,倾去,勿洗,滴加兔来源一抗(1:200稀释),4 ℃冰箱中过夜。
取出切片,室温平衡30 min,PBS冲洗3次×3 min。滴加试剂B,置于37 ℃烘箱中20 min,PBS洗3次× 3 min。滴加试剂C,置于37 ℃孵育20 min,PBS洗3次×3 min。用DAB呈色,清水冲洗,细胞核用苏木素复染,中性树脂封片。
1.4 统计学处理染色后,采用BX5正置荧光显微镜(奥林巴斯),采集200倍图像,像素为1200×1600,每个样本随机采集不重复图像,每组每抗体选取雌雄各选3个样本。采集图像选取每只大鼠肾样本近球小管和远球小管各5个,肝样本肝小叶区域5个。运用Image J图片分析软件对采集图像中的阳性像素点数量进行统计计算。(1)将导入的彩色图像转化为灰度图像:进入Image菜单并点击“Type”选项卡,选择“RGB stack”选项从而将图像分割为红、绿、蓝频道,浏览3个频道的图像后,鉴于蓝色分离度最佳,选取该频道的图像;(2)进入Image菜单并点击“Adjust”选项卡,并使用“Threshold”工具分离阳性染色区域,并持续调整阈值直至阳性染色区域呈现红色高亮,所有图像使用同一阈值;(3)对于这些满足阈值的区域按如下步骤进行:进入“Analyze”下的“Set Measurement”并检查“Area”,“Area fraction”,“Limit to threshold”,当点击“Analyze”菜单下的“Measure”,结果呈现在Result窗口中[11]。分析结果以均数±标准差的方式表示。
数据采集完成后,用SPSS13.0统计软件分析,两组之间采用两独立样本均数t检验。以α=0.05为检验标准,P < 0.05认为差异有显著统计学意义。
2 结果 2.1 HE染色低硒组大鼠肝肾出现明显的纤维化组织,而对照组中极少见纤维化组织。肝脏中,纤维化主要发生在汇管区,纤维化组织分布在大血管周围,环形分布,肝小叶区域少见纤维化组织。肾脏中,纤维化主要发生在肾门区域,表现为肾门区域原有的包绕结缔组织增宽增厚(图 1)。
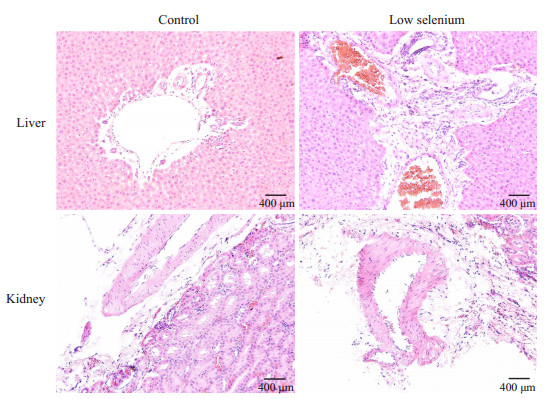
|
图 1 肝肾HE染色结果 Figure 1 HE staining of liver and kidney of the rats in low-selenium and control groups. |
在肝中,阳性表达位置主要在中央静脉周围,阳性细胞呈环型放射状分布在中央静脉四周,或簇状分布,随着与中央静脉距离变远而减少,阳性细胞主要呈卵圆形、圆形、纺锤形。细胞染色阳性呈棕黄色,以胞浆着色为主,也有一部分细胞核阳性染色。雌性低硒组阳性点数(146 178±97 135)高于对照组(42 210±48 626),P> 0.05。雄性低硒组阳性点数(188 313±168 463)高于对照组(170 289±168 463),P>0.05。
在肾中,阳性表达位置主要在肾小管区域,随肾小管走形分布。肾小球细胞周围阳性染色极少。细胞染色阳性呈棕黄色,着色部位基本在胞浆,细胞核阳性染色少见。近球小管区雌性低硒组阳性像素点数(64 028±33 447)高于对照组(60 691±28 606),P>0.05,近球小管区雄性低硒组阳性像素点数(104 929±30 462)高于对照组(66 183±39 469),P>0.05;远球小管中雌性低硒组阳性像素点数(301 730±140 244)低于对照组(501 644±136 243),P>0.05,远球小管中雄性低硒组阳性像素点数(149 253±53 264)低于对照组(224 123±144 798),P>0.05(图 2、3)。
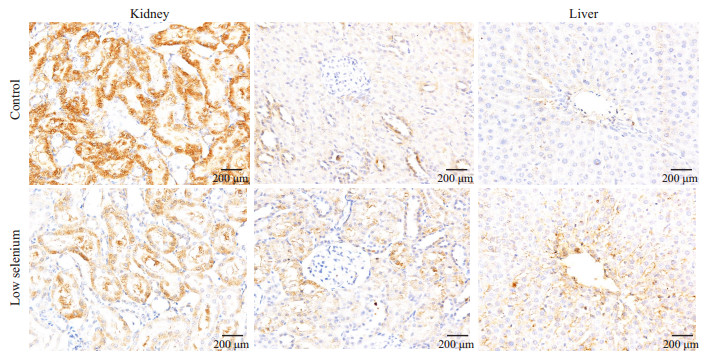
|
图 2 免疫组化染色结果显示雌性组CCR7在肝肾中的表达 Figure 2 Immunohistochemistry of CCR7 in the liver and kidney of female rats in low-selenium and control groups. |
|
图 3 免疫组化染色结果显示雄性组CCR7在肝肾中的表达 Figure 3 Immunohistochemistry of CCR7 in the liver and kidney of male rats in low-selenium and control groups. |
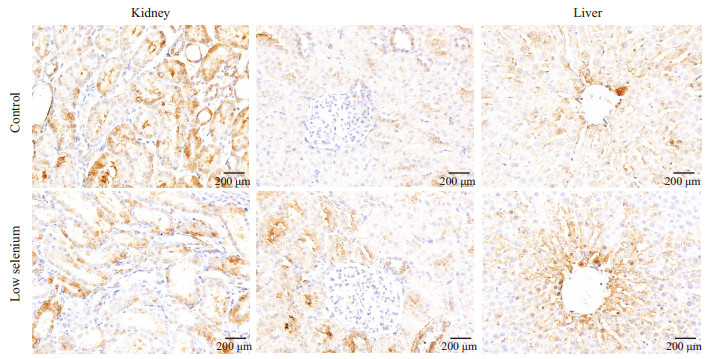
在肝中,阳性表达位置基本与上述相同。阳性染色细胞核较CCR7抗原多见。雌性低硒组阳性点数(71 329±54 902)低于对照组(243 238±123 630),P=0.022。雄性低硒组阳性点数(58 665±20 387)低于对照组(330 619±120 638),P=0.001。
在肾中,阳性表达位置主要在肾小管区域,肾小球内少见阳性染色。近球小管区雌性低硒组阳性像素点数(141 047±160 714)低于对照组(213 000±68 968),P>0.05,近球小管区雄性低硒组阳性像素点数(89 971±73 180)低于对照组(230 940±56 416),P < 0.05;远球小管中雌性低硒组阳性像素点数(117 928±29 820)低于对照组(382 455±98 827),P < 0.05,远球小管中雄性低硒组阳性像素点数(56 965±13 134)低于对照组(271 823±135 003),P < 0.05(图 4、5)。
|
图 4 免疫组化染色结果显示雌性组CD163在肝肾中的表达 Figure 4 Immunohistochemistry of CD163 in the liver and kidney of female rats in low-selenium and control groups. |
|
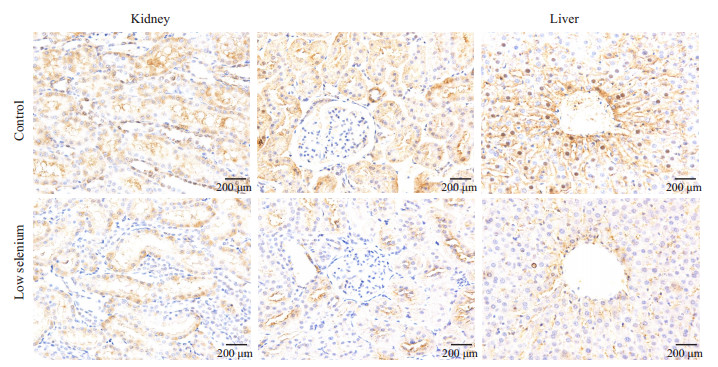
图 5 免疫组化染色结果显示雄性组CD163在肝肾中的表达 Figure 5 Immunohistochemistry of CD163 in the liver and kidney of male rats in low-selenium and control groups. |
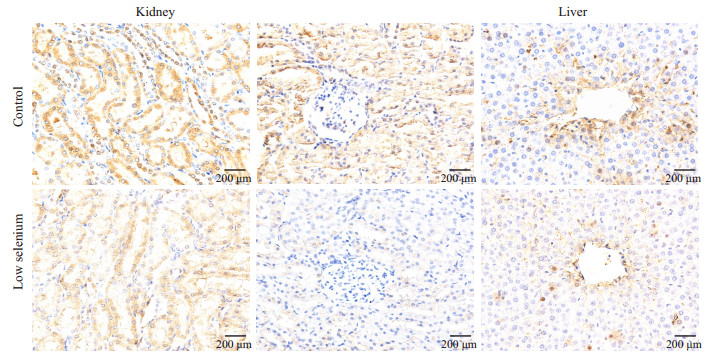
在肝中,阳性表达位置主要在中央静脉周围,细胞间隙染色较深,阳性染色细胞核较少见。雌性低硒组阳性点数(108 577±80 999)高于对照组(69 302±28 846),P>0.05。雄性低硒组阳性点数(91 062±60 986)高于对照组(70 832±46 044),P>0.05。
在肾中,阳性表达位置主要在肾小管区域,与上述相同。近球小管区雌性低硒组阳性像素点数(161 406±62 249)高于对照组(49 245±15 480),P < 0.05,近球小管区雄性低硒组阳性像素点数(72 043±38 247)高于对照组(5714±3104),P < 0.05;远球小管中雌性低硒组阳性像素点数(207 726±52 631)高于对照组(48 948±35 176),P < 0.05,远球小管中雄性低硒组阳性像素点数(15 674±17 910)低于对照组(14 157±6597),P>0.05(图 6、7)。
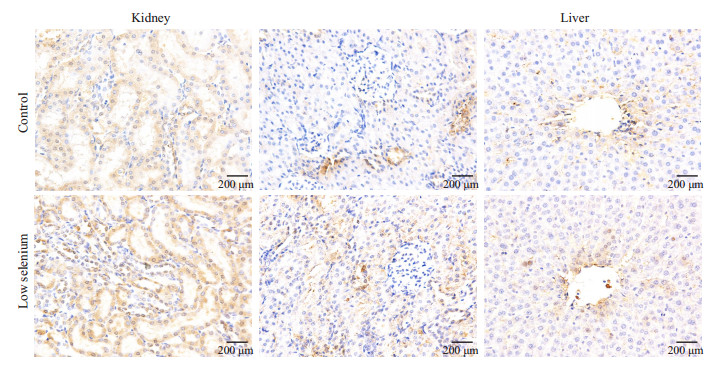
|
图 6 免疫组化染色结果显示雌性组CD206在肝肾中的表达 Figure 6 Immunohistochemistry of CD206 in the liver and kidney of female rats in low-selenium and control groups. |
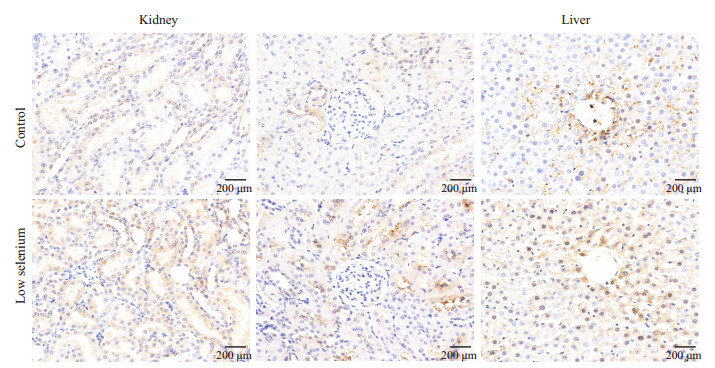
|
图 7 免疫组化染色结果显示雄性组CD206在肝肾中的表达 Figure 7 Immunohistochemistry of CD206 in the liver and kidney of male rats in low-selenium and control groups. |
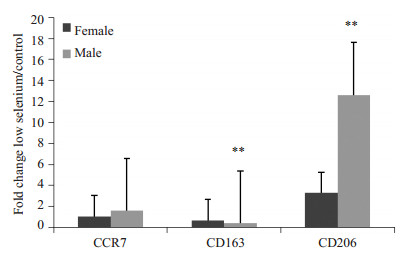
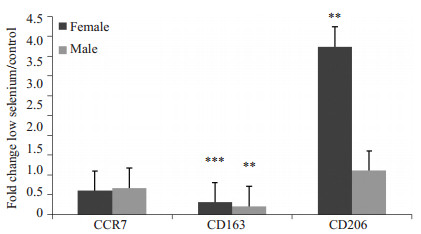
对低硒和正常组肝肾免疫组化3个部位3种标记物的染色强度结果做统计学分析,对比与汇总结果见图 8~10。在肝中,CCR7雌性相较雄性实验组表达明显多于对照组,CD163、CD206雌性雄性对比相当,前者实验组表达少于对照组,后者实验组多于对照组。在肾的近球小管中,CCR7、CD163雌性雄性对比相当,均为实验组表达少于对照组,CD206雄性相较雌性实验组表达明显多于对照组。在肾的远球小管中,CCR7、CD163雌性雄性对比相当,均为实验组表达少于对照组,CD206雌性相较雄性实验组表达明显多于对照组(图 8~10)。
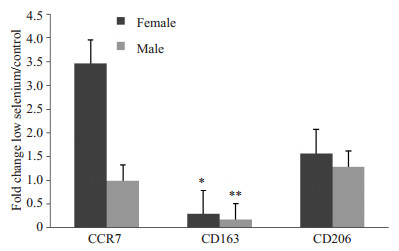
|
图 8 CCR7、CD163、CD206在肝中的表达差异 Figure 8 Comparison of expressions of CCR7, CD163 and CD206 in the liver in female and male rats. *P < 0.05, **P < 0.01. |
|
图 9 CCR7、CD163、CD206在近球小管中的表达差异 Figure 9 Comparison of CCR7, CD163 and CD206 in the proximal tubule in female and male rats. **P < 0.01. |
|
图 10 CCR7、CD163、CD206在远球小管中的表达差异 Figure 10 Comparison of CCR7, CD163 and CD206 in the distal tubule in female and male rats. **P < 0.01, ***P < 0.001. |
肝纤维化是很多慢性肝病的共同特征,伴随门脉高压和功能损害,长期持续发展致肝硬化。肾门是肾血管、淋巴管、神经和肾盂出入的部位,纤维化可能使这些结构出现狭窄压迫,长期导致肾实质损害继而导致肾功能衰竭[7-8]。
在本研究中,HE染色结果表明低硒组肾脏和肝脏中出现较多的纤维化组织。纤维化组织在肾脏中主要分布肾门区,在肝脏中主要分布在中央静脉区。大鼠缺硒造成的纤维化,可能对大鼠健康产生不利影响。硒在人体内参与合成了内质网蛋白硒蛋白K(SellK),在人肝癌细胞中参与调节内质网应激,可能与肝纤维化有直接关系[9]。根据以往研究,人体不同器官中硒含量肾脏最高,肝脏次之[10],也有研究证明,肝硬化患者血清硒含量低于慢性乙肝患者,更低于正常对照,含硒药物可促进异常的肝功能恢复,减轻肝纤维化,从而预防肝癌的发生[11]。
巨噬细胞在炎症反应和肿瘤发生发展中起到极其重要的作用,M1、M2两种巨噬细胞亚型在这方面发挥着几乎相反的作用。既往研究表明,硒具有抗炎症、调节体内氧化还原水平的功能,其具体机制除经典的提高谷胱甘肽过氧化酶活性外[12],本研究主要探索硒是否也参与了巨噬细胞的极化过程,从而影响疾病的发展。
本研究免疫组化结果说明肝脏中低硒组可能会抑制巨噬细胞向M2型转化。CCR7表达在低硒和正常组中的差异无统计学意义,低硒组CD163的表达低于正常组,这与HE染色低硒组损伤高于对照组的结果是相符合的,也与炎症反应中M1主要发挥损伤作用、M2细胞主要发挥抗炎修复作用相符合,说明低硒可能在炎症反应起到抑制修复的作用。在肾脏中,CCR7表达在低硒和正常组亦无统计学意义,雄性低硒组CD163的表达低于正常组,雌性远曲小管低硒组CD163的表达低于正常组。肾作为人体中最大的硒库,对缺硒可能较肝脏更为敏感,低硒在肾脏中同样有抑制损伤修复的作用。
有研究表明CD163的表达已被证实与炎症抑制反应相关。除此之外,在免疫应答的最初阶段,CD163在宿主的防御抗炎过程中扮演着重要的角色[13-14],可溶性CD163也是与炎症相关的生物标记[15]。对比得知,CCR7和CD163分别作为M1型、M2型极化的标志物随硒的含量多少有不同的表达水平。
但值得注意的一点,CD163、CD206同为M2型巨噬细胞标记物。CD163是M2型巨噬细胞的特异性标记物,CD206除在M2型巨噬细胞表达之外,也在树突状细胞表达,鉴于此,选择CD163的结果代表巨噬细胞极化方向更为可信。CD206仅在雌鼠的远曲小管和雌雄鼠的近曲小管高表达,在肝脏中无差异,所以无法得出其和树突状细胞之间的关系。而且低硒组CD206的较高表达,是否因为肝肾损伤免疫过程中,有外周血中未成熟树突状细胞进入肝肾组织引起,且是否与性别有一定关系,还有待后续进一步的研究。
硒可以提高巨噬细胞的杀伤能力和延长巨噬细胞的活动时间,反之,可能是低硒导致了巨噬细胞活动时间减少或功能异常而出现上述结果[16-17]。除此之外,硒还可以防止巨噬细胞减少白介素的产生,从而提高巨噬细胞抗炎作用[18]。其他如乳酸菌胞外多糖等物质硒化后,可使巨噬细胞内钙离子浓度升高,促进发挥其免疫功效,在肿瘤治疗方面有一定疗效[19]。而对于上述所说的内质网蛋白硒蛋白K(SellK),更改其mRNA和蛋白表达路径,就可以改变巨噬细胞增殖及吞噬能力,从而改变其抗感染免疫能力[20]。由此可知,硒与巨噬细胞功能如分化,增殖等乃至疾病的发生发展息息相关。而我国居民硒摄入量普遍不足,因此,建议可以在饮食中适当补硒。
总而言之,本研究主要有3个主要发现,首先,大鼠肝肾纤维化改变与低硒有关。第二,低硒组较正常组CD163表达少,表明低硒抑制极化方向偏向M2;发挥了炎症损伤作用,适当补硒有抑制炎性因子和抗肝纤维化的作用。低硒组CD206在肾脏的高表达的影响因素较多,需要进一步研究。第三,肾脏中雄性低硒组CD163在近曲小管、雌性低硒组CD206在远曲小管表达有统计学意义;其他雌雄两性小鼠在免疫组化表达结果中无明显差异。
| [1] | Stout RD, Jiang C, Matta B, et al. Macrophages sequentially change their functional phenotype in response to changes in microenvironmental influences[J]. J Immunol,2005, 175 (1) : 342-9. DOI: 10.4049/jimmunol.175.1.342. |
| [2] | 郭银凤, 张晓良. 巨噬细胞活化表型与肾脏疾病[J]. 肾脏病与透析肾移植杂志,2014, 23 (3) : 260-4. |
| [3] | Ye H, Wang LY, Zhao J, et al. Increased CD163 expression is associated with acute-on-chronic hepatitis B liver failure[J]. World J Gastroenterol,2013, 19 (18) : 2818-25. DOI: 10.3748/wjg.v19.i18.2818. |
| [4] | 周宪宾, 姚成芳. 巨噬细胞M1/M2极化分型的研究进展[J]. 中国免疫学杂志,2015, 5 (4) : 285-90. |
| [5] | Gladyshev VN. Selenium and methionine sulfoxide reduction[J]. Free Radic Biol Med,2014, 75 (Suppl 1) : S8-9. |
| [6] | Nelson SM, Shay AE, James JL, et al. Selenoprotein expression in macrophages is critical for optimal clearance of parasitic helminth nippostrongylus brasiliensis[J]. J Biol Chem,2016, 291 (6) : 2787-98. DOI: 10.1074/jbc.M115.684738. |
| [7] | 王权, 孟凯. 慢性肝病肝脏储备功能与肝纤维化的相关性探讨[J]. 中外医学研究,2016, 14 (15) : 135-6. |
| [8] | 崔玉杰, 孟祥娟, 李红娟, 等. 周细胞在慢性肾脏病中缺氧与纤维化相互关系中的作用[J]. 标记免疫分析与临床,2016, 23 (2) : 233-6. |
| [9] | 李瑞敏, 张仁利. 硒蛋白K的生物学功能研究发展[J]. 热带医学杂志,2015, 51 (3) : 133-5. |
| [10] | 陈春英, 赵九江, 章佩群, 等. 中子活化法研究硒在人体组织中的亚细胞分布[J]. 核化学与放射化学,2002, 24 (3) : 138-43. |
| [11] | 徐晓磊. 硒酵母片联合恩替卡韦治疗慢性乙型肝炎临床研究[J]. 中外医疗,2015, 34 (26) : 126-7. |
| [12] | 邱美珍, 杨俊, 何平, 等. 酵母硒对小鼠免疫功能影响[J]. 应用预防医学,2014, 285 (2) : 56-7. |
| [13] | Cassetta L, Cassol E, Poli G. Macrophage polarization in health and disease[J]. ScientificWorldJournal,2011, 11 (5) : 2391-402. |
| [14] | Shabo I, Svanvik J. Expression of macrophage antigens by tumor cells[J]. Adv Exp Med Biol,2011, 714 (2) : 141-50. |
| [15] | Moller HJ. Soluble CD163[J]. Scand J Clin Lab Invest,2012, 72 (1) : 1-13. DOI: 10.3109/00365513.2011.626868. |
| [16] | 王磊, 杜菲, 孙卉, 等. 人体硒代谢与硒营养研究进展[J]. 生物技术进展,2015, 5 (4) : 285-90. |
| [17] | Aribi M, Meziane W, Habi S, et al. Macrophage bactericidal activities against staphylococcus aureus are enhanced in vivo by Selenium supplementation in a dose-dependent manner[J]. PLoS One,2015, 10 (9) : e0135515. DOI: 10.1371/journal.pone.0135515. |
| [18] | Tyszka-Czochara M, Pasko P, Zagrodzki P, et al. Selenium supplementation of amaranth sprouts influences betacyanin content and improves Anti-Inflammatory properties via NFκB in murine RAW 264.7 macrophages[J]. Biol Trace Elem Res,2016, 169 (2) : 320-30. DOI: 10.1007/s12011-015-0429-x. |
| [19] | 刘鹭, 潘道东, 丁琳, 等. 硒化乳酸菌胞外多糖对小鼠腹腔巨噬细胞及肿瘤细胞内游离Ca2+的影响[J]. 食品科学,2014, 35 (1) : 62-73. |
| [20] | 黄飞雁, 满云翔, 傅玉才, 等. 干扰SellK对小鼠巨噬细胞非特异性免疫应答的影响[J]. 中国热带医学,2015, 15 (8) : 7-11. |
 2016, Vol. 36
2016, Vol. 36
