2. 重庆市人民医院放射科, 重庆 400014 ;
3. 重庆医科大学生物医学工程学院//省部共建国家重点实验室培育基地-重庆市超声医学工程重点实验室//重庆市生物医学工程学重点实验室, 重庆 400016
2. Department of Radiology, Chongqing People's Hospital, Chongqing 400014, China ;
3. State Key Laboratory of Ultrasound Engineering in Medicine Co-Founded by Chongqing and Ministry of Science and Technology, College of Biomedical Engineering, Chongqing Medical University, Chongqing Key Laboratory of Biomedical Engineering, Chongqing 400016, China
高强度聚焦超声(HIFU)消融已广泛应用于各种肿瘤的治疗中,并取得可观的疗效[1-4]。但HIFU治疗效率低下仍是其发展的瓶颈。研究表明,改变组织声环境可以提高HIFU治疗效率[5-6]。目前最常用的增效方法是向体内注入微泡造影剂[7-10],人为改变组织声环境,从而提高HIFU损伤效率。但是微泡造影剂具有肿瘤血管穿透力弱、分布不均、稳定性差、血液循环时间短等缺点,并且人工注入体内是一种有创方式,因此其应用受到一定的限制。我们在前期的研究中发现,低剂量聚焦超声预辐照可以使靶组织声环境发生自身改变[11],从而提高HIFU损伤效率[12-14],并通过剂量学与方法学等研究,发现采用100 W功率进行一遍低剂量预辐照,24 h后再进行HIFU消融,增效效果最佳[15-18]。但是目前尚无研究对微泡与低剂量预辐照两种增效方法的优劣势进行系统性比较。因此,本研究对比观察低剂量预辐照与微泡对HIFU消融兔肝VX2移植瘤的增效作用,探讨两种方法在增效效果、有效性、稳定性及安全性方面的优劣,以期寻找到一种更为安全、有效的HIFU增效方法,为临床提高HIFU治疗效率提供新思路。
1 材料和方法 1.1 实验动物与设备纯种新西兰大白兔55只,雌雄不限,体质量1.5~2.0 kg,月龄2~3月(重庆医科大学实验动物中心提供)。荷瘤种兔1只(重庆医科大学超声工程研究所提供)。
JC200型聚焦超声肿瘤治疗系统(重庆海扶技术(HIFU)有限公司);光学显微镜(Olympus-Bx40,日本);电子显微镜(Hitachi-7500,日本)。
1.2 实验方法 1.2.1 建立兔肝VX2移植瘤模型采用包埋法。经手术开腹剥离荷瘤种兔肝肿瘤,取边缘生长旺盛无坏死的组织,切成1 mm×1 mm×1 mm瘤块。再开腹暴露拟接种兔肝,用眼科镊于肝右中叶膈面穿破形成窦道,将瘤块包埋其中,然后清创缝合,即制成荷瘤兔。
1.2.2 HIFU消融荷瘤兔随机分为A、B、C 3组:A组25只,低剂量预辐照+HIFU消融;B组15只,微泡+HIFU消融;C组15只,单纯HIFU消融。A组于肿瘤建模后第15天进行低剂量聚焦超声预辐照,选定肿瘤区域,按“线-面-体”方式由深至浅逐层进行辐照,两线间距8 mm,每层间距3 mm,功率100 W,扫描1遍,24 h后随机处死10只实验兔,另15只实验兔进行HIFU消融。B组于肿瘤建模后第16天经耳缘静脉快速团注微泡造影剂声诺维(SonoVue),剂量0.05 mL/kg,随后快速注入1 mL生理盐水冲洗导管,15 s后进行HIFU消融。C组于建模后第16天进行HIFU消融。各组的HFU消融参数保持一致:采用直线扫描,线长10 mm,靶点距体表距离均为15 mm,功率250 W,当靶区出现稳定的回声增强时终止扫描。
1.3 观察指标 1.3.1 能效因子(EEF)记录各组HIFU消融的时间。HIFU消融后即刻处死所有剩余实验兔,取辐照区域瘤组织放入37 ℃的TTC(氯化三苯基四氮唑)溶液中染色[19-20],被破坏的组织呈苍白色,测量凝固性坏死的长、宽、厚径,以公式:V=(4/3)π×(1/2)长×(1/2)宽×(1/2)厚计算坏死体积。根据公式EEF(J/mm3)=Pt/V计算能效因子,式中:EEF为能效因子[21-22],指损伤单位体积的组织所需的超声能量;P(W)为声功率;t(s)为辐照时间;V(mm3)为坏死体积。
1.3.2 病理变化HIFU消融前,A组随机处死10只实验兔,取肿瘤组织,以10%福尔马林液固定行光镜检查,2.5%戊二醛固定行电镜检查。HIFU消融后,处死所有实验兔,取辐照区域坏死组织,同样行光镜与电镜检查。
1.3.3 声通道损伤HIFU消融后,观察实验兔从皮肤到靶区所经过的声通道组织,如皮肤、软组织、肌肉、脏器等,是否出现肉眼可见的损伤性变化。
1.4 统计学处理采用SPSS13.0统计软件。结果用均数±标准差表示,采用t检验进行统计学分析。P < 0.05为差异有统计学意义。
2 结果 2.1 低剂量预辐照、微泡对HIFU消融的影响当HIFU消融靶区出现稳定的回声增强时,A组(低剂量预辐照+HIFU消融)、B组(微泡+HIFU消融)所用的时间明显短于C组(单纯HIFU消融)(P < 0.05),但在靶区产生凝固性坏死的体积增大,EEF值明显降低(P < 0.05),说明低剂量预辐照与微泡均可以有效缩短消融时间,提高HIFU消融效率。而在A、B组之间,消融时间、凝固性坏死体积、EEF差异均无统计学意义(表 1)。
| 表 1 低剂量预辐照、微泡对HIFU消融的影响 Table 1 Effect of HIFU ablation combined with low-dose irradiation or microbubble |
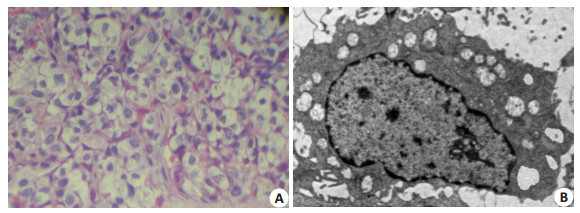
低剂量预辐照24 h后,A组剖腹可见肿瘤边缘出现暗红色的充血带。光镜下,肿瘤细胞明显水肿,呈气球样变,肿瘤间质血管淤血,并可见少量淋巴细胞、中性粒细胞浸润。电镜下,肿瘤细胞浆内出现大量大小不等的空泡,细胞器明显肿胀,肿瘤间质血管腔内可见大量红血球聚集(图 1)。
|
图 1 低剂量预辐照24 h后病理变化 Figure 1 Histopathological changes of the tumor 24 h after low-dose irradiation. A: Tumor cell edema and ballooning changes under light microscope (Original magnification: × 400); B: Vacuoles in the cytoplasm and organelle swelling under electron microscope (×6000). |
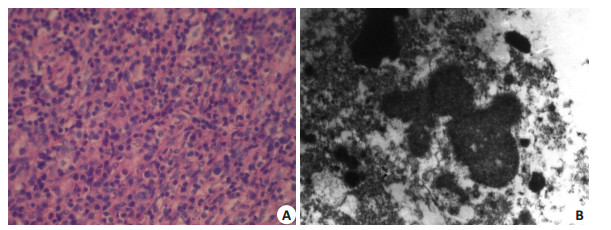
HIFU消融后,3组的靶区组织经TTC染色后,均可见椭圆形苍白色不着色区,即凝固性坏死区,与周围组织有明显分界。光镜下,肿瘤细胞结构破坏,核固缩、深染,胞浆呈嗜酸性。电镜下,肿瘤细胞均为不可逆变性坏死,细胞膜及核膜断裂,细胞器结构明显破坏,细胞核固缩,核碎裂(图 2)。
|
图 2 HIFU消融后病理变化 Figure 2 Histopathological changes of the tumor after HIFU ablation. A: Tumor cell nucleus pyknosis and dark staining with acidophilic cytoplasm under light microscope (×400); B: Tumor cell membrane and nuclear membrane rupture, nuclear pyknosis and fragmentation under electron microscope (×5000). |
与C组(单纯HIFU消融)对比,A组(低剂量预辐照+HIFU消融)中有8例EEF明显降低,4例无明显变化,3例升高,增效的有效率为53.33%;B组(微泡+HIFU消融)中有12例EEF明显降低,3例无明显变化,0例升高,增效的有效率为80%,说明微泡对HIFU的增效作用更为稳定,有效性更高。
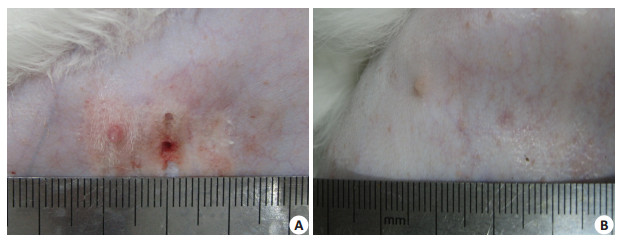
2.4 低剂量预辐照、微泡联合HIFU消融对声通道的影响C组(单纯HIFU消融)中7例、B组(微泡+HIFU消融)中4例靶区前方软组织出现不同程度的损伤,皮肤可见红斑,A组(低剂量预辐照+HIFU消融)无一例出现肉眼可见变化,说明通过微泡或低剂量预辐照增效后,可以提高对声通道的安全性,其中低剂量预辐照的安全性最高(图 3)。
|
图 3 HIFU消融后皮肤改变 Figure 3 Skin changes after HIFU ablation. A: Skin erythema in microbubble+HIFU ablation group; B: No skin change in low-dose irradiation+HIFU ablation group. |
HIFU作为一种新型的无创治疗技术,现已广泛应用于多种肿瘤的临床治疗中。但HIFU治疗效率低下仍然是其面临的主要问题。近年来,改变组织声环境以提高HIFU治疗效率成为HIFU研究的热点[23-24]。
本研究结果显示,低剂量预辐照与微泡具有相同的HIFU增效作用,两种方法在消融时间、凝固性坏死体积、EEF上均无统计学差异(P>0.05)。由于低剂量预辐照是通过预辐照使靶区组织声环境发生自身改变,从而达到增效目的,因此具有无创、能集中作用于靶区组织的优势;而微泡造影剂是将外源性空化核人工引入体内,增加肿瘤组织内的空化核数量,从而提高空化效应,加大对组织的损伤,这种人工引入体内的方法是一种有创方式,并且微泡造影剂具有自身的缺点,如肿瘤血管穿透力弱、不能均一分布于靶组织、稳定性差、血液循环时间短等,因此其应用受到一定的限制。
本研究中发现,兔肝VX2移植瘤经低剂量聚焦超声辐照,24 h后会出现肿瘤细胞明显水肿,胞浆内大量空泡,肿瘤间质血管淤血等一系列病理变化,分析其增效的机制可能有以下3个方面:一、兔肝VX2移植瘤的结构、密度、血液供应以及功能状态等发生了变化,改变了组织声环境,从而增加了超声能量沉积;二、肿瘤细胞浆内出现大量空泡,增加了组织的空化效应,从而提高损伤效率[25-26];三、肿瘤间质内血管淤血使肿瘤内因血流带走的热量减少,从而减少了消融所需剂量[27]。但其具体作用机制还有待进一步研究证实。
数据显示,低剂量预辐照增效的有效率为53.33%,而微泡造影剂为80%,说明微泡造影剂的增效作用更为稳定,有效性更高。分析其原因可能与各自不同的增效机制有关:低剂量预辐照是通过作用于靶组织,致使靶组织自身发生病理生理改变而改变组织声环境,而机体对辐照损伤的反应不尽相同,可能会导致个别靶组织的改变不利于超声能量的沉积,比如过强的炎症反应导致细胞坏死等等,进而出现损伤效率反而降低的情况;反之,微泡造影剂是人工直接从外界引入到靶组织,成分和剂量相对稳定,因此对HIFU的增效作用相对稳定,有效性更高。
此外,本研究结果显示,低剂量预辐照及微泡增效后,对声通道的损伤大大减少,但微泡增效后仍有4例靶区前方的声通道组织出现不同程度的损伤,皮肤出现红斑,而低剂量预辐照增效后无一例出现,说明低剂量预辐照对声通道的安全性比微泡更高,分析其原因可能与微泡分布的不均一性有关。
综上所述,低剂量预辐照具有与微泡相同的HIFU增效作用,同时具有无创、能集中作用于靶组织、安全性更高等优点,有可能成为一种新的安全有效的HIFU增效方法。但其增效作用的稳定性及有效性相对较差,此问题有待进一步研究解决。
| [1] | Mahmoud MZ, Alkhorayef M, Alzimami KS, et al. High-Intensity focused ultrasound (HIFU) in uterine fibroid treatment:review study[J]. Pol J Radiol,2014, 79 (1) : 384-90. |
| [2] | 张喆, 金成兵, 周崑, 等. 高强度聚焦超声治疗肾上腺嗜铬细胞瘤的临床初探[J]. 中国超声医学杂志,2015, 31 (7) : 663-6. |
| [3] | 周崑, DimitrovDD, AndreevTV, 等. 高强度聚焦超声治疗不能手术胰腺癌的1年生存分析:中国和保加利亚的多中心临床研究[J]. 重庆医科大学学报,2015, 40 (3) : 378-83. |
| [4] | Saif MW. Advancements in the management of pancreatic cancer:2013[J]. JOP,2013, 14 (2) : 112-8. |
| [5] | Wang Z, Li F, Bai J, et al. A study of acoustic environment in tissue of high intensity focused ultrasound[M]. 3rd. International symposium on therapeutic ultrasound, Lyon, France, 2003, 68. |
| [6] | 王敏, 冉海涛, 何敏瑜, 等. 高分子液态氟碳微球增效高强度聚焦超声治疗兔乳腺VX2移植瘤实验研究[J]. 中国超声医学杂志,2014, 30 (2) : 167-70. |
| [7] | Peng S, Xiong Y, Li K, et al. Clinical utility of a microbubbleenhancing contrast("SonoVue")in treatment of uterine fibroids with high intensity focused ultrasound:a retrospective study[J]. Eur J Radiol,2012, 81 (12) : 3832-8. DOI: 10.1016/j.ejrad.2012.04.030. |
| [8] | 李云华, 常才. 超声微泡造影剂在高强度聚焦超声增效领域的研究进展[J]. 中华超声影像学杂志,2015, 24 (8) : 732-5. |
| [9] | 蒋红, 罗爽, 何敏, 等. HIFU联合超声微泡增效剂SonoVue治疗盆腔手术史子宫肌瘤患者研究[J]. 昆明医科大学学报,2013, 34 (8) : 58-62, 88. |
| [10] | Jiang N, Xie B, Zhang X, et al. Enhancing ablation effects of a Microbubble-Enhancing contrast agent ("SonoVue") in the treatment of uterine fibroids with High-Intensity focused ultrasound:a randomized controlled trial[J]. Cardiovasc Intervent Radiol,2014, 37 (5) : 1321-8. DOI: 10.1007/s00270-013-0803-z. |
| [11] | 张奕, 邹建中, 欧霞, 等. 低剂量高强度聚焦超声辐照兔肝后的病理转归[J]. 中国医学影像技术,2010, 26 (4) : 620-2. |
| [12] | 张奕, 陈菲, 邹建中, 等. 高强度聚焦超声二次辐照兔肝VX2移植瘤的实验研究[J]. 中国超声医学杂志,2010, 26 (5) : 400-3. |
| [13] | 邹海蓉, 邹建中, 王雁, 等. 低剂量超声预辐照对高强度聚焦超声消融兔肝VX2瘤的增效研究[J]. 世界科技研究与发展,2011, 33 (4) : 657-60. |
| [14] | 邹海蓉, 邹建中, 欧霞, 等. 首次低剂量超声辐照对HIFU消融兔肝VX2瘤的影响[J]. 第三军医大学学报,2011, 33 (2) : 116-8. |
| [15] | 欧霞, 邹建中, 张奕, 等. 不同剂量高强度聚焦超声辐照兔肝VX2移植瘤的病理学观察[J]. 中国介入影像与治疗学,2011, 8 (2) : 132-6. |
| [16] | 欧霞, 王雁, 邹海蓉, 等. 兔肝VX2移植瘤不同剂量高强度聚焦超声辐照后增殖细胞核抗原的表达及意义[J]. 中国医科大学学报,2010, 39 (12) : 989-91. |
| [17] | 欧霞, 邹建中, 陶轶妮, 等. 不同剂量高强度聚焦超声辐照与HIFU消融VX2兔肝移植瘤量效关系的实验研究[J]. 世界科技研究与发展,2011, 33 (5) : 908-10. |
| [18] | 张奕, 邹建中, 马闻, 等. 两种方式高强度聚焦超声2次辐照兔肝移植瘤的比较[J]. 中国医科大学学报,2010, 39 (2) : 92-4. |
| [19] | 常淑芳, 顾美礼, 伍烽, 等. 氯化三苯基四氮唑染色在高强度超声生物学焦域观测中的应用[J]. 中国超声医学杂志,2000, 16 (9) : 641-4. |
| [20] | 艾慧坚, 钟明松, 李发琪, 等. 低功率HIFU辐照离体牛肝后强回声出现的原因[J]. 世界科技研究与发展,2012, 34 (3) : 469-71. |
| [21] | 刘宝琴, 熊树华, 王智彪, 等. 体外不同频率高强度聚焦超声的生物学焦域[J]. 中国超声医学杂志,2002, 18 (6) : 417-20. |
| [22] | 易良波, 王琦, 王智彪, 等. 对比观察Sono Vue与包裹全氟戊烷的介孔二氧化硅纳米微球在蛋清体模中的高强度聚焦超声增效作用[J]. 中国介入影像与治疗学,2014, 11 (2) : 103-6. |
| [23] | Hamano N, Negishi Y, Takatori K, et al. Combination of bubble liposomes and high-intensity focused ultrasound(HIFU)enhanced antitumor effect by tumor ablation[J]. Biol Pharm Bull,2014, 37 (1) : 174-7. DOI: 10.1248/bpb.b13-00605. |
| [24] | Sun Y, Zheng Y, Ran H, et al. Superparamagnetic PLGA-iron oxide microcapsules for dual-modality US/Mr imaging and high intensity focused US breast cancer ablation[J]. Biomaterials,2012, 33 (24) : 5854-64. DOI: 10.1016/j.biomaterials.2012.04.062. |
| [25] | Farny CH, Glynn Holt R, Roy RA. The correlation between bubble-enhanced HIFU heating and cavitation power[J]. IEEE Trans Biomed Eng,2010, 57 (1) : 175-84. DOI: 10.1109/TBME.2009.2028133. |
| [26] | Parsons JE, Cain CA, Abrams GD, et al. Pulsed cavitational ultrasound therapy for controlled tissue homogenization[J]. Ultrasound Med Biol,2006, 32 (1) : 115-29. DOI: 10.1016/j.ultrasmedbio.2005.09.005. |
| [27] | Wu F, Wang ZB, Chen WZ, et al. Advanced hepatocellular carcinoma:treatment with high-intensity focused ultrasound ablation combined with transcatheter arterial embolization[J]. Radiology,2005, 235 (2) : 659-67. DOI: 10.1148/radiol.2352030916. |
 2016, Vol. 36
2016, Vol. 36
