2. 济南军区总医院急诊重症中心, 山东济南 250031 ;
3. 解放军总医院第一附属医院全军烧伤研究所基础部, 北京 100048
2. Department of Critical Care Medicine, General Hospital of Jinan Command, Jinan 250031, China ;
3. Trauma Research Center, First Hospital Affiliated to the Chinese PLA General Hospital, Beijing 100048, China
严重烧、创伤及外科大手术应激打击极易诱发脓毒症等感染并发症,进一步发展可导致脓毒性休克、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS),是临床烧、创伤和危重患者最主要死亡原因之一。尽管临床治疗已取得显著进展,但病死率仍居高不下,成为直接影响患者预后、阻碍进一步提升危重烧伤救治成功率的突出难题,因此,提高对脓毒症的认识和防治水平无疑具有重要的理论价值及临床意[1]。
淋巴细胞凋亡在维持免疫稳态和自身免疫耐受中起着重要作用。在严重创伤打击时,无论是在中枢还是外周淋巴器官中均发现了大量淋巴细胞凋亡[2]。淋巴细胞凋亡增加可能是机体免疫抑制发生的重要机制之一[3-4]。Smad2和Smad3是转化生长因子β1(TGFβ1)下游受体激活蛋白,活化的TGFβ1使Smad2/Smad3发生磷酸化而被激活,受到Bcl-2家族的促凋亡和抗凋亡蛋白的调节,通过细胞色素C的释放激活胱天蛋白酶(caspase-9)。最终活化的caspase-8、caspase-9都通过激活下游的caspase-3介导细胞的调亡。Bcl-2、Bcl-xl维护线粒体的完整性从而阻碍了细胞色素C的释放;Bax、Bim等促凋亡成员则促进了这一过程的发生。
肿瘤坏死因子-α诱导蛋白-8样分子2(TIPE2)是新近发现的蛋白,在体内试验中,敲除小鼠TIPE2基因两个月后发现部分动物出现慢性疾病,表现为体重减轻、脾肿大、白细胞增加和多器官自发性炎症反应,说明TIPE2缺乏容易诱发广泛性炎症[5-6]。本课题组先前研究已证实TIPE2在烫伤小鼠T淋巴细胞存在表达,烫伤后24 h表达最高[7-8],并且发现沉默TIPE2后烫伤小鼠中IFN-γ显著升高而IL-4水平显著下降,IFN-γ/IL-4比值明显升高,说明脾脏TIPE2可能参与组织局部促炎和抗炎性细胞因子表达调节,并对局部免疫产生影响。我们假设TIPE2是介导严重烧伤后T淋巴细胞免疫功能障碍的关键调控分子,并很可能通过线粒体相关凋亡途径调节T淋巴细胞凋亡发挥作用。本研究通过研究TIPE2与CD4+ T细胞凋亡之间的关系,探讨其参与严重烧伤后脓毒症的调控机制。
1 材料和方法 1.1 实验动物及分组实验小鼠为健康清洁级BALB/C小鼠,购自中国医学科学院医学实验动物研究所,均为雄性,体质量20±2 g。140只成年雄性BALB/C小鼠分为6组:烫伤组(burn)40只,假伤组(Sham)40只,沉默TIPE2组(siTIPE2-burn)15只,沉默病毒对照组(siTIPE2-siTIPE2-negative-burn)15只,过表达TIPE2组(TIPE2-burn)15只,过表达病毒对照组(TIPE2-negative -burn)15只。
1.2 RNA干扰及过表达TIPE2小RNA干扰慢病毒表达载体(siRNA)由上海吉凯公司合成,siRNATIPE2的DNA靶序列为5'-GAAGTGAAACTCAGGTCCG-3'[5],对照组RNA序列5'-TTCTCCGAACGTGTCACGT-3'。过表达DNA靶序列上游引物为GAGGATCCCCGGGTACCGGTC GCCACCATGGAGTCCTTCAGCTCA,下游引物为TCCTTGTAGTCCATACCGAGCTTGCCCTCGTCC AG。过表达对照组采用空载体质粒。合成DNA片段转移至pGCL-GFP构建pFIV-H1/U6-copGFP载体,转染过程严格按照说明书执行。
1.3 动物模型小鼠适应性饲养1周,自由进食水,室温25 ℃,昼夜节律为12 h。术前禁食12 h,自由饮水。小鼠乙醚麻醉后,剃去背部鼠毛,暴露背部在99 ℃热水中烫8 s,根据公式计算小鼠体表面积,造成15%面积皮肤烫伤模型。假伤组小鼠除了浸泡温水,其他麻醉方式和喂养同烫伤组。后4组通过尾静脉分别注射携带siTIPE2/过表达或空载体对照慢过表达或空载体对照慢病毒,待2周后复制小鼠burn模型,术后予0.9%生理盐水40 mL/kg抗休克治疗,所有小鼠在烫伤24 h处死。动物实验相关方案通过动物伦理委员会批准,动物处置过程所有操作符合动物伦理学标准。
1.4 脾脏CD4+ T细胞分离小鼠断颈处死后无菌条件下取脾脏,分离小鼠脾脏单个核细胞。采用MiniMACS免疫磁性分离系统,每108个单核细胞加入100 μL生物素-抗体“鸡尾酒”,4 ℃避光预冷10 min。然后加入300 μL PBS,200 μL抗生物素磁珠4 ℃避光预冷15 min后离心洗涤。500 μL PBS重悬细胞,通过LS柱阴性分选后收集留出的细胞悬液,离心洗涤获得CD4+ T细胞,分离出的CD4+ T用FITC标记抗CD4抗体孵育,流式细胞术鉴定正常小鼠脾脏CD4+ T细胞纯度(图 1)。
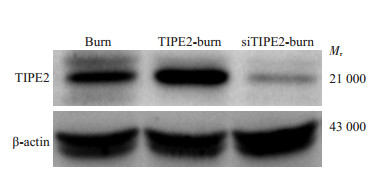
|
图 1 Western blot检测burn组、TIPE2-burn组和siTIPE2-burn组TIPE2蛋白表达 Figure 1 Expressions of TIPE2 in burn, TIPE2-burn and siTIPE2-burn groups |
根据PE Annexin-V凋亡试剂盒,离心收集细胞(5×105),用预冷的PBS洗2遍(1200 r/min离心8 min);加入100 μL的稀释液1% Binding buffer重悬细胞,分别加入5 μL Annexin V和7AAD混匀,4 ℃避光反应20 min;加入300 μL的稀释液Binding buffer,1 h内流式细胞仪检测。
1.6 蛋白质免疫印迹试验(Western blot)检测检测各组小鼠CD4+ T淋巴细胞内TIPE2,Smad2/ Smad3、磷酸化(P)-Smad2/P-Smad3以及Bcl-2/Bim的蛋白表达。采用BCA法对小鼠CD4+ T细胞总蛋白进行定量分析。聚丙烯酰胺凝胶电泳(SDS-PAGE)中细胞蛋白上样量均为50 μg,取30 μL浓缩物上样,用100 g/L聚丙烯酰胺凝胶进行电泳。第一抗体为兔抗鼠TIPE2多克隆抗体(1:500),兔抗鼠Smad2单克隆抗体(1: 2000),兔抗鼠(P)-Smad2多克隆抗体(1:500),兔抗鼠Smad3单克隆抗体(1:2000),兔抗鼠(P)-Smad3单克隆抗体(1:2000),兔抗鼠Bcl-2单克隆抗体(1:1000),兔抗鼠Bim多克隆抗体(1:500),第二抗体为辣根过氧化酶标记羊抗兔IgG(1:2500),单克隆β-actin作为蛋白对照,比较烫伤组和烫伤RNAi-TIPE2组TIPE2蛋白表达情况,观察TIPE2基因沉默效果。应用ImageJ软件分析目标条带的灰度值进行蛋白定量。
1.7 流式细胞仪检测CD4+ T线粒体膜电位变化按JC-1试剂盒说明书配制染色工作液。将各组细胞重悬于0.5 mL细胞培养液中,并加入0.5 mL的JC-1染色工作液,颠倒数次以混匀。于细胞培养箱中37 ℃孵育20 min,600 r/min 4 ℃离心3~4 min,沉淀细胞。弃上清,用JCM染色缓冲液洗涤2次后行流式细胞仪分析。
1.8 共聚焦荧光法检测CD4+ T细胞色素C表达收集5×105各组小鼠CD4+ T细胞,PBS润洗3次,1500 r/min离心5 min,弃上清,收集细胞。加入4%多聚甲醛溶液500 μL室温下固定30 min,PBS洗涤去上清,加入500 μL 0.2%的TritonX-100室温下穿孔20 min。PBS润洗细胞2次,1200 r/min离心5 min,弃上清。加入500 μL阻断缓冲液(1% BSA),室温下封闭30 min。按1:400比例用1% BSA稀释细胞色素C抗体500 μL,4 ℃反应过夜。PBS洗涤1遍,1:200比例稀二抗500 μL避光孵育1 h,PBS润洗细胞2次,弃上清。加入200 μL的DAPI染色30 min。载玻片滴20 μL样本,加1滴DAPI混匀,加盖玻片,激光扫描共聚焦显微镜观察。
1.9 化学比色法检测各组CD4+ T内caspase活性取收集1×106各组小鼠CD4+ T细胞,PBS洗涤2次,弃上清,加入250 μL预冷的Lysis buffer混匀,冰浴10 min将样品细胞裂解,1000 g离心5 min,收上清转移至EP管中。检测取96孔培养板中进行,反应体系包括:100 μg蛋白(体积50 μL)、50 μL现配的反应液、5 μL的caspase比色底物,37 ℃避光孵育2 h,Spectra MR全功能酶标仪上检测405 nm处的吸光度值。实验设调零孔组2个,一组为不加蛋白样本组,另一组为不加比色底物组,剩余体积均由稀释液补足。各实验组设2个空白孔。
1.10 统计学分析采用SPSS17.0统计软件,数据采用均数±标准差表示,组间样本比较采用方差分析,两两比较采用方差齐性检验,若方差齐性则使用LSD检验,方差不齐采用Dennett t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠脾脏CD4+ T细胞纯度从脾脏分离CD4+ T细胞,通过流式细胞仪检测提取的正常小鼠脾脏CD4+ T细胞的纯度达到92.9%。胎盘蓝染色活细胞率达到98%。
2.2 CD4+ T细胞内TIPE2蛋白表达(图 2)
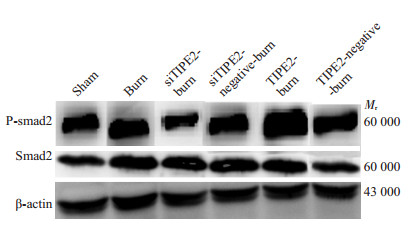
|
图 2 CD4+ T内Smad2和P-Smad2蛋白表达 Figure 2 Expressions of Smad2/P-smad2 in CD4+ T cells |
Western blot检测结果显示,TIPE2基因沉默使小鼠脾脏CD4+ T淋巴细胞TIPE2表达下调>70%;TIPE2-burn组TIPE2蛋白表达使小鼠脾脏CD4+ T淋巴细胞TIPE2表达上调>50%。
2.3 各组CD4+ T细胞凋亡率比较CD4+ T调亡率TIPE2-burn组凋亡率最高(69.8%),而siTIPE2-burn组CD4+ T调亡率为12.33%,与Sham组(10.82%)无统计学差异,但显著低于其余5组(P < 0.01)。
2.4 CD4+ T内Smad2/Smad3、P-Smad2/P-Smad3和Bcl-2/Bim蛋白表达从图 2、3表 1、2可以看出,burn组Smad2/Smad3和P-smad2/P-Smad3较sham组和siTIPE2-burn组升高;siTIPE2-burn组Smad2/Smad3无明显降低,P-smad2/ P-Smad3表达较其余组显著降低(P < 0.05)。TIPE2-burn组Smad2/Smad3较sham组明显升高(P < 0.05),较其余组无统计学意义,P-smad2/P-Smad3表达较其余组显著升高(P < 0.05)。再结合图 4、表 3可见,siTIPE2-burn组Bcl-2的表达升高(P < 0.05),Bim的表达则降低(P < 0.05)。TIPE2-burn组反之。
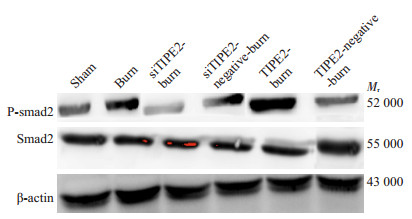
|
图 3 Western blot检测CD4+ T内Smad3和P-Smad3蛋白表达 Figure 3 Expressions of Smad3/P-Smad3 in CD4+ T cells |
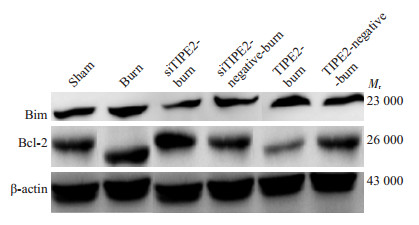
|
图 4 各组小鼠脾脏CD4+ T内Bcl-2/Bim蛋白表达 Figure 4 Expressions of Bcl-2/Bim in CD4+ T cells |
| 表 1 各组小鼠脾脏CD4+T内Smad2/P-Smad2蛋白表达比较 Table 1 Expressions of Smad2/P-Smad2 in CD4+T lymphocytes (Mean±SD) |
| 表 2 各组小鼠脾脏CD4+T内Smad3/P-Smad3蛋白表达比较 Table 2 Expressions of Smad3/P-Smad3 in CD4+ T lymphocytes (Mean±SD) |
| 表 3 各组小鼠脾脏CD4+T内Bcl-2/Bim蛋白表达比较 Table 3 Expressions of Bcl-2/Bim in CD4+ T lymphocytes (Mean±SD) |
siTIPE2-burn组线粒体膜电位为(97.50±2.40)%,较sham组(98.20±1.20)%外其余组比较升高(P < 0.05)。TIPE2-burn组CD4+ T内线粒体膜电位为(70.90±1.4)5%,较其余组降低(P < 0.01)。
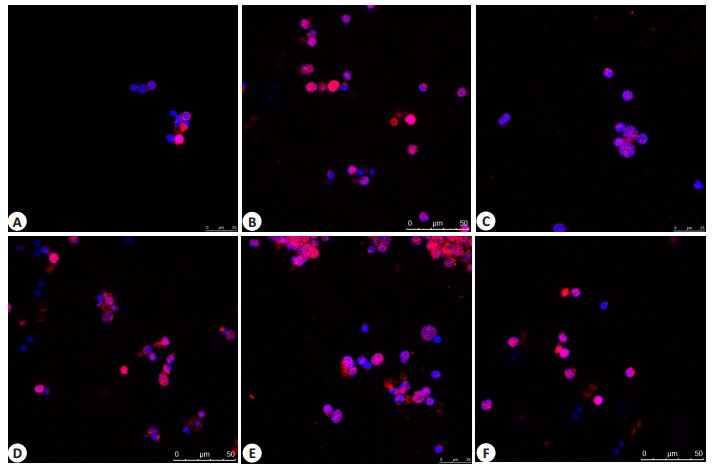
2.6 CD4+ T细胞色素C表达(图 5)
|
图 5 各组CD4+ T细胞色素C表达 Figure 5 Changes in cytochrome C in CD4+ T cells. The cytochrome C protein was directly labeled as red by the red pigment, and the DAPI was stained with blue. A: Sham; B: Burn; C: siTIPE2-burn; D: siTIPE2-negative-burn; E: TIPE2-burn; F: TIPE2-negative -burn. |
siTIPE2-burn组细胞色素C水平为33.50±3.40%,较除sham组(23.20±3.40)%外降低,(P < 0.05);TIPE2-burn组细胞色素C水平为(51.90±3.41)%,较其余组有所升高(P < 0.05)。
2.7 化学比色法检测各组CD4+ T内caspase活性siTIPE2-burn组CD4+ T内caspase-3较sham组,burn组,siTIPE2-negative-burn组和TIPE2-negativeburn略降低,但无统计学意义;较TIPE2-burn组降低(P < 0.01),caspase-8、caspase-9活性较其余组降低(P < 0.05)。TIPE2-burn组caspase-3、caspase-8、caspase-9活性较其他组均升高(P < 0.05,表 4)。
| 表 4 CD4+T内caspase的活性变化比较 Table 4 Caspase activity of T CD4+ cells in each group (Mean±SD) |
细胞免疫的状态被认为与脓毒血症的发生和发展密切相关。免疫细胞的凋亡是脓毒症介导免疫抑制的主要原因。动物研究证实脓毒症可以导致严重免疫细胞凋亡。大量动物和人研究证实在脓毒血症外周和脾脏淋巴细胞减少,凋亡是淋巴细胞减少的主要的机制。防止T淋巴细胞凋亡可以增强宿主抵抗脓毒血症的能力。有研究发现抗凋亡免疫治疗可以改善其生存率。因此,T淋巴细胞凋亡机制和凋亡预防是脓毒症新的研究及治疗靶点[9-12]。降低脓毒症死亡率需要从预防免疫T细胞减少,加速其功能恢复,阻断免疫抑制通路的研究着手[13-14]。业已明确,脓毒症时调节T细胞通过膜结合TGFβ1通路,参与了效应T细胞的凋亡[15-16, 18]。其中线粒体通过释放凋亡基因在凋亡中起着关键性作用[17, 19]。
2008年Sun等[5]发现TIPE2以来,越来越多的证据证实TIPE2在维持免疫稳态中起着重要作用。主要通过Toll样受体信号通路和T细胞受体进行调节,另据报道小剂量内毒素攻击小鼠模型,与正常野生型组相比,TIPE2基因敲除组出现明显休克反应[5]。研究说明TIPE2在急、慢性炎症病理过程中具有潜在调节效应[5-6, 20]。有趣的是TIPE2在炎症组织中高表达,在正常组织少量表达或无表达[21-22]。因此推测TIPE2是防止机体过度免疫反应和维持免疫稳态的重要调节器。TIPE2与TNFAIP8家族其它成员有基因同源性,其被认为有调节凋亡的功能[23-25]。有资料证实,内毒素刺激巨噬细胞TIPE2可下调多条炎症相关信号转导通路,减弱转录因子激活蛋白-1的活性。并且TIPE2基因缺陷细胞呈现对TLR和T细胞受体信号活化的高反应性[5, 20, 26]。TIPE2参与机体免疫动态平衡调控过程的分子机制可能与其结合caspase-8有关。先前研究证实TIPE2蛋白存在于CD4+ T细胞的胞浆中,沉默TIPE2基因表达后,小鼠脾T淋巴细胞增殖反应明显增强,凋亡减少,提示TIPE2的表达可促进T淋巴细胞的凋亡[7-8],我们推测TIPE2参与了TGF-β1信号通路介导CD4+ T细胞凋亡过程。本研究旨在探讨通过体内实验siRNA沉默TIPE2表达下调对急性损伤后CD4+ T细胞介导的凋亡的影响。
本研究发现,burn组Smad2/Smad3磷酸化明显增强,TIPE2基因沉默能够抑制Smad2/Smad3的活化。结果提示沉默TIPE2基因表达后,降低了小鼠脾T淋巴细胞TGFβ1下游信号分子Smad2/Smad3活化,从而降低CD4+ T内促调亡蛋白Bim表达,促进抗调亡蛋白Bcl-2表达,从而降低了小鼠脾T淋巴细胞的凋亡。反推TIPE2可以减少脓毒症Bcl-2蛋白表达,增加Bim蛋白表达,提示TIPE2作为一种重要的负向调控分子,具有促进正常及烧伤后脓毒症小鼠脾CD4+ T淋巴细胞凋亡的作用,机制可能通过活化的TGFβ1使Smad2/ Smad3发生磷酸化而被激活,受到Bcl-2家族的促凋亡和抗凋亡蛋白的调节,通过细胞色素C的释放caspase-9。最终活化的caspase-8、caspase-9都通过激活下游的caspase-3介导T细胞的调亡。
总之,TIPE2作为一种重要的负向调控分子与机体细胞免疫功能异常密切相关,很可能是体内关键的细胞免疫调节因子之一,其确切作用及关键环节值得深入探讨。本研究证实TIPE2促进严重烧伤后脾脏T淋巴细胞的凋亡,这对于从新的角度深入认识TIPE2在烧伤脓毒症发病中的地位具有重要理论意义和临床价值,并通过小RNA干扰技术可对TIPE2表达进行干预,为脓毒症免疫机制和诊治研究提供新方向。今后仍需进一步扩大样本量,对其结论进行充分验证。
| [1] | Kumar G, Kumar N, Taneja A, et al. Nationwide trends of severe sepsis in the 21st century (2000-2007)[J]. Chest,2011, 140 (5) : 1223-31. DOI: 10.1378/chest.11-0352. |
| [2] | Zhang QH, Chen Q, Kang JR, et al. Treatment with gelsolin reduces brain inflammation and apoptotic signaling in mice following thermal injury[J]. J Neuroinflammation,2011, 8 (1) : 118. DOI: 10.1186/1742-2094-8-118. |
| [3] | Russell JA. Management of sepsis[J]. Engl J Med,2006, 355 : 1699-713. DOI: 10.1056/NEJMra043632. |
| [4] | Jiang LN, Yao YM, Sheng ZY. The role of regulatory T cells in the pathogenesis of sepsis and its clinical implication[J]. J Interferon Cytokine Res,2012, 32 (8) : 341-9. DOI: 10.1089/jir.2011.0080. |
| [5] | Sun HH, Gong SY, Carmody RJ, et al. TIPE2, a negative regulator of innate and adaptive immunity that maintains immune homeostasis[J]. Cell,2008, 133 (3) : 415-26. DOI: 10.1016/j.cell.2008.03.026. |
| [6] | Li D, Song L, Fan Y, et al. Down-regulation of TIPE2 mRNA expression in peripheral blood mononuclear cells from patients with systemic lupus erythematosus[J]. Clin Immunol,2009, 133 (3) : 422-7. DOI: 10.1016/j.clim.2009.08.014. |
| [7] | Luan YY, Yao YM, Zhang L, et al. Expression of tumor necrosis factor-alpha induced protein 8 like-2 contributes to the immunosuppressive property of CD4(+)CD25(+) regulatory T cells in mice[J]. Mol Immunol,2011, 49 (1/2) : 219-26. |
| [8] | Jiang LN, Yao YM, Zhu XM, et al. The effect of tumor necrosis factor-α-induced protein 8 like-2 on immune response of CD4+ T lymphocytes in mice after thermal injury[J]. Eur Inflamm,2013, 11 (1) : 83-98. |
| [9] | Wesche D, Lomas-Neira J, Perl M, et al. Ayala A:leukocyteapoptosis and its significance in sepsis and shock[J]. Leukoc Biol,2005, 78 (2) : 325-37. DOI: 10.1189/jlb.0105017. |
| [10] | Bandyopadhyay G, De A, LaudanskiK, et al. Negative signaling contributes to T-cell anergy in traumapatients[J]. Crit Care Med Crit Care Med,2007, 35 (3) : 794-801. DOI: 10.1097/01.CCM.0000256847.61085.A5. |
| [11] | Chang K, Unsinger J, Davis C, et al. Multiple triggers of cell death in sepsis:death receptor andmitochondrial-mediated apoptosis[J]. FASEB,2007, 21 (3) : 708-19. DOI: 10.1096/fj.06-6805com. |
| [12] | Kasten K, Tschöp J, Adediran S, et al. T cells are potent early mediators of the host response to sepsis[J]. Shock,2010, 34 (4) : 327-36. DOI: 10.1097/SHK.0b013e3181e14c2e. |
| [13] | Cabrera-Perez J, Condotta S, Badovinac V, et al. Impact of sepsis on CD4 T cell immunity[J]. Leukoc Biol,2014, 96 (5) : 767-77. DOI: 10.1189/jlb.5MR0114-067R. |
| [14] | Kim JS, Kim SJ, Lee SM. Genipin attenuates sepsis-induced immunosuppression through inhibition of T lymphocyte apoptosis[J]. Int Immunopharmacol,2015, 27 (1) : 15-23. DOI: 10.1016/j.intimp.2015.04.034. |
| [15] | 尹承芬, 秦庆华, 董宁, 等. 调节性T细胞通过膜结合转化生长因子β1影响效应性T细胞凋亡[J]. 中国急救复苏与灾害医学杂志,2013, 8 (3) : 215-9. |
| [16] | Luan YY, Yin CF, Qin QH, et al. Effect of regulatory T cells on promoting apoptosisof T lymphocyte and its regulatory mechanism in sepsis[J]. J Interferon Cytokine Res,2015, 35 (12) : 969-80. DOI: 10.1089/jir.2014.0235. |
| [17] | Ten Dijke P, Hill C. New insights into TGF-beta-Smadsignaling[J]. Trends Biochem,2004, 29 (5) : 265-73. DOI: 10.1016/j.tibs.2004.03.008. |
| [18] | 秦庆华.调节性T细胞促进效应T细胞凋亡在脓毒症免疫抑制中的作用及机制研究[D].广州:南方医科大学. 2013:1-3. http://cdmd.cnki.com.cn/article/cdmd-90023-1014100566.htm |
| [19] | Gillies LA, Kuwana T. Apoptosis regulation at the mitochondrial outer membrane[J]. J Cell Biochem,2014, 115 (4) : 632-40. DOI: 10.1002/jcb.24709. |
| [20] | Freundt EC, Bidere N, Lenardo MJ. A different TIPE of immune homeostasis[J]. Cell,2008, 133 (3) : 401-2. DOI: 10.1016/j.cell.2008.04.017. |
| [21] | Zhang GZ, Hao CY, Lou YW, et al. Tissue-specific expression of TIPE2 provides insights into its function[J]. Mol Immunol,2010, 47 (15) : 2435-42. DOI: 10.1016/j.molimm.2010.06.016. |
| [22] | Kumar D, GokhaleP, BroustasC, et al. Expression of SCC-S2, an antiapoptoticmolecule, correlates with enhanced proliferation and tumorigenicity of MDA-MB 435 cells[J]. Oncogene,2004, 23 (2) : 612-6. DOI: 10.1038/sj.onc.1207123. |
| [23] | Zhang CB, Chakravarty D, Sakabe I, et al. Role of SCC-S2 in experimental metastasis and modulation of VEGFR-2, MMP-1, and MMP-9 expression[J]. Mol Ther,2006, 13 (5) : 947-55. DOI: 10.1016/j.ymthe.2005.11.020. |
| [24] | Woodward MJ, De Boer J, Heidorn S, et al. Tnfaip8 is an essential gene for the regulation of glucocorticoid-mediated apoptosis of thymocytes[J]. Cell Death Differ,2010, 17 (2) : 316-23. DOI: 10.1038/cdd.2009.125. |
| [25] | Zhang X, Wang JW, Fan C, et al. Crystal structure of TIPE2 provides insights into immune homeostasis[J]. Nat Struct Mol Biol,2009, 16 (1) : 89-90. DOI: 10.1038/nsmb.1522. |
 2016, Vol. 36
2016, Vol. 36
