2. 成都七中, 四川成都 610041 ;
3. 西南医科大学附属中医院综合内科, 四川泸州 646000
2. Chengdu No.7 High School, Chengdu 610041, China ;
3. Department of General Medicine, Affiliated Hospital of Southwest Medical University, Luzhou 646000, China
龋病是一种多因素相关的感染性疾病,其发生原因主要包括宿主因素(唾液,牙齿表面解剖形态和矿化程度,机体健康、营养和激素水平等)和一些外源性因素(食物,定植在牙齿表面的微生物菌群,口腔卫生情况,和相关氟化物的使用情况等)[1]。近年来,已有大量关于龋病病因的探究,主要从唾液功能方面、机体免疫方面、龋病致病菌方面(尤其是变异链球菌等产酸、耐酸菌)以及氟化物应用等方面做具体分析,得出一系列结论却未见重大突破。而成人猖獗龋,作为一种特殊类型的急性龋,与其相关的研究报道较为少见,值得深入探讨。
猖獗龋又称猛性龋,主要的表现为病情发展很快,多个牙齿、牙面在6~12个月内患龋,并且易导致牙髓感染,因此,在治疗的过程中存在较大的难度[2]。猖獗龋常见于颌面部及头颈部接受放化疗的患者、舍格伦综合征和一些有严重全身性疾病的患者,主要原因是其涎腺遭到破坏而发生功能障碍导致唾液分泌减少,从而引起口腔微生物群落发生较大变化而发生[3]。另外猛性龋的发生与生活习惯有着密切关联[4],很多研究表明,夜间进食、蔗糖摄入频率高是导致猛性龋的主要原因[5],还可见于药物滥用,尤其是甲基苯丙胺成瘾[6]、患有抑郁症[7]和艾滋病[8]的患者。当猖獗龋发生于儿童时期时,称之为奶瓶龋或早发性儿童龋;当发生于成年时期时,Akpata[9]等简单称之为“成人重型龋齿”,实际上,人们对成人猖獗龋的关注度远不如儿童,且其临床描述较为模糊,或许没有严格的临床诊断标准也是关于成人猖獗龋鲜见报道的一个原因。
对于成人猖獗龋病因的研究中,尚未得出明确致病机制。本例患者无既往系统病病史,未主诉有不良嗜好,以猖獗龋为首发症状,较为罕见。因此我们开展了对该患者口腔不同标本的微生物组成和结构分析,试图探索其微生物病原菌。
1 资料和方法 1.1 患者信息患者编号RC(rampant caries),男性,33岁,汉族。有饮用冰红茶、凉茶习惯(每日1~2瓶);多个牙区龋坏两年,无既往系统病病史。口腔检查:33牙、42牙深龋;11~17牙、21~28牙、34~38牙、43~47牙残根。
1.2 实验方法 1.2.1 取样方法取样全菌斑(A)、龋损(Q)、唾液(T,少,取样困难)、黏膜(N)样本,采集前嘱受检者温开水轻轻漱去口中的食物残渣。集合菌斑样本置于含1 mL无菌转运液的EP管中,管口用0.2 mL石蜡油封闭,置于冰上,30 min内转运接种。
(1)唾液样本收集:采集受检人非刺激性唾液3 mL;(2)全菌斑收集:在棉卷隔湿下用龈上刮治器刮取全口龈上菌斑,吹干牙面,再刮取龈下菌斑,集合在一起;(3)龋损菌斑:用刮治器刮取龋损处集合菌斑样本;(4)口腔黏膜拭子:手持采样拭子伸进口腔一侧,在内壁黏膜旋转10~15圈,然后再上下移动刮拭5~10次,力度适中,以紧贴口腔内壁黏膜为宜,确保采样拭头各处都能蘸取口腔黏膜脱落细胞;将采样拭子手柄折断弃去,采样头放入采样试管内。
1.2.2 细菌分离培养鉴定将菌斑和黏膜样本在振荡器反复震荡混匀,弃棉签头备用。4种样本原代涂片镜检,革兰染色观察,并拍照。取原代样本20 μL用三角推棒均匀涂布于选择培养基科马嘉平板、轻唾培养基平板(MS)、Rogosa平板用于选择培养念珠菌、链球菌和乳杆菌。
将样本采用BHI培养基10倍连续梯度稀释法, 将稀释度为10-2~10-6的样本20 μL用三角推棒均匀涂布于BHI血平板,放入37 ℃厌氧环境培养24~48 h。记录血平板中菌落外形、颜色、透明度、光泽、凸度、硬度、边缘、溶血情况,挑取外形不同的菌落传代分离培养,采用梅里埃生化鉴定仪和16S rDNA序列进化分析联合鉴定未知细菌。
1.2.2.1 梅里埃生化鉴定仪根据细菌初步革兰染色特征选择鉴定卡片(GN/GP/NH/ANC等),并根据说明书要求将培养了18~24 h的菌苔用0.45%专用生理盐水配制成规定浊度的菌悬液, 利用梅里埃全自动细菌鉴定仪(Vitek2 compact system,美国)进行鉴定,读取结果。
1.2.2.2 16S rDNA序列进化分析挑取适量菌苔, 按照细菌DNA提取试剂盒(天根生化科技有限公司,北京,中国)说明书的步骤提取细菌DNA。用通用引物27F和1492R扩增16S rDNA基因序列,1%琼脂糖凝胶电泳检测PCR产物条带约为1.5 kb,送PCR产物至上海生工测序。将测序所得的拼接序列与HOMD(human oral microbiome database)数据库和EzTaxon数据库(EzTaxon server 2.1)中的国际标准模式菌株进行BLAST序列比对, 根据进化树获得亲缘关系最近、相似度最高的菌种名称。
1.2.3 细菌DNA水平检测提取四种样本的全菌DNA;另选取既往提取的年龄相当,性别男性的两例健康志愿者(H1,H2)和两例猖獗龋患者(RC1, RC2)DNA,进行变异链球菌的相对含量检测和微生物组结构分析。
1.2.3.1 qPCR检测变异链球菌相对含量使用BioRad CFX96荧光定量PCR仪,按照SYBR Green Ⅰ(TaKaRa,中国)嵌合荧光法进行qPCR扩增,获得各目的基因产物的Cq值,并计算相对含量。
1.2.3.2 DGGE分析微生物组结构使用引物Bac1(5'-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGG GCACGGGGGGACTACGT-GCCAGCAGCC-3)'、Bac2(5'-GGACTACCAGGGTATCTACTAATCC-3)'进行常规PCR,使用Bio-Rad D-Code system(Bio-Rad公司,美国)对PCR扩增产物进行变性梯度凝胶电泳(denaturing gradient gel electrophoresis, DGGE)电泳。丙烯酰胺凝胶质量分数为8%,变性剂浓度梯度质量分数为40%~60%(100%变性剂包含体积分数为40%的甲酰胺与7 mol/L的尿素),变性胶上表面加入5 mL无变性作用的积层凝胶。60 V恒定电压、58 ℃条件下,在1×TAE缓冲液(pH=8.5)中电泳16 h。电泳完成后,采用0.5 μg/mL溴化乙锭染色15 min,然后用1×TAE缓冲液漂洗去除多余染料,凝胶成像系统采集并记录DGGE凝胶的数码图。切取差异条带放入装有TAE的EP管中,溶胶后获取DNA,经测序PCR后送上海生工测序。
1.2.4 统计学分析采用SPSS20.0统计学软件的ANOVA方法及Image J软件分析实验结果。P < 0.05表示差异有统计学意义。
2 结果 2.1 实验室检查抽血查免疫全套检测免疫力及特异性免疫抗体。免疫抗体阴性,无自身免疫疾病。CD4、CD8数量基本正常,免疫功能基本正常。Anti-HIV阴性。但IgE升高明显(218.7 U/mL,正常值0.1~150 U/mL),中性分叶核细胞增高(7.56×109/L,正常值1.8~6.3×109/L),提示感染血象。
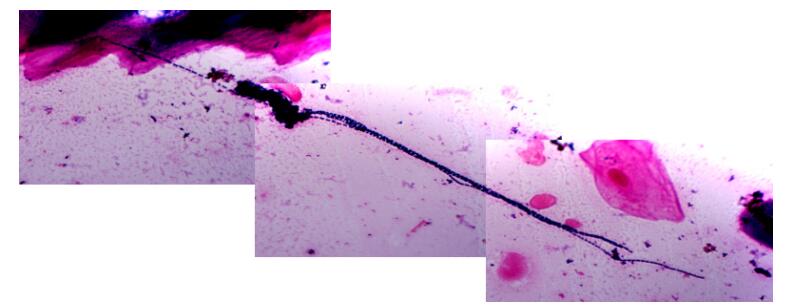
2.2 原代涂片镜检结果原代涂片发现唾液中有大量极长链的细菌,需要3~4个100×视野才能照完长链,如图 1;龋损样本中有螺旋体和弯曲菌,黏膜拭子涂片显示菌极少,有部分链球菌、杆菌和放线菌(结果未显示)。
|
图 1 唾液样本原代涂片镜检革兰染色图 Figure 1 Gram staining of the original saliva samples (Original magnification: ×1000). |
选择培养基科玛嘉中可见变异链球菌(C.albicans)在全菌斑中含量最多,为2100 CFU/mL,唾液中为550 CFU/mL(表 1)。4种样本中MS、Rogosa选择培养基中的链球菌和乳杆菌数量巨大,难以计数。基础培养基分离培养过程中并未见到原代涂片中极长链的细菌,唾液中总菌含量最高(7.6×107 CFU/mL),龋损中溶血菌含量最高(43.5%,表 2)。
| 表 1 初代科玛嘉平板中真菌的数量 Table 1 Numbers of fungi in the primary CHROMagar medium (20 μL) |
| 表 2 初代BHI血平板中的溶血菌数量 Table 2 Number of hemolytic bacteria in the BHI medium |
以全菌斑稀释10-4(A4),挑取不同外形的菌落,传代至纯种,经生化和DNA测序鉴定,结果如表 3所示。全菌斑分离出多种链球菌(如戈登链球菌、变异链球菌、中间链球菌、咽峡炎链球菌)、龋损菌斑中多次分离到变异链球菌以及苏黎世链球菌,Rogosa选择培养基分离了多种乳杆菌,另外还鉴定了栖牙普雷沃菌、具核梭杆菌、殊异韦荣菌、韦德纤毛菌和戴安娜月形单胞菌。
| 表 3 不同标本中细菌分离鉴定结果 Table 3 Identification results of bacterial colonies from the specimens |
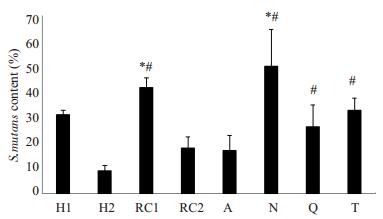
如图 2所示,变异链球菌(S.mutans)在4种样本中含量均较高,其中黏膜样本(N)的相对含量最高,与健康组H1、H2相比均有显著差异;Q和T中的变异链球菌相对含量也显著高于健康组中的H2(P < 0.05)。
|
图 2 qPCR检测S.mutans相对含量 Figure 2 S.mutans relative contents (%) quantified with qPCR. H1, H2: Two healthy volunteers; RC1, RC2: Two patients with rampant caries. *P < 0.05 vs H1; #P < 0.05 vs H2. |
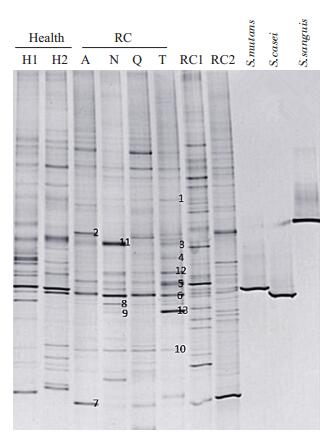
患者RC中A、N、Q和T与健康组(H1,H2)及另两例猖獗龋(RC1,RC2)相比,DGGE示(图 3)细菌多样性(条带数)明显降低,但丰度明显增强(条带亮度);T的多样性最高、N最少;变异链球菌在4种样本均有检出;血链球菌无明显条带;干酪乳杆菌有较弱条带。切取差异明显的13条带进行分子鉴定,其中5个条带为纤毛菌特征条带。
|
图 3 DGGE检测细菌多样性及目的条带测序鉴定 Figure 3 Bacterial diversity shown by DGGE and identification of the target bands by sequencing. The obvious different bands were cut for PCR and sequencing. 1: Leptotrichia sp.; 2: Leptotrichia wadei; 3: Leptotrichia shahii; 4: Leptotrichia buccalis; 5: Aggregatibacter segnis; 6: Leptotrichia hofstadii; 7:Corynebacterium matruchotii; 8: Neisseria flava; 9: Peptostreptococcus stomatis; 10:Neisseria bacilliformis; 11:Eubacterium nodatum; 12:Porphyromonas endodontalis; 13: Lactobacillus delbrueckii. |
本例患者自述爱喝冰红茶、凉茶。调查显示,市场上的冰红茶和凉茶PH呈酸性,且含有较多的蔗糖。蔗糖作为细菌代谢的底物,其致龋作用早已被人们所认识。在代谢过程中为细菌提供营养,其终末产物又可造成牙体硬组织的破坏。很多学者已对各种常见糖的致龋力做了深入的比较研究,各种碳水化合物中,蔗糖致平滑面龋的能力最强。菌斑中很多细菌可以代谢蔗糖,其中变异链球菌代谢蔗糖能力最强。控制龋病发生发展的因素很大程度上是由于包括唾液在内的机体固有的防御机制。唾液最重要的防御功能是冲洗和中和作用,表现为唾液的流量和缓冲能力[10]。本例患者唾液分泌较少,有研究证实,唾液流量的减少会导致龋病的快速进展并且唾液缓冲能力与龋病易感性相关[11]。所以该患者口腔自洁作用减弱,抗龋能力下降,唾液成为天然培养基,检出较多生长茂盛极长链的细菌,但随着人工培养,细菌的性状可能发生了改变,并没重现极长链细菌,根据后续分离培养、DGGE中菌属频度分析结合形态学特征,我们推断极长链菌可能是变异链球菌或纤毛菌。
大量报道显示,在猛性龋感染牙面上定殖着数量巨大的变异链球菌(S.mutans)和乳杆菌等细菌[12]。细菌分离鉴定发现该患者唾液中乳杆菌较多,乳杆菌可以利用蔗糖等碳水化合物代谢产生乳酸,使唾液中的PH长期处于酸性,促使牙齿脱钙,对龋病的进展有重要作用[13]。变异链球菌在龋病的进展过程中起着非常关键的作用[14]。我们采用细菌分离培养、形态学、生理生化、DNA分子鉴定等方法鉴定出变异链球菌在龋损、菌斑中检出频率较高;qPCR也显示变异链球菌在黏膜、唾液、龋损中相对含量显著高于健康组。这与报道中的结果一致,变异链球菌在该病的进程中是一个优势病原菌。
研究者也发现,在儿童猛性龋的菌斑生物膜中,除了分离到大量链球菌属外,一种机会致病真菌白念珠菌(C.albicans)也被频繁的检测到[15]。C.albicans是迄今为止,人口腔黏膜表面检出最多的真菌,它经常参与软组织上多种微生物生物膜的形成[16]。研究发现,在缺少蔗糖底物时,C.albicans与S.mutans的黏附作用较为微弱,但当存在蔗糖底物时,其相互黏附作用会大大增加。扫描电镜结果发现,球菌与真菌间产生的胞外多糖促成了它们之间的黏附作用[17]。或许这是本研究中q-PCR检测黏膜样本中S.mutans含量最高的原因。Falsetta等[18]发现C.albicans可以诱导S.mutans毒力因子gtfB、fabM的表达并且其产生的β-葡聚糖可以为gtfB提供位点而有助于胞外多糖基质网结构的形成。
我们首次分离到苏黎世链球菌(Streptococcus tigurinus),它在人口腔环境中的检出率非常高,它可导致严重的炎症,如感染性心内膜炎、骨髓炎、关节炎、脑膜炎等[19]。另外,S.tigurinus的侵袭力较强,一旦进入血液,会导致侵袭性感染[20]。DGGE检测细菌多样性及目的菌的相对含量发现,纤毛菌含量增高。近来,许多研究[21-23]发现龋损处纤毛菌被大量频繁的检出。它是一种革兰阴性厌氧菌,是一种潜在的致龋菌,可以发酵单糖和双糖产酸[24],Luo等[25]研究发现它只存在于患龋个体,且检出率高达50%,所以它很有可能和龋病有密切联系且在龋病的发生发展中起重要作用。另外猖獗龋患者和健康者相比,细菌多样性明显降低,但丰度明显增强,微生物生态失衡可能也是导致其猖獗龋发生的原因。
因此,我们推断该患者的病因主要是唾液减少导致包括变异链球菌、苏黎世链球菌等多种链球菌、纤毛菌、乳杆菌、放线菌、螺旋体、栖牙普雷沃菌、具核梭杆菌、殊异韦荣菌、新月单胞菌等多种致病微生物繁殖增多,细菌多样性减少所致。
| [1] | Lenander-Lumikari M, Loimaranta V. Saliva and dental caries[J]. Adv Dent Res,2000, 14 (1) : 40-7. DOI: 10.1177/08959374000140010601. |
| [2] | Navit S, Katiyar A, Samadi F, et al. Rehabilitation of severely mutilated teeth under general anesthesia in an emotionally immature child[J]. J Indian Soc Pedod Prev Dent,2010, 28 (1) : 42. DOI: 10.4103/0970-4388.60476. |
| [3] | 樊明文, 周学东. 牙体牙髓病学[M]. 北京: 人民卫生出版社, 2004 . |
| [4] | Manski MC, Parker ME. Early childhood caries:knowledge, attitudes, and practice behaviors of Maryland dental hygienists[J]. Am Dent hyg Assoc,2010, 84 (4) : 190-5. |
| [5] | Utreja D, Tewari A, Chawla HS. A study of influence of sugars on the modulations of dental plaque pH in children with rampant caries, moderate caries and no caries[J]. J Indian Soc Pedod Prev Dent,2010, 28 (4) : 278. DOI: 10.4103/0970-4388.76158. |
| [6] | Naidoo S, Smit D. Methamphetamine abuse:a review of the literature and case report in a young male[J]. SADJ,2011, 66 (3) : 124-7. |
| [7] | Friedlander AH, Norman DC. Late-life depression:Psychopathology, medical interventions, and dental implications[J]. Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2002, 94 (4) : 404-12. DOI: 10.1067/moe.2002.122434. |
| [8] | Chidzonga MM. HIV/AIDS orofacial lesions in 156 Zimbabwean patients at referral oral and maxillofacial surgical clinics[J]. Oral Dis,2003, 9 (6) : 317-22. DOI: 10.1034/j.1601-0825.2003.00962.x. |
| [9] | Akpata ES, Al-Attar A, Sharma PN. Factors associated with severe caries among adults in Kuwait[J]. Med Prin Pract,2009, 18 (2) : 93-9. DOI: 10.1159/000189805. |
| [10] | Lagerlöf F. Caries-protective factors in saliva[J]. Adv Dent Res,1994, 8 (2) : 229-38. |
| [11] | Edgar WM, Higham SM, Manning RH. Saliva stimulation and caries prevention[J]. Adv Dent Res,1994, 8 (2) : 239-45. |
| [12] | Matee MN, Mikx FM, Maselle SM, et al. Mutans streptococci and lactobacilli in breast-fed children with rampant caries[J]. Caries Res,1992, 26 (3) : 183-7. DOI: 10.1159/000261440. |
| [13] | Liu Y, Liu Z, Feng X, et al. The isolation and identification of pathogenic bacteria from rampant caries in children[J]. Hua Xi Kou Qiang Yi Xue Za Zhi,2001, 19 (4) : 219-21. |
| [14] | Smith EG, Spatafora GA. Gene regulation in S. mutans:complex control in a complex environment[J]. J Dent Res,2012, 91 (2) : 133-41. DOI: 10.1177/0022034511415415. |
| [15] | De Carvalho FG, Silva DS, Hebling J, et al. Presence of mutans Streptococci and Candida spp. in dental plaque/dentine of carious teeth and early childhood caries[J]. Arch Oral Biol,2006, 51 (11) : 1024-8. DOI: 10.1016/j.archoralbio.2006.06.001. |
| [16] | Harriott MM, Noverr MC. Importance of candida-bacterial polymicrobial biofilms in disease[J]. Trends Microbiol,2011, 19 (11) : 557-63. DOI: 10.1016/j.tim.2011.07.004. |
| [17] | Metwalli KH, Khan SA, Krom BP. Streptococcus mutans, Candida albicans, and the human mouth:A sticky situation[J]. PLoS Pathog,2013, 9 (10) : e1003616. DOI: 10.1371/journal.ppat.1003616. |
| [18] | Falsetta ML, Klein MI, Colonne PM, et al. Symbiotic relationship between streptococcus mutans and Candida albicans synergizes virulence of plaque biofilms in vivo[J]. Infect Immun,2014, 82 (5) : 1968-81. DOI: 10.1128/IAI.00087-14. |
| [19] | Zbinden A, Bostanci N, Belibasakis GN. The novel species Streptococcus tigurinus and its association with oral infection[J]. Virulence,2015, 6 (3, SI) : 177-82. DOI: 10.4161/21505594.2014.970472. |
| [20] | Zbinden A, Mueller NJ, Tarr PE, et al. Streptococcus tigurinus, a novel member of the Streptococcus mitis group, causes invasive infections[J]. J Clin Microbiol,2012, 50 (9) : 2969-73. DOI: 10.1128/JCM.00849-12. |
| [21] | Johansson I, Witkowska E, Kaveh B, et al. The microbiome in populations with a low and high prevalence of caries[J]. J Dent Res,2016, 95 (1) : 80-6. DOI: 10.1177/0022034515609554. |
| [22] | Simon-Soro A, Mira A. Solving the etiology of dental caries[J]. Trends Microbiol,2015, 23 (2) : 76-82. DOI: 10.1016/j.tim.2014.10.010. |
| [23] | Belstrom D, Fiehn NE, Nielsen CH, et al. Differentiation of salivary bacterial profiles of subjects with periodontitis and dental caries[J]. J Oral Microbiol,2015, 7 : 27429-27429. |
| [24] | Thompson J, Pikis A. Metabolism of sugars by genetically diverse species of oral Leptotrichia[J]. Mol Oral Microbiol,2012, 27 (1) : 34-44. DOI: 10.1111/omi.2012.27.issue-1. |
| [25] | Luo AH, Yang DQ, Xin BC, et al. Microbial profiles in saliva from children with and without caries in mixed dentition[J]. Oral Dis,2012, 18 (6) : 595-601. DOI: 10.1111/odi.2012.18.issue-6. |
 2016, Vol. 36
2016, Vol. 36
