卒中后抑郁症(PSD)是继发生于脑卒中后的一种抑郁状态,根据相关统计资料显示,目前该病发生率大致为36.4%~43.7%[1]。大部分患者病程持续时间较长,长期的抑郁状态对机体神经系统、内分泌系统,甚至肠粘膜屏障功能均会造成一定程度的损害[2]。现代医学认为中风后抑郁症的发生和脑实质受损后神经生物学功能障碍以及下丘脑—垂体—肾上腺轴的功能障碍有关[3]。根据既往有关功能性抑郁症患者病理、生理研究资料来看,在这些患者中出现的抑郁状态与肠道菌群失调密切相关[4],且最近研究表明通过调节肠道菌群失调状态甚至可以在一定程度上改善患者的抑郁状态[5-6]。卒中后抑郁症与功能性抑郁症发病时间及病理生理基础明显不同,但是患病后出现的长期抑郁状态是二者共同点[7]。由于卒中后抑郁患者肠道菌群的变化情况尚缺乏相应的研究,为解决这一问题,本研究以卒中后抑郁患者及健康对照者为研究对象,利用Roche/45高通量测序平台对粪便标本中的16S RNA V3区进行定性分析,以明确卒中后抑郁患者随着情绪行为方面改变和肠道微生态环境变化之间的联系,为卒中后抑郁症的治疗提供新的靶点。
1 资料和方法 1.1 实验材料主要试剂和仪器:QIAamp DNA Stool Mini Kit,德国,QLAGEN;QIAquick Gel extraction Kit,德国,QLAGEN;Glass beads 100 μm,美国,Sigma;Agarose,上海,Gene;NanoDrop ND-1000 sspectrophotometer,美国,Electron Corporation;FastPrep mini bead beater,美国,Thereto Electron Corporation;Centrifuge,美国,Therrno Electron Corporation;UVI fel documentation system,美国,UVItec Electrophoresis,美国,Bio-Rad Laboratories。
1.2 临床资料32例研究对象来自陕西中医药大学附属医院,均为首次发生中风,男性18例女性14例;年龄最小者40岁,年龄最大65岁;中风病程均在4周内;脑出血10例,脑缺血19例混合型3例。对照组30例来自陕西中医药大学附属医院健康体检中心并经过MINI检查排除精神疾病。所有病例均符合第4届全国脑血管学术会议修订的中风病诊断标准和《中国精神疾病分类方案与诊断标准》(CCMD-2R)抑郁症诊断标准。
1.3 标本收集收集符合上述标准患者的清晨第1次粪便中段标本约10 g,精确称取粪便样本100 mg放入新的2 mL无菌离心管中3份,并按入组先后编号,其中2份进行基因组DNA提取效率比较试验及测序,其余1份备用。所有粪便标本在采集后1 min内处理完毕,随即保存于-80 ℃冰箱中以便后期使用。
1.4 粪便细菌基因组DNA的抽提按照试剂盒说明书要求快速抽提样品中的所有细菌基因组DNA并均保存于-20 ℃冰箱备用。
1.5 PCR扩增
采用16S rRNA基因V3可变区作为靶标进行PCR扩增。扩增16S rDNA基因的V3可变区引物为341F:5-GTATTACCGCGGCTGCTGG-3',534R:5'-CGCCC GCCGCGCGCGGCGGGCGGGGCGGGGCACGGGGGGACCCTACGGAGGCAG-3'(下游引物含40 bp GC夹子)。参照Muyzerdeng方法,对16S rRNA基因的V3可变区进行扩增。本实验采用了两步法进行PCR扩增。第1步采用Touchdown PCR。反应程序为:95 ℃预变性3 min;95 ℃变性1 min,65 ℃退火1 min(每两个循环降低1 ℃),72 ℃延伸1 min,执行20个循环;95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,执行5个循环,16 ℃维持10 min。
1.6 二代高通量测序与技术—454焦磷酸测序采用Barcoded 454测序方法对肠道菌群结构组成进行分析,应用16S rRNA基因的V3可变区通用引物27F 5-AGAGTTTGATCCTGGCTCAG-3',5338 S'-TT ACCGCGGCTGCTGGCAC-3'进行PCR扩增。为进行454高通量定向平行多样本检测,在上下游引物的5'端加上8个碱基(NNNNNNNN)的唯一的Barcode,用于454焦磷酸测序后识别不同的样本。PCR扩增的反应程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,执行30个循环;72 ℃ 7 min,4 ℃维持。而后用1.0%的琼脂糖凝胶检测扩增结果。扩增产物应用QIAuick Gel Extraction Kit进行割胶回收,回收产物用50 μL EB buffer洗脱。而后经核酸定量仪NanoDrop ND-1000进行核酸定量检测,并进行核酸电泳半定量确认。此后将59个样本的PCR产物进行等分子数混合,混合后样本在GS FLX(lbche)平台上进行行454测序。根据碱基配对时释放的焦磷酸将荧光素氧化而释放的光信号,读取测试原始序列。
1.7 生物信息学分析454测序后得到的原始序列数据,需要筛选出质量较高的符合要求的有效序列,根据Barcode所含信息可以把含有总序列中的单个样本来源的序列数区分,从而进行样本问的差异比较。这样筛选出来的有效序列去除所有的引物和Barcode,将序列调整为5'-3'方向,生成OTU,便于进行下一步分析。通过Mothur软件用相似度水平为97%的OTU来分析菌群多样性(Shannon指数,simpson指数,Evenness指数),丰度(Chao指数,ACE指数)以及相似性曲线。
1.8 细菌分类学比对,聚类及统计分析16S rDNA基因片段的种类鉴定是通过WND-BLAST方法和RDPⅡ数据库中的高质量16S序列数据库,与最相似的序列对比。将所有细菌的分类学进行统计,并进行主成分分析(PCA)。通过分析不同样品的OTU组成可以反映样品间的差异和距离,PCA运用方差分解,将多组数据的差异反映在二维坐标图上坐标轴为能够最大程度反映方差的两个特征,从而观察不同样本不同组别间微生物群落菌群多样性的分类学差异及与疾病关系密切的细菌种属。
1.9 统计方法采用SPSS 19.0统计软件进行分析。细菌种属或者OTUs组间统计学差异,采用Mann-Whitney检验,t检验,相关性分析Spearman Rank相关检验。P < 0.05提示差异具有统计学意义。
2 结果 2.1 454焦磷酸测序结果分析对62例粪便标本(32例PSD患者和30例正常健康成人组)行454焦磷酸测序后,总共获得超过1 563 738条有效的16S rRNA基因序列,原始序列经过筛选优化之后得到1 496 238条高质量的序列,平均每个样品24 133条序列,卒中后抑郁症患者组32个样品共752 047条序列,健康对照组744 191条序列。在对以上数据分析过程中我们使用Good's Coverage指数来分析每组样品的测序覆盖率,结果显示各组的测序覆盖率均达到97%以上,通过对各样品进行稀释曲线分析提示测序每增加100序列产生少于1个新种系型细菌,说明本研究中的测序序列代表了环境中97%以上的细菌种系型。
通过对两组样品OTU种类对比可以看出PSD患者肠道微生态环境中检测到的OTU种类明显高于健康人群,这说明了PSD患者群体中微生态环境发生了明显改变(图 1)。
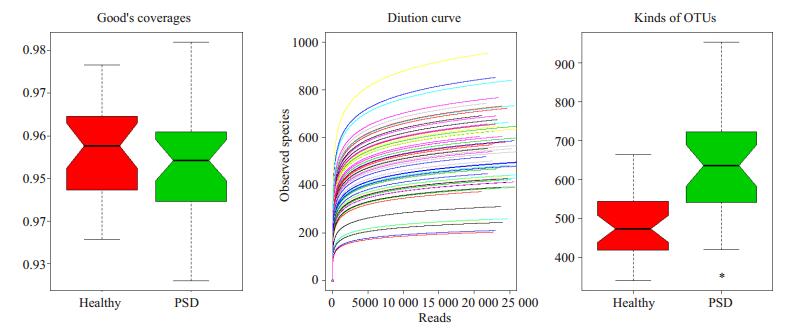
|
图 1 两组样品Good's Coverage指数、稀释曲线及OTU种类对比分析 Figure 1 Results of Good's Coverage index, dilution curve and types of OTUs in the two groups. The type of OTU in PSD group was significantly more than that in healthy group (*P < 0.05). |
对两组样品chao1指数与ACE指数进行对比,数据显示PSD组样品chao1指数及ACE指数均高于正常健康对照组(P < 0.01,图 2)。
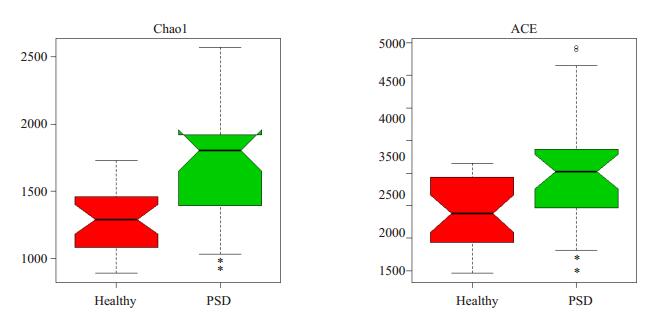
|
图 2 两组样品chao1指数与ACE指数对比结果 Figure 2 Results of Chao1 index and ACE index of the two groups. The Chao1 index and ACE index of PSD group were higher than those in healthy adults (**P < 0.01). |
对两组样品香农维纳指数(Shannon),辛普森指数(Simpion)及均一度指数(Evenness)对比结果如下,PSD组样品Shannon指数明显高于健康对照组(P < 0.05),Simpion指数有所下降但是与正常健康对照组相比二者无统计学意义(P > 0.05),Evenness指数较正常健康对照组有所升高,同样也不存在统计学差异(P > 0.05,图 3)。
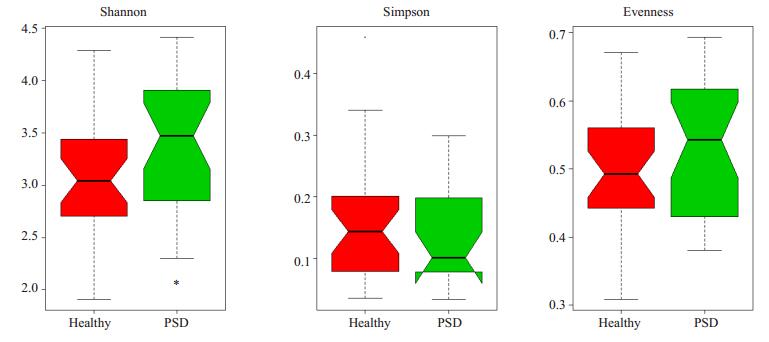
|
图 3 两组样品Shannon指数,Simpion指数及Evenness指数对比结果 Figure 3 Results of Shannon index, Simpion index and Evenness index in the two groups (*P > 0.05). |
通过对测序样品的序列进行比对分析,我们研究了卒中后抑郁症患者粪便微生物群落结构,同时也与相对应健康人的粪便微生物群落进行了两两对比。具体结果如下。
2.3.1 门(Phylum)的水平比较在门(Phylum)的水平上,两组样品的微生物群落结构及其相对丰度结果:PSD患者组样品在门水平上拟杆菌门(63.41±9.55)%,变形菌门(2.89±0.78)%,梭杆菌门(1.83±0.58)%均较正常健康对照组明显增加(P < 0.05),厚壁菌门(30.4±5.9)%数量明显减少(P < 0.05,图 4)。
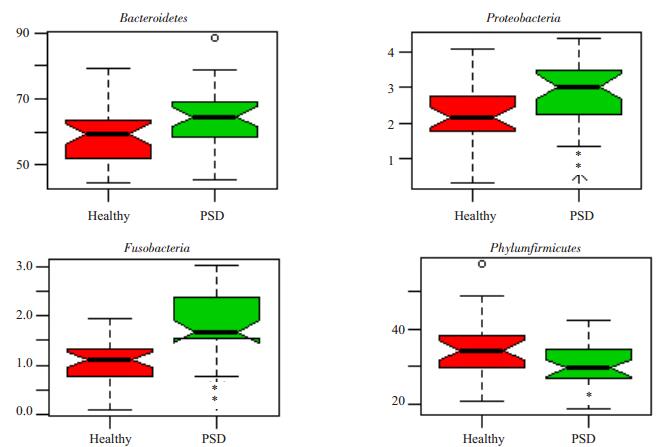
|
图 4 两组样品的微生物群落结构及其相对丰度在门水平对比结果 Figure 4 Microbial community structure and relative abundance of the two groups compared at the level of the Phylum (**P < 0.05). |
科(Family)的水平上两组样品的微生物群落结构及其相对丰度结果:科水平上PSD组样品氨基酸球菌科(Acidaminococcaceae)(4.09±1.19)%,理研菌科(Rikenellaceae)(6.62±2.01)%,Sutterellaceae(1.21±0.52)%,梭杆菌科(Fusobacteriaceae)(1.82±0.66)%,紫单胞菌科(Porphyromonadaceae)(3.50±1.05)%,肠杆菌科(Enterobacteriaceae)(1.40±0.75)%,比例明显增加(P < 0.05),瘤胃菌科(Ruminococcaceae)(8.36±2.88)%,普雷沃氏菌科(Prevotellaceae)(10.21±3.45)%,毛螺菌科(Lachnospiraceae)(10.03±2.75)%,丹毒丝菌科(Erysipelotrichaceae)(0.64±0.38)%,细菌比例明显减少(P < 0.05,图 5)。
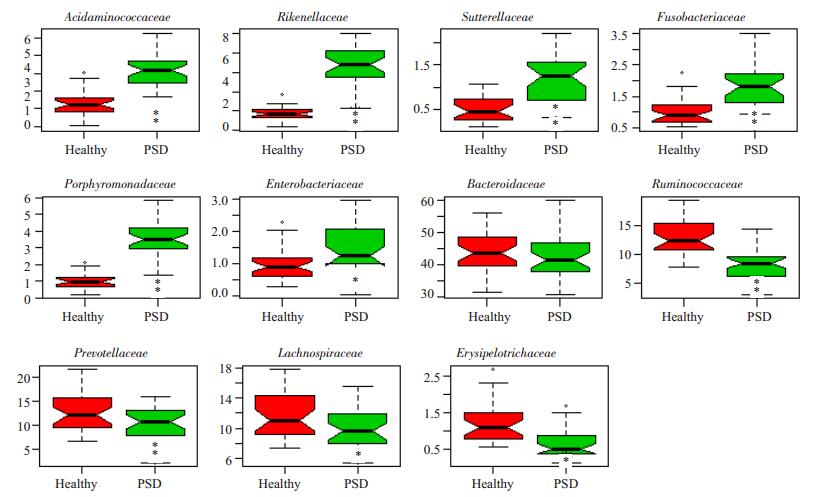
|
图 5 两组样品的微生物群落结构及其相对丰度科(Family)的水平对比结果 Figure 5 The microbial community structure and relative abundance of the two groups were compared at the level of the Family (**P < 0.01, *P < 0.05). |
PSD患者肠道菌群种类在属水平上分别为Phascolarctobacterium(3.81±0.90)%,Clostridium XIX(1.81±0.21)%,Escherichia/Shigella(1.00±0.46)%,罗氏菌属(Roseburia)(1.38±0.38)%,Lachnospiracea incertae sedis(2.34±0.96)%,Blautia(1.11±0.56)%,Parabacteroides(7.29±0.82)%,Alistipes(6.59±1.33)%,Parasutterella(1.12±0.35)%,巨单胞菌属(Megamonas)(2.48±1.13)%,比例明显升高(P < 0.05);普氏菌属(Prevotella)(9.26±3.57)%,普拉梭菌属(Faecalibacterium)(3.75±0.86)%,瘤胃球菌属(Ruminococcus)(0.25±0.23)%,小杆菌属(Dialister)(0.68±0.35)%,细菌比例明显减少(P < 0.05,图 6)。
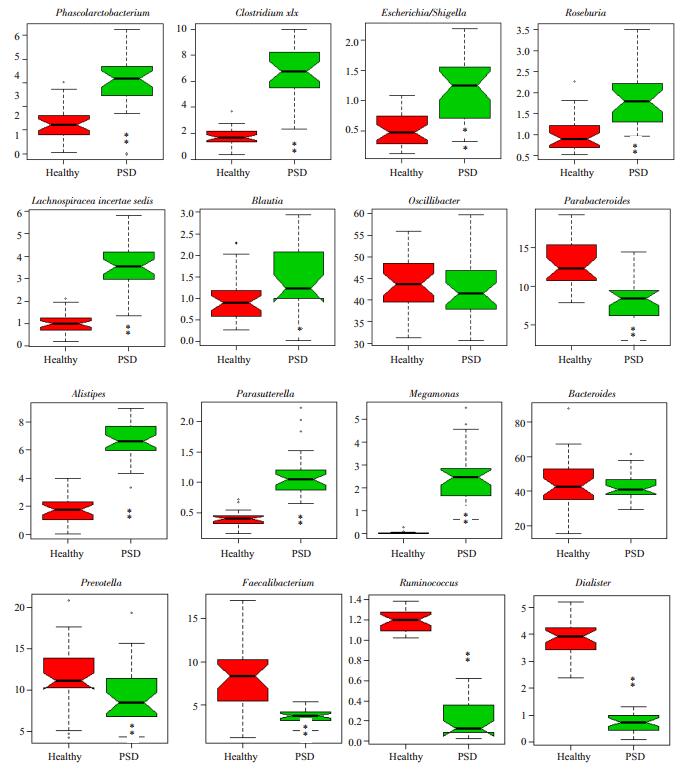
|
图 6 两组样品的微生物群落结构及其相对丰度属(Genus)的水平对比结果 Figure 6 Microbial community structure and relative abundance of the two groups compared at the level of genus (**P < 0.01, *P < 0.05). |
卒中后抑郁症是脑卒中后的常见并发症,患者临床表现除肢体功能障碍外,还伴有精神情绪的异常,如:情绪低落、对外界事物兴趣减退、思维功能迟滞等表现[8],严重降低了患者对医疗活动的依从性,不利于患者肢体功能恢复锻炼[9]。研究表明患者长期处于抑郁状态下对其神经,内分泌、免疫,以及胃肠道功能状态均有不同程度的影响。抑郁状态对于胃肠道功能的影响主要表现在影响胃肠正常节律性运动以及黏膜分泌状况,而以上两种变化对肠道内菌群集落种类及空间分布有着直接的影响[10]。根据临床流行病学调查结果显示卒中后抑郁症患者并发胃肠道功能障碍主要症状包括:食欲减退,功能性便秘,腹部胀满等[11],部分临床症状与患者精神行为学改变呈明显相关。随着近年来精准医学的提出和逐步开展,找出与卒中后抑郁症患者精神行为学改变密切相关的新靶点,实施精准治疗成为治疗本病的关键[12]。鉴于以上两方面研究结果我们假定卒中后抑郁症患者在抑郁症状产生的过程中其肠道菌群也可能发生了改变,这些改变和抑郁症状的产生和缓解有着密切联系。
肠道微生物被称为机体内第二基因组,即微生物组,是人体不可分割的基因组成部分[13]。随着人体肠道微生物群落元基因组研究的不断深入,越来越多的分子生物学证据揭示肠道微生物群落不仅参与和调控机体的生理功能,还通过肠—脑轴,参与调控高级神经活动,与精神心理的健康和疾病密切相关[14]。微生物群落的种类、组成和数量的平衡及其功能与宿主的行为密切相关,包括焦虑、抑郁和认知障碍,甚至精神分裂、老年性痴呆、自闭症等[15]。由于大部分的肠道微生物难以培养,故目前应用的分离培养技术很难深入了解菌群整体结构及其与宿主之间的相互关系,因此我们分析了采用了454焦磷酸测序技术全面了解人体肠道内环境中菌群多样性及其结构。由于16S rDNA的独特优势,可以通过设计Barcode同时针对多个样本进行平行测序,保证了实验的准确性,产生大量的用于区分细菌的序列,对标本中发现的序列进行生物信息学分析。实验结果显示卒中后抑郁症患者肠道菌群在门、纲、目、科、属各个分类学水平与正常健康成人比较均存在明显差异(P < 0.05),特征性表现为其中的潜在致病菌肠杆菌科构成比例显著增加而抗炎性细菌Faecalibacterium减少。根据既往对潜在致病性肠杆菌科细菌的认识来看,这些细菌数目的增多往往会导致胃肠道局部炎症因子长期过量释放,同时有研究证实炎症因子的增加与宿主抑郁症状的出现和加重密切相关[16-17]。这一结果与文献中记载的功能型抑郁症患者肠道菌群变迁情况有一定类似之处,本次研究证实了患者肠道菌群状态与患者在卒中后抑郁状态之间具有内在关联[18]。限于目前技术条件及病人依从性,已有研究未能长期动态监测卒中后抑郁症患者肠道微生态环境,对其中变化的肠道菌群群落结构及代谢产物与宿主之间的交互关系有待进一步探索[19-22]。
| [1] | Ayerbe L, Ayis S, Wolfe CD, et al. Natural history, predictors and outcomes of depression after stroke:systematic review and meta-analysis[J]. Br J Psychiatry,2013, 202 (1) : 14-21. DOI: 10.1192/bjp.bp.111.107664. |
| [2] | Kelly JR, Kennedy PJ, Cryan JF, et al. Breaking down the barriers:the gut microbiome, intestinal permeability and stress-related psychiatric disorders[J]. Front Cell Neurosci,2015, 35 (9) : 392. |
| [3] | Casamayor EO, Schafer H, Baneras L, et al. Identification of and spatio-temporal differences between microbial assemblages from two neighboring sulfurous lakes:Comparison by microscopy and denaturing gradient gel electrophoresis[J]. Appl Environ Microbiol,2000, 66 (2) : 499-508. DOI: 10.1128/AEM.66.2.499-508.2000. |
| [4] | Petra AI, Panagiotidou S, Hatziagelaki E, et al. Gut-MicrobiotaBrain axis and its effect on neuropsychiatric disorders with suspected immune dysregulation[J]. Clin Ther,2015, 37 (5) : 984-95. DOI: 10.1016/j.clinthera.2015.04.002. |
| [5] | 吴腾云, 林华军, 蒋春雷, 等. 肠道菌群紊乱所致炎症反应与抑郁症[J]. 现代生物医学进展,2014, 14 (36) : 7175-7, 7193. |
| [6] | 崔心尧, 王继中. 抑郁症人群肠道微生物群落结构与功能探讨[J]. 中国微生态学杂志,2015, 27 (10) : 1145-51. |
| [7] | 陈湛愔, 陆兵勋, 陈逢俭, 等. 脑梗死后情感障碍与认知功能障碍关系及其影响因素的研究[J]. 南方医科大学学报,2008, 28 (4) : 627-9, 633. |
| [8] | 刘丽红, 张文静, 徐清秀. 脑卒中患者焦虑与抑郁的调查分析及相应护理对策[J]. 南方医科大学学报,2006, 26 (1) : 89-90. |
| [9] | Feng C, Fang M, Liu XY. The neurobiological pathogenesis of poststroke depression[J]. Scientific World Journal,2014, 2014 : 521349. |
| [10] | Idiaquez J, Farias H, Torres F, et al. Autonomic symptoms in hypertensive patients with post-acute minor ischemic stroke[J]. Clin Neurol Neurosurg,2015, 139 (9) : 188-91. |
| [11] | Nassan M, Nicholson WT, Elliott M, et al. Pharmacokinetic pharmacogenetic prescribing guidelines for antidepressants:a template for psychiatric precision medicine[J]. Mayo Clin Proc,2016, 91 (7) : 897-907. DOI: 10.1016/j.mayocp.2016.02.023. |
| [12] | Maranduba CM, De Castro SB, De Souza GT, et al. Intestinal microbiota as modulators of the immune system and neuroimmune system:impact on the host health and homeostasis[J]. J Immunol Res,2015 : 931574. |
| [13] | Vayssier-Taussat M, Kazimirova M, Hubalek Z, et al. Emerging horizons for tick-borne pathogens:from the'one pathogen-one disease[J]. Future Microbiol,2015, 10 (12) : 2033-43. DOI: 10.2217/fmb.15.114. |
| [14] | Mayer EA, Knight R, Mazmanian SK, et al. Gut microbes and the brain:paradigm shift in neuroscience[J]. J Neurosci,2014, 34 (46) : 15490-6. DOI: 10.1523/JNEUROSCI.3299-14.2014. |
| [15] | 盛华芳, 周宏伟. 微生微生物组学大数据分析方法、挑战与机遇[J]. 南方医科大学学报,2015, 35 (7) : 931-4. |
| [16] | Bested AC, Logan AC, Selhub EM. Intestinal microbiota, probiotics and mental health:from Metchnikoff to modern advances:part Ⅲ-convergence toward clinical trials[J]. Gut Pathog,2013, 5 (1) : 4. DOI: 10.1186/1757-4749-5-4. |
| [17] | Maletic V, Robinson M, Oakes T, et al. Neurobiology of depression:an integrated view of key findings[J]. Int J Clin Pract,2007, 61 (12) : 2030-40. DOI: 10.1111/ijcp.2007.61.issue-12. |
| [18] | 蒋海寅.人类肠道微生物群落菌群多样性变化与抑郁症的相关性研究[D].杭州:浙江大学, 2015. http://cdmd.cnki.com.cn/article/cdmd-10335-1015608944.htm |
| [19] | 王文建, 郑跃杰. 肠道菌群与中枢神经系统相互作用及相关疾病[J]. 中国微生态学杂志,2016, 28 (2) : 240-5. |
| [20] | 王珊, 夏耿红, 何彦, 等. 氧化三甲胺分布特征及其与肠道菌群的关联性[J]. 南方医科大学学报,2016, 36 (4) : 455-60. |
| [21] | 牛敏, 邵天波, 陈瑞春, 等. 溃疡性结肠炎患者肠道菌群分析和细菌毒素基因检测[J]. 郑州大学学报:医学版,2015, 50 (4) : 514-8. |
| [22] | 万鼎铭, 周雪芳, 谢新生, 等. 异基因造血干细胞移植后肠球菌相关性腹泻的临床分析[J]. 郑州大学学报:医学版,2014, 49 (2) : 284-7. |
 2016, Vol. 36
2016, Vol. 36
