CDK6是一个关键性的细胞周期因子,位于人类七号染色体上,包含7个外显子,编码38 kD的蛋白质。该基因与CDK6、CCND1结合成复合物,进一步诱导RB蛋白磷酸化,从而诱导细胞周期由G1 向S 期转化。Mb1umbres等研究显示,在体内敲除CDK6和CDK4基因后,小鼠在胚胎时期将会死于严重的贫血[1],该研究显示了CDK6对于发育的重要性。
在以往的研究中,CDK6 过表达已经展示在许多肿瘤中,显示了其对于肿瘤发病过程的重要性。Timmermann等[2]发现,与正常黏膜相比,CDK6在鳞状口腔癌中的活性明显增高,利用CDK6 抑制剂,抑制cyclin-CDK-Rb通路激活,从而逆转上皮异常增生。除此之外,CDK6在慢性B淋巴细胞性白血病、髓母细胞 瘤以及粘液纤维肉瘤中表达增高[3-5]。罗小鹏等[6-7]也发现,CDK6在鼻咽癌组织中表达升高,且抑制其表达后,能抑制细胞周期进展和细胞生长。在膀胱癌中,CDK6表达明显比癌旁组织高,并与膀胱癌的侵袭和分级明显呈正相关[8]。在很多肿瘤中,CDK6被不同的miRNAs(mir-105、miR-29c、miR-340、miR-124a)[9-12]靶击,导致其表达下调,从而抑制肿瘤细胞生长。以上这些研究建议CDK6在肿瘤发生发展过程中发挥了重要作用。然而,CDK6在卵巢癌中的表达与临床参数和预后的关系目前还没有相关报道。为明确CDK6在CDK6在卵巢癌在作用,我们检测了CDK6在卵巢癌组织中表达,并分析其表达与卵巢癌临床病理参数和预后的相关性。
1 材料和方法 1.1 临床资料收集贵州省妇幼保健院病理科2007年1月~2014 年1月收集121例Ⅰ~Ⅱ期上皮性卵巢癌和48例卵巢石 蜡组织标本。患者年龄23~82岁。另外,我们还收集了 2014年1月~2015年12月36例新鲜上皮性卵巢癌和16 例卵巢手术切除标本,液氮立即保存。
1.2 主要试剂逆转录试剂盒及实时荧光定量PCR试剂盒购自日 本Takara公司。Trizol购自美国Invitrogen公司。免疫 组化SP法试剂盒购自福建迈新公司。
1.3 RNA提取及逆转录常规Trizol 提取总RNA。总RNA 随即被逆转录 成cDNA,反应条件如下:总RNA 1 μg 与2 μL dNTP mix(10 mmoL)和2 μL oligo(dT)18(0.5 μg/μL)及无 RNA酶的去离子水共13.5 μL混匀,离心。70 ℃变性 5 min,室温静置2 min。然后依次添加5×Buffer 4 μL, 0.1 moL DTT 1 μL,RNase 抑制剂(40 U/μL)0.5μL,逆 转录酶(200 U/μL)1 μL,混匀,离心,放入42 ℃水浴中 反应1 h,95 ℃灭活5 min。-20 ℃冷冻备用。
1.4 表达检测实时荧光定量PCR(real-time quantitative PCR, QPCR)在胃癌组织中扩增NDRG1和E-cadherin基因, 反应体系为SYBR Premix Ex(2×)10 μL、,上下游引物 (10 μmoL)各0.4 μL、,ROX Reference Dye Ⅱ(50×) 0.4 μL、cDNA 模板1 μL 和灭菌去离子水7.8 μL 共 20 μL。反应条件如下:94 ℃变性2 min;94 ℃变性10 s; 55 ℃退火10 s,72 ℃延伸15s,45个循环;最后,产物在 72 ℃延伸5 min,溶解曲线分析。CDK6引物见[3]。内参 照引物为Beta actin,正义引物:5'-CACCCAGCACA ATGAAGAT-3',反义引物:5'-CAAATAAAGCCATG CCAAT-3',全长255 bp。引物由上海英骏公司合成。 实验重复3次。
1.5 免疫组化取卵巢癌和卵巢石蜡切片置于60 ℃烤箱烘烤2 h;依次将切片按顺序浸入二甲苯中各脱蜡20 min后将切片按顺序浸入不同梯度酒精中水化2 min,然后置于超 纯水中待用;将切片放入盛有柠檬酸盐抗原修复液的孵育槽中,然后高压锅中高温高压修复2 min,室温自然冷 却;滴加卵白素,室温孵育10 min;PBS洗5 min×3次; 滴加d-生物素溶液,室温孵育10 min;PBS洗5 min×3 次;滴加内源性过氧化物酶阻断剂,室温孵育15 min; PBS 洗3 min×3 次后10%山羊血清封闭,室温孵育 10 min,弃血清;滴加1∶100 稀释CDK6 抗体(美国 Santa Cruzbiotechnology公司),4 ℃孵育过夜;PBS洗 5 min×3次后滴加二抗(生物素标记的羊抗兔IgG)室温 孵育10 min;PBS 洗3 min×3 次后滴加链霉素抗生物 素蛋白-过氧化物酶溶液,室温孵育l0 min;PBS 冲洗 3 min×3次后滴加新鲜配制的DAB液于切片中,显微镜 下观察,显色约20s后,置于水中中止显色;苏木素复染,流水冲洗返蓝15 min;切片依次浸入不同浓度酒精中脱水各2 min后在二甲苯中各透明,中性树胶封片,显微镜下观察染色效果。
1.6 免疫组化结果判定免疫组化评分分别采取了胞浆和胞核单独进行,具 体评分标准详见[13]。最后每张切片CDK6表达量评分 采用如下公式:蛋白表达量综合计分=胞浆评分+胞核评 分。总分为12分;高表达:≥7分;低表达:<7分。
1.7 实验数据处理及分析采用SPSS20.0统计分析软件包进行数据处理。非 配对T检验用于分析CDK6 mRNA在卵巢癌与卵巢组 织之间的表达差异。CDK6蛋白表达与临床参数相关 性采用χ2检验。生存预后分析采用Kaplan-Meier。Cox 模型用于评估CDK6表达作为影响患者生存的独立预 后因素。P<0.05为差异有统计学意义。
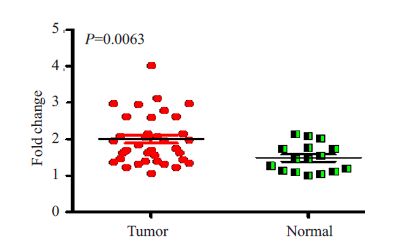
2 结果 2.1 CDK6 mRNA在卵巢癌组织中表达上调实时荧光定量PCR检测了36例卵巢癌和16例卵巢 组织CDK6 mRNA表达水平,结果显示,与卵巢组织相比, CDK6在卵巢癌组织中表达明显上调(图 1,P=0.0063)。
|
图 1 CDK6 mRNA在卵巢癌组织癌组织中表达上调 Figure 1 CDK6 mRNA was upregulated in ovarian cancer tissues. |
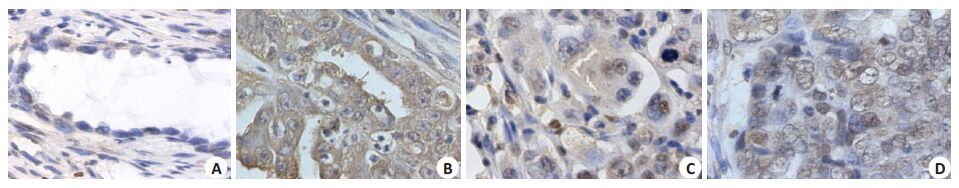
我们利用免疫组化检测了121例卵巢癌组织和48 例卵巢组织中CDK6蛋白表达。结果显示,CDK6蛋白 在卵巢癌组织和卵巢组织中均能检测其表达。除此 之外,CDK6 蛋白在两种组织中显示为核浆共表达因 子(图 2)。
|
图 2 CDK6在卵巢癌及卵巢组织中表达 Figure 2 Expression of CDK6 in ovarian cancer tissues and normal ovarian tissue (Original magnification: ×400). A: Low expression of CDK6 in normal ovarian tissue; B: CDK6 expression in the cytoplasm of ovarian cancer tissue; C, D: Coexpression of CDK6 in the cytoplasm and nuclei in ovarian cancer tissue. |
免疫组化分析了121例卵巢癌组织和48例卵巢组 织中CDK6蛋白表达差异。结果显示,与正常卵巢组织相 比,CDK6蛋白在卵巢癌中表达明显上调(表 1,P=0.044)。
| 表 1 CDK6在卵巢癌中表达上调 Table 1 Elevated expression of CDK6 protein in ovarian cancer |
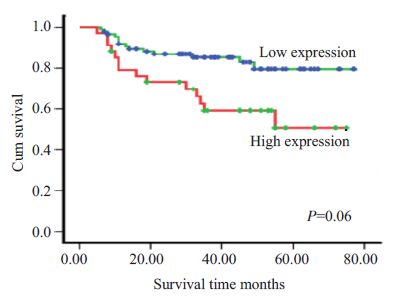
统计分析显示,过表达的CDK6与卵巢癌患者年龄、 病理类型、分化程度以及临床分期无明显关系(表 2)。 CDK6表达越高,患者综合生存时间越短(图 3,P=0.006)。
| 表 2 CDK6表达与卵巢癌临床参数相关性分析 Table 2 Correlation of CDK6 expression with clinical features of patients with ovarian cancer |
|
图 3 CDK6表达升高诱导卵巢癌患者不良预后 Figure 3 Increased CDK6 expression is associated with a poor prognosis of ovarian cancer patients. |
进一步我们利用Cox模型评估CDK6在卵巢癌中 作为独立预后因子的可能性。单变量和多变量分析结 果都显示,CDK6表达是影响卵巢癌患者预后的独立性 因素(表 3)。
| 表 3 单变量和多变量Cox回归模型综合生存分析总结 Table 3 Univariate and multivariate Cox regression analysis of overall survival of the patients |
细胞正常的分裂、增殖、分化与衰老维持着机体自 身的稳定。细胞周期的异常会导致这一系列过程的紊乱,从而诱导肿瘤的发生[14-17]。
CDK6是一个关键的细胞周期促进因子,参与诱 导肿瘤细胞的增殖[18-19]。在卵巢癌中能被miR-211直接 抑制,参与了卵巢癌的发病过程[20]。然而,CDK6表达 模式以及与卵巢癌临床病理参数之间的关系一直没有 明确。在这次研究中,为了明确CDK6在卵巢癌中的作 用,我们首先利用实时荧光定量PCR 的方法检测了 CDK6 在卵巢癌与卵巢组织中的表达。结果显示, CDK6 mRNA在卵巢癌组织中表达明显上调。进一步, 免疫组化分析显示,CDK6是一个核浆共表达因子。与 mRNA表达水平类似,CDK6蛋白表达水平在卵巢癌组 织中也明显升高。该结果相似于Baba[21]和罗小鹏[6]等 在食道癌和鼻咽癌中的报导,建议CDK6在卵巢癌中发 挥了重要的作用。
在以前的研究中,CDK6表达升高与食道癌和粘液 纤维肉瘤等肿瘤的临床进展密切相关。与这些研究结 果不一致的是,在我们的结果中,并没有发现过表达的 CDK6与早期卵巢癌患者的临床参数包括患者的年龄、临床分期、分化程度、病理类型等相关。但我们观察到 过表达的CDK6与早期卵巢癌患者的预后呈明显负相 关。CDK6表达越高,卵巢患者预后与差。反之,CDK6 表达越低,则患者预后越好。该结果与Tsai[5]等报道相 似,提示过表达的CDK6导致了卵巢患者不良预后。最后,我们基于Cox模型分析还发现,CDK6表达可以作 为预测卵巢癌独立预后因素,这进一步表明了CDK6在 卵巢癌发病过程的重要性,并提示CDK6可以作为一个 潜在的基因治疗靶标用于卵巢癌的治疗。目前,针对 CDK6 与CDK4 复合物的抑制剂PD-0332991 已经开 发,能明显抑制肿瘤细胞生长[22-25]。综合以上结果,我们认为,CDK6是一个重要候选癌基因,其表达上调在卵 巢癌发病和导致不良的预后方面发挥了重要的作用。 因此,变异的CDK6表达能作为早期卵巢癌发病的一个 恶性标志物。
| [1] |
Malumbres M, Sotillo R, Santamaría D, et al. Mammalian cells cycle without the D-type cyclin-dependent kinases Cdk4 and Cdk6[J].
Cell,2004, 118 (4) : 493-504.
DOI: 10.1016/j.cell.2004.08.002. ( 0) 0)
|
| [2] |
Timmermann S, Hinds PW, Münger K. Elevated activity of cyclin-dependent kinase 6 in human squamous cell carcinoma lines[J].
Cell Growth Differ,1997, 8 (4) : 361-70.
( 0) 0)
|
| [3] |
Hayette S, Tigaud I, Callet-Bauchu E, et al. In B-cell chronic lymphocytic leukemias, 7q21 translocations Lead to overexpression of the CDK6 gene[J].
Blood,2003, 102 (4) : 1549-50.
DOI: 10.1182/blood-2003-04-1220. ( 0) 0)
|
| [4] |
Mendrzyk F, Radlwimmer B, Joos S, et al. Genomic and protein expression profiling identifies CDK6 as novel Independent prognostic marker in medulloblastoma[J].
J Clin Oncol,2005, 23 (34) : 8853-62.
DOI: 10.1200/JCO.2005.02.8589. ( 0) 0)
|
| [5] |
Tsai JW, Li CF, Kao YC, et al. Recurrent amplification at 7q21.2 Targets CDK6 gene in primary myxofibrosarcomas and identifies CDK6 overexpression as an independent adverse prognosticator[J].
Ann Surg Oncol,2012, 19 (8) : 2716-2725.
DOI: 10.1245/s10434-012-2317-3. ( 0) 0)
|
| [6] |
罗小鹏, 覃继新, 黄永秩, 等. CDK6在鼻咽癌中的表达及临床意义[J].
南方医科大学学报,2013, 33 (12) : 1811-4.
( 0) 0)
|
| [7] |
罗小鹏, 夏琼, 覃继新, 等. siRNA抑制CDK6表达影响鼻咽癌细胞 增殖和细胞周期进展[J].
南方医科大学学报,2014, 34 (7) : 1071-4.
( 0) 0)
|
| [8] |
Wang G, Zheng LY, Yu ZJ, et al. Increased cyclin-dependent kinase 6 expression in bladder cancer[J].
Oncol Lett,2012, 4 (1) : 43-6.
( 0) 0)
|
| [9] |
Honeywell DR, Cabrita MA, Zhao H, et al. miR-105 inhibits prostate tumour growth by suppressing CDK6 levels[J].
PLoS One,2013, 8 (8) : e70515.
DOI: 10.1371/journal.pone.0070515. ( 0) 0)
|
| [10] |
Zhao X, Li J, Huang S, et al. MiRNA-29c regulates cell growth and invasion by targeting CDK6 in bladder cancer[J].
Am J Transl Res,2015, 7 (8) : 1382-9.
( 0) 0)
|
| [11] |
Li X, Gong X, Chen J, et al. miR-340 inhibits glioblastoma cell proliferation by suppressing CDK6, cyclin-D1 and cyclin-D2[J].
Biochem Biophys Res Commun,2015, 460 (3) : 670-7.
DOI: 10.1016/j.bbrc.2015.03.088. ( 0) 0)
|
| [12] |
Agirre X, Vilas-Zornoza A, Jiménez-Velasco A, et al. Epigenetic silencing of the tumor suppressor microRNA Hsa-miR-124a regulates CDK6 expression and confers a poor prognosis in acute lymphoblastic leukemia[J].
Cancer Res,2009, 69 (10) : 4443-53.
DOI: 10.1158/0008-5472.CAN-08-4025. ( 0) 0)
|
| [13] |
Wu A, Wu B, Guo J, et al. Elevated expression of CDK4 in lung cancer[J].
J Transl Med,2011, 9 : 38.
DOI: 10.1186/1479-5876-9-38. ( 0) 0)
|
| [14] |
杨金娣, 庞战军. F10基因沉默及过表达对绒癌细胞系JAR[J].
南方医 科大学学报,2016, 36 (3) : 351-5.
( 0) 0)
|
| [15] |
Chen X, Chen XG, Hu X, et al. MiR-34a and miR-203 inhibit survivin expression to control cell proliferation and survival in human osteosarcoma cells[J].
J Cancer,2016, 7 (9) : 1057-65.
DOI: 10.7150/jca.15061. ( 0) 0)
|
| [16] |
Zhang ZZ, Zhao G, Zhuang C, et al. Long non-coding RNA LINC00628 functions as a gastric cancer suppressor via long-range modulating the expression of cell cycle related genes[J].
Sci Rep,2016 (6) : 27435.
( 0) 0)
|
| [17] |
朱显军, 邓海军, 叶耿泰, 等. TALEN介导的MYH9基因沉默及对细 胞周期与凋亡的影响[J].
南方医科大学学报,2016, 36 (3) : 375-80.
( 0) 0)
|
| [18] |
Kawasaki Y, Komiya M, Matsumura K, et al. MYU, a target lncRNA for Wnt/c-Myc signaling, mediates induction of CDK6 to promote cell cycle progression[J].
Cell Rep,2016 .
( 0) 0)
|
| [19] |
Zhu K, Liu L, Zhang J, et al. MiR-29b suppresses the proliferation and migration of osteosarcoma cells by targeting CDK6[J].
Protein Cell,2016, 7 (6) : 434-44.
DOI: 10.1007/s13238-016-0277-2. ( 0) 0)
|
| [20] |
Xia B, Yang S, Liu T, et al. miR-211 suppresses epithelial ovarian cancer proliferation and cell-cycle progression by targeting cyclin D1 and CDK6[J].
Mol Cancer,2015, 14 : 57.
DOI: 10.1186/s12943-015-0322-4. ( 0) 0)
|
| [21] |
Baba Y, Watanabe M, Murata A, et al. LINE-1 hypomethylation, DNA copy number alterations, and CDK6 amplification in esophageal squamous cell carcinoma[J].
Clin Cancer Res,2014, 20 (5) : 1114-24.
DOI: 10.1158/1078-0432.CCR-13-1645. ( 0) 0)
|
| [22] |
Logan JE, Mostofizadeh N, Desai AJ, et al. PD-0332991, a potent and selective inhibitor of cyclin-dependent kinase 4/6, demonstrates inhibition of proliferation in renal cell carcinoma at nanomolar concentrations and molecular markers predict for sensitivity[J].
Anticancer Res,2013, 33 (8) : 2997-3004.
( 0) 0)
|
| [23] |
Leonard JP, Lacasce AS, Smith MR, et al. Selective CDK4/6 inhibition with tumor responses by PD0332991 in patients with mantle cell lymphoma[J].
Blood,2012, 119 (20) : 4597-607.
DOI: 10.1182/blood-2011-10-388298. ( 0) 0)
|
| [24] |
Patnaik A, Rosen LS, Tolaney SM, et al. Efficacy and safety of abemaciclib, an inhibitor of CDK4 and CDK6, for patients with breast cancer, Non-Small cell lung cancer, and other solid tumors[J].
Cancer Discov,2016, 6 (7) : 740-53.
DOI: 10.1158/2159-8290.CD-16-0095. ( 0) 0)
|
| [25] |
Sherr CJ, Beach D, Shapiro GI. Targeting CDK4 and CDK6: from discovery to therapy[J].
Cancer Discov,2016, 6 (4) : 353-67.
DOI: 10.1158/2159-8290.CD-15-0894. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
