脊髓损伤(SCI)一直是困扰医学界的一大难题,脊髓缺血再灌注损伤(SCII)作为原发性脊髓损伤后的继发性损害是造成神经细胞损伤的一个重要因素[1-2], 它是指一些导致脊髓缺血因素去除后,脊髓恢复供血, 神经功能在原缺血损伤基础上进一步加重,甚至出现不可逆性脊髓神经元迟发性死亡的现象[3]。
瞬时受体电位(TRP)超家族是一组非选择性阳离子通道,包括8 个成员,TRPM1~8[4]。最新研究发现, TRPM8 不仅对低温刺激敏感[5],而且还可能参与炎症和神经性疼痛的痛觉调控,可作为治疗神经性疼痛的新靶点[6-7]。TRPM8 参与调节细胞生长和死亡过程,具有重要的临床和药理学研究价值[8]。UCP是线粒体内膜上的一种具有调节质子跨膜作用的特殊蛋白质[9-10],目前已经发现5 种UCPs,存在于中枢神经系统的是 UCP2、UCP4和UCP5。研究表明,UCP2基因敲除的小鼠较正常小鼠大脑线粒体在氧化应激下能够产生更多的ROS,UCP3过表达显著降低细胞衰老诱导的ROS的产生[11]。UCP4可能参与了脑缺血再灌注损伤的病理过程,其表达的降低可能影响细胞内活性氧量的变化[12]。
TRP家族中TRPM2/TRPM7 和TRPM4与缺血性损伤的关系密切,可参与缺血性脑损伤的发生发展过程[13-14],而TRPM8 与TRPM2 属于同源性分子, TRPM8可调节细胞的生长和死亡,参与炎症反应[15],因此我们猜测TRPM8可能与脊髓缺血再灌注损伤诱导的神经细胞凋亡具有相关性,因此,本研究在体外建立氧糖剥夺/复糖复氧模型模拟脊髓缺血再灌注损伤,探讨 TRPM8对脊髓神经元PC12细胞凋亡的影响及可能的分子机制。
1 材料和方法 1.1 细胞PC12 神经元细胞,购自美国模式培养物保藏所 (American Type Culture Collection,ATCC)。
1.2 主要试剂DMEM培养液、无糖DMEM培养液、胎牛血清 (Fetal Bovine Serum,FBS)(Gibco,美国);TRPM8抗体 (英国Abcam 公司),UCP4 抗体(Santa Cruz,美国), PKA抗体、p-PKA抗体、Bax抗体、Bcl-2 抗体和β-actin 抗体,羊抗兔Ig G(北京中杉金桥);空白质粒载体、 UCP4 质粒载体(Santa Cruz,美国);LipofectamineTM 2000(Invitrogen,Inc.);PKA抑制剂H-89、TRPM8特异性阻断剂AMTB(Sigma,美国);Annexin V-FITC/PI 细胞凋亡检测试剂盒(南京凯基生物);ECL化学发光检测试剂盒(Pierce,美国);预染蛋白Marker (MBI公司)。 其余常规生物化学试剂为Amresco或Sigma分装,购自北京鼎国生物技术有限公司。
1.3 细胞培养与分组PC12神经细胞用DMEM培养液(10% FBS)培养于37 ℃、5% CO2孵箱,选用对数生长期的细胞进行实验。实验分为:正常组(Con),氧糖剥夺/复糖复氧组 (OGD/R),OGD/R+AMTB组:向氧糖剥夺/复糖复氧的细胞中加入TRPM8 抑制剂AMTB(10 mmol/L),培养 24 h;OGD/R+AMTB+H-89 组:向氧糖剥夺/复糖复氧的细胞中加入TRPM8 抑制剂AMTB(10 mmol/L)和 PKA抑制剂H-89(40 μmol/L),共培养24 h;OGD/R+ AMTB+NC 组、OGD/R+AMTB+UCP4 plasmid 组、 OGD/R+NC组、OGD/R+UCP4 plasmid组:分别转染空质粒(NC)或UCP4质粒载体,待细胞转染48 h后,建立 OGD/R模型,按照分组。
1.4 质粒转染采用LipofectamineTM 2000 试剂盒进行质粒转染。使用100 μL无血清培养基,稀释1.0 μg 质粒DNA (UCP4重组质粒或空载体对照),轻轻振摇使之混合均匀;将5 μL LipofectamineTM 2000 稀释到100 μL无血清的培养基中,混匀;将稀释的质粒DNA(阳性重组质粒或空载体对照)和稀释LipofectamineTM 2000混合在一起(总体积为200 μL),向PC12细胞培养液中加入质粒和LipofectamineTM 2000的混合液,转染48 h。收集细胞提取总蛋白,检测UCP4的表达,若显著过表达,则表明转染成功。
1.5 细胞培养与氧糖剥夺/复糖复氧(OGD/R)模型的建立按照分组处理细胞后,无糖DMEM培养液洗涤2 遍,将培养基更换为无糖DMEM,快速放入三气缺氧箱 (94% N2,0.5% O2,5% CO2,37 ℃)培养6 h,换回正常培养基,放入37 ℃、5% CO2孵箱继续培养24 h,模拟再灌注损伤[16-17]。
1.6 流式检测细胞凋亡收集各组细胞,用冷PBS 清洗后,加入500 μL缓冲液调整细胞至1×106/mL,加入5 μL AnnexinV-FITC 室温避光孵育15 min,立即加入5 μL PI室温避光继续孵育5 min,流式细胞仪进行检测。
1.7 RT-PCR技术收集各组细胞,Trizol法提取细胞总RNA,Qiagen RNasey Mini Kit 检测RNA纯度。逆转录后进行PCR 反应,TRPM8 的引物5'-ACTCAGAAGGCTGAGGT ACA-3',5'-TTCAGTCGGAGTCTCACTCT-3';UCP4 的引物5'-TAACCAAGGGAACCACAACATAC-3', 5'-TTGTAGAAAGAGGGAAAAGGACC-3';β-actin 的引物5'-CACGATGGAGGGGCCGGACTCATC-3',5'- TAAAGACCTCTATCATCAACACAGT-3'。条件为预变性94 ℃ 5 min,94 ℃ 30 S,60 ℃ 30 S,72 ℃ 1 min, 72 ℃ 10 min,30个循环。产物琼脂糖凝胶电泳,凝胶成像仪进行图像和条带灰度分析。
1.8 Western blotting分析收集各组细胞,提取总蛋白,BCA法进行蛋白定量。总蛋白经SDS-PAGE电泳分离后转移至NC膜, 5% BCA 封闭1 h,封闭后的滤膜再与TRPM8 抗体、 UCP4 抗体、PKA抗体、CAMP抗体(1∶500)及Bax 抗体、Bcl-2 抗体、β-actin 抗体(1∶200)4 ℃孵育过夜。经 TBST 洗涤后,HRP 标记的兔抗山羊Ig G 或羊抗兔Ig G 作为二抗(1∶2000)室温孵育2 h,洗膜后,ECL 化学发光法显影成像。
1.9 数据分析采用SPSS17.0 统计软件分析。数据以均数±标准差表示,两组间比较采用t检验。多组间差异采用方差分析,以P<0.05为差异有统计学意义。
2 结果 2.1 氧糖剥夺/复糖复氧对神经元细胞TRPM8和UCP4表达的影响RT-PCR和Western blot方法检测氧糖剥夺/复糖复氧后PC12细胞中TRPM8和UCP4的表达变化,结果如 图 1,和正常组相比,氧糖剥夺/复糖复氧后TRPM8 的 mRNA和蛋白表达均显著增强,而UCP4的表达被抑制 (P<0.05)。
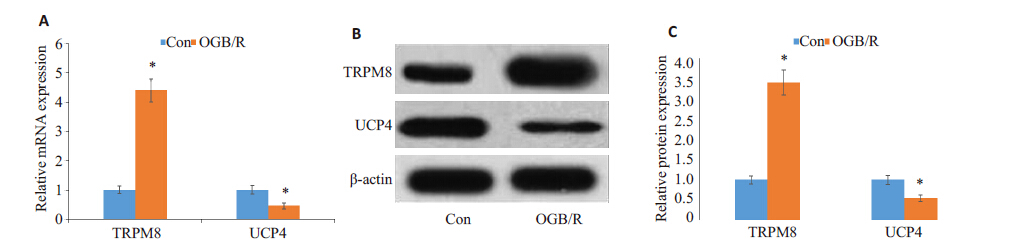
|
图 1 氧糖剥夺/复糖复氧诱导的神经元细胞TRPM8和UCP4的表达 Figure 1 Expression of TRPM8 and UCP4 mRNA (A) and proteins (B, C) in PC12 cells with OGD for 24 h detected with RT-PCR and Western blotting. *P<0.05 vs control group. |
流式细胞术检测细胞凋亡,结果发现,氧糖剥夺/复糖复氧诱导了细胞凋亡(图 2A、B,P<0.05),且促凋亡因子Bax表达上调,抑凋亡因子Bcl-2 下降(图 2C、D,P< 0.05)。抑制TRPM8的表达,则细胞凋亡率显著下降, Bax表达明显下降,Bcl-2增加(P<0.05)。表明TRPM8可能与氧糖剥夺/复糖复氧诱导的神经细胞的凋亡相关。
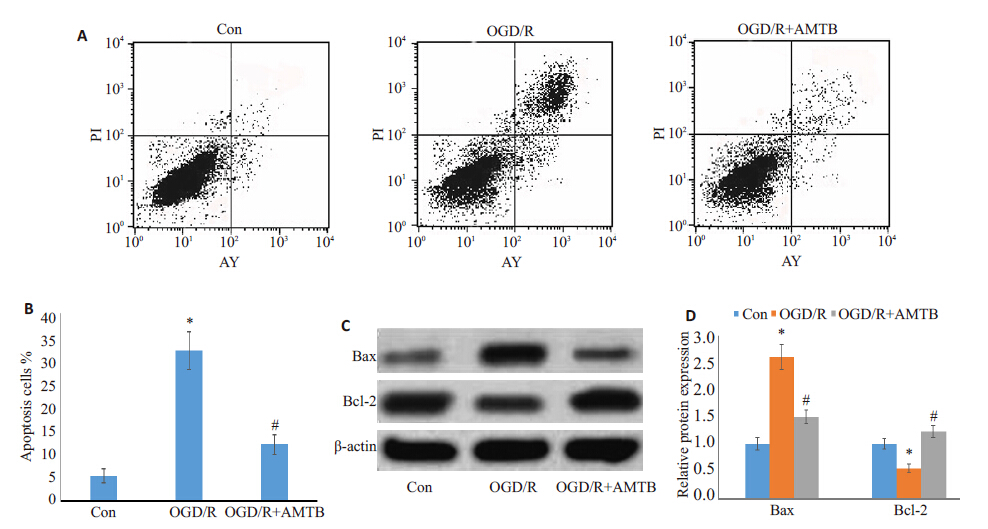
|
图 2 TRPM8对氧糖剥夺/复糖复氧后神经细胞凋亡的影响 Figure 2 Effect of TRPM8 on apoptosis of PC12 cells exposed to OGD. A,B: Cell apoptotic rate measured with flow cytometry; C,D: Bax and Bcl-2 protein expressions. *P<0.05 vs control group; #P<0.05 vs OGD group. |
文献报道TRPM8 可通过PKA磷酸化调节UCP1 的表达[18],而UCP4 与UCP1 属于同家族蛋白,且在 OGD/R 诱导的PC12 细胞中UCP4 被抑制,因此猜测 TRPM8 与UCP4 之间可能也存在着联系(图 3A,B), OGD/R 诱导p-PKA 和cAMP 蛋白表达下降,说明 cAMP-PKA信号通路被抑制。进一步探究发现,抑制 TRPM8 的表达,p-PKA、cAMP的表达水平明显提高, 且UCP4 的表达也增强;同时抑制TRPM8 和 cAMP-PKA 信号,UCP4 的表达显著下调(图 3C,P< 0.05)。综合以上结果可知,TRPM8可通过cAMP-PKA 信号调控UCP4的表达。
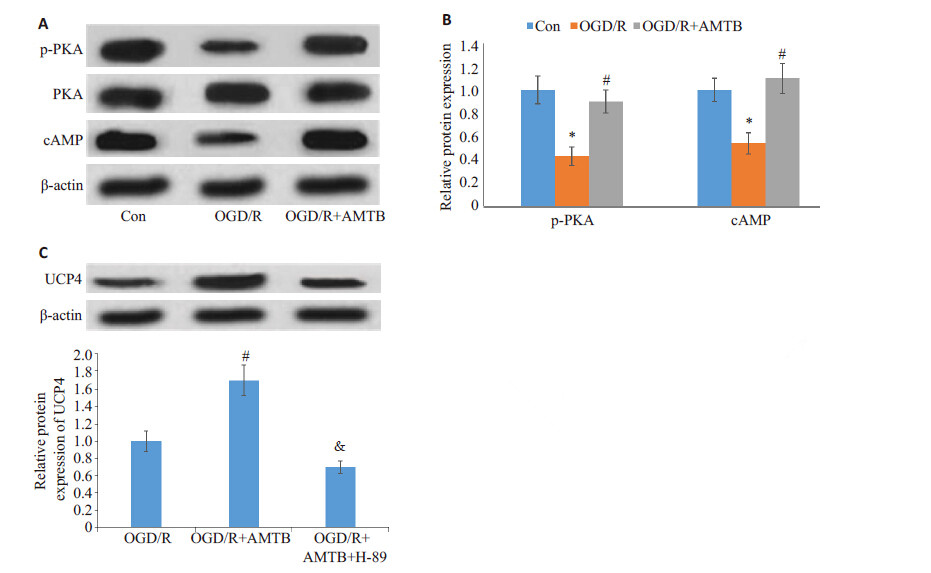
|
图 3 western blot 检测p-PKA、PKA、cAMP 和UCP4的蛋白表达水平 Figure 3 Western blotting of p-PKA,cAMP (A, B) and UCP4 (C) protein expressions in PC-12 cells with different treatments. *P<0.05 vs control group; #P<0.05 vs OGD group; &P< 0.05 vs OGD+AMTB group. |
通过cAMP-PKA/ UCP4 调控PC12 细胞凋亡进一步探究TRPM8 与细胞凋亡的相关性。转染 UCP4质粒载体,通过western blot检测细胞UCP4的蛋白表达,发现其显著性过表达,表明转染成功。UCP4过表达,则Bax显著下调,Bcl-2表达增加(图 4A、B,P<0.05); 同时抑制TRPM8和cAMP-PKA信号,结果发现Bax表达增加,Bcl-2的表达明显减少;抑制TRPM8且过表达 UCP4,检测细胞凋亡相关因子,Bax 的表达减少而 Bcl-2明显增加(图 4C、D,P<0.05)。由此可知,TRPM8 可通过cAMP-PKA/UCP4调控PC12细胞的凋亡。
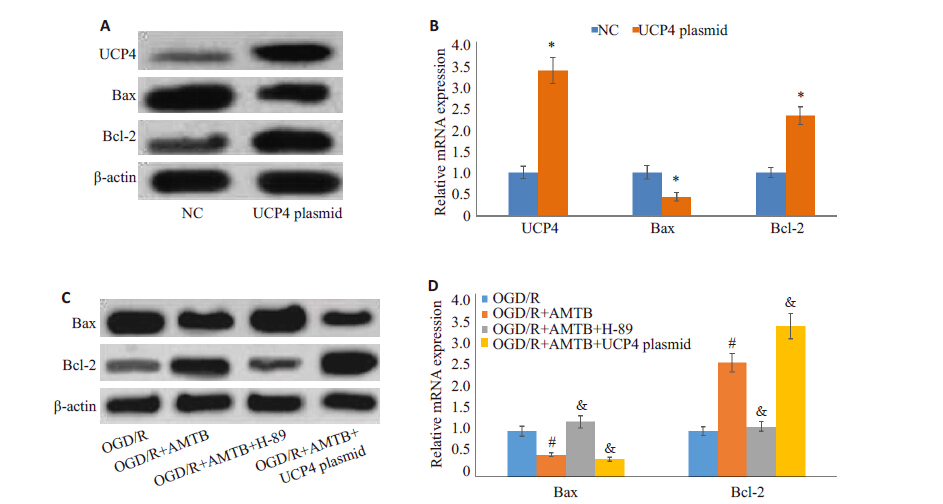
|
图 4 TRPM8通过cAMP-PKA/UCP4调控PC12细胞凋亡 Figure 4 TRPM8 mediates OGD-induced PC12 cell apoptosis through cAMP-PKA/UCP4 signaling. A, B: Western blotting of Bax and Bcl-2 protein expressions. *P<0.05 vs negative control (NC) group. #P<0.05 vs OGD group. &P<0.05 vs OGD/R+AMTB group. |
脊髓缺血再灌注损伤是一种常见的临床病理生理过程,可造成严重后果[19-20],对脊髓I/R损伤的机制探讨的缺乏是探索新防治方法的障碍之一。目前认为,在脊髓缺血再灌注损伤中神经细胞凋亡起重要作用。本实验以OGD/R模型在体外模拟脊髓缺血再灌注损伤,探究TRPM8在神经元细胞凋亡中的分子机制。
TRPM是细胞膜上的一类重要的非选择性阳离子通道超家族,根据同源性分为4组,TRPM1和TRPM3, TRPM2 和TRPM8,TRPM4 和TRPM5,TRPM6 和 TRPM7[21]。研究表明,TRPM2/TRPM7 和TRPM4 与缺血性损伤的关系密切,这些受体通过对钙离子的调控,参与了缺血性脑损伤的发生发展过程[22-23]。 TRPM8 不仅对低温刺激敏感,而且还可能参与炎症和神经性疼痛的痛觉调控,还参与调节细胞生长和凋亡的过程[24]。TRPM8与TRPM2属于同源性分子,因此本实验想要探究TRPM8在脊髓缺血再灌注诱导神经元细胞凋亡中的作用。前期研究结果表明,在OGD/R模型中 TRPM8显著过表达;抑制TRPM8,发现PC12细胞的凋亡显著减少,促凋亡因子Bax的表达下降,抑凋亡因子 Bcl-2蛋白表达增强。表明TRPM8可能参与了OGD/R 损伤导致的神经细胞凋亡。
UCP4是线粒体内膜上的一种具有调节质子跨膜作用的特殊蛋白质,UCP4激活后可以通过调节神经元能量等机制起到神经保护作用,以及脑细胞氧化应激调节等作用[25]。脑处于氧化应激状态时,UCP4 可通过降低ROS 而产生抗氧化作用,还可能参与细胞增殖、凋亡等细胞损伤过程[26]。本实验发现,和正常培养条件比较,OGD/R损伤导致PC12 细胞UCP4 的表达受损;转染质粒使UCP4过表达,则Bax的蛋白表达下降,Bcl-2 显著过表达,PC12细胞的凋亡减少,由此猜测UCP4可能也参与OGD/R损伤导致的PC12细胞凋亡。
进一步探究TRPM8和UCP4对OGD/R损伤导致的神经元细胞凋亡的作用机制。已有文献研究报道,提高海马组织cAMP含量、促进PKA磷酸化,激活cAMPPKA- CREB信号转导通路,可以保护神经元[27-28];抑制 PKA、ERK1/2、CREB蛋白磷酸化水平会诱导大鼠海马神经细胞凋亡[29]。本文的实验结果表明(图 3),PC12细胞经氧糖剥夺6 h再复糖复氧24 h,cAMP和p-PKA的表达和正常组比较有所下降,说明OGD/R 严重抑制 cAMP-PKA信号的激活;抑制TRPM8,发现被阻碍的 cAMP-PKA信号有所恢复,且UCP4的表达增加,细胞凋亡减少;同时抑制TRPM8 和cAMP-PKA 信号,则 UCP4的表达明显下降,细胞凋亡增加(图 4)。综上所述,抑制TRPM8 可激活cAMP-PKA/UCP4 信号,从而调控OGD/R损伤导致的脊髓神经细胞凋亡。
本研究只是初步探讨了TRPM8 在脊髓缺血再灌注损伤诱导的神经细胞凋亡中的作用,今后还需要进一步深入研究他在脊髓损伤中的分子机制,为治疗脊髓损伤提供新的分子依据和靶点。
| [1] |
Zhou YF, Li L, Feng F, et al. Osthole attenuates spinal cord ischemia-reperfusion injury through mitochondrial biogenesisindependent inhibition of mitochondrial dysfunction in rats[J].
J Surg Res,2013, 185 (2) : 805-14.
DOI: 10.1016/j.jss.2013.06.044. ( 0) 0)
|
| [2] |
Kang X, Wen J, Wang X, et al. Temporal and spatial pattern of RhoA expression in injured spinal cord of adult mice[J].
Nan Fang Yi Ke Da Xue Xue Bao,2013, 33 (4) : 463-8.
( 0) 0)
|
| [3] |
Oyinbo CA. Secondary injury mechanisms in traumatic spinal cord injury: a nugget of this multiply cascade[J].
Acta Neurobiol Exp (Wars),2011, 71 (2) : 281-99.
( 0) 0)
|
| [4] |
Morenilla-Palao C, Luis E, Fernaadez-Pena CA, et al. Ion Channel profile of TRPM8 cold receptors reveals a role of TASK-3 Potassium channels in thermosensation[J].
Cell Rep,2014, 8 (5) : 1571-82.
DOI: 10.1016/j.celrep.2014.08.003. ( 0) 0)
|
| [5] |
Wm K, Bifolck-Fisher A, Bautista DM, et al. TRPM8, but not TRPA1, is required for neural and behavioral responses to acute noxious cold temperatures and cold-mimetics in vivo[J].
Pain,2010, 150 (2) : 340-50.
DOI: 10.1016/j.pain.2010.05.021. ( 0) 0)
|
| [6] |
Knowlton WM, Palkar R, Lippoldt EK, et al. A Sensory-Labeled line for cold: TRPM8-Expressing sensory neurons define the cellular basis for cold, cold pain, and cooling-mediated analgesia[J].
J Neurosci,2013, 33 (7) : 2837-48.
DOI: 10.1523/JNEUROSCI.1943-12.2013. ( 0) 0)
|
| [7] |
Harrington AM, Hughes PA, Martin CM, et al. A novel role for TRPM8 in visceral afferent function[J].
Pain,2011, 152 (7) : 1459-68.
DOI: 10.1016/j.pain.2011.01.027. ( 0) 0)
|
| [8] |
Yee NS, Zhou WQ, Lee M. Transient receptor potential Channel TRPM8 is over-expressed and required for cellular proliferation in pancreatic adenocarcinoma[J].
Cancer Lett,2010, 297 (1) : 49-55.
DOI: 10.1016/j.canlet.2010.04.023. ( 0) 0)
|
| [9] |
Ramsden DB, Ho PW, Ho JW, et al. Human neuronal uncoupling proteins 4 and 5 (UCP4 and UCP5): structural properties, regulation, and physiological role in protection against oxidative stress and mitochondrial dysfunction[J].
Brain Behav,2012, 2 (4) : 468-78.
DOI: 10.1002/brb3.55. ( 0) 0)
|
| [10] |
Huang ZM, Li JH, Du SH, et al. Effects of UCP4 on the proliferation and apoptosis of chondrocytes: its possible involvement and regulation in osteoarthritis[J].
PLoS One,2016, 11 (3) : e0150684.
DOI: 10.1371/journal.pone.0150684. ( 0) 0)
|
| [11] |
Grisendi S, Bernardi R, Rossi M, et al. Role of nucleophosmin in embryonic development and tumorigenesis[J].
Nature,2005, 437 (7055) : 147-53.
DOI: 10.1038/nature03915. ( 0) 0)
|
| [12] |
王丽荣, 刘瑞珍. 原代培养神经元类缺血再灌后UCP4 的表达与ROS 的相关性[J].
山西医科大学学报,2008, 39 (5) : 399-401.
( 0) 0)
|
| [13] |
张厉, 杨春喜, 贺石生. TRPM家族对细胞钙/镁平衡调控的研究进展[J].
基础医学与临床,2013, 33 (3) : 370-3.
( 0) 0)
|
| [14] |
曾招. 离子通道TRPM7 调节细胞生理的分子机制研究[Z], 2014.
http://cdmd.cnki.com.cn/article/cdmd-10285-1015410076.htm
( 0) 0)
|
| [15] |
李敏超, 周向东. 瞬时受体电位M8 离子通道对冷刺激诱导气道上皮细胞炎症反应的影响[J].
中华结核和呼吸杂志,2011, 34 (10) : 757-61.
( 0) 0)
|
| [16] |
Fan L, Dang X, Shi Z, et al. Hydroxysafflor yellow A protects PC12 cells against the apoptosis induced by Oxygen and glucose deprivation[J].
Cell Mol Neurobiol,2011, 31 (8) : 1187-94.
DOI: 10.1007/s10571-011-9720-3. ( 0) 0)
|
| [17] |
Wu K, Zhou KL, Wang YL, et al. Stabilization of HIF-1 alpha by FG-4592 promotes functional recovery and neural protection in experimental spinal cord injury[J].
Brain Res,2016, 1632 : 19-26.
DOI: 10.1016/j.brainres.2015.12.017. ( 0) 0)
|
| [18] |
De Petrocellis L, Starowicz K, Moriello AS, et al. Regulation of transient receptor potential channels of melastatin type 8(TRPM8): effect of cAMP,cannabinoid CB 1 receptors and endovanilloids[J].
Exp Cell Res,2007, 313 (9) : 1911-20.
DOI: 10.1016/j.yexcr.2007.01.008. ( 0) 0)
|
| [19] |
Brevoord D, Kranke P, Kuijpers M, et al. Remote ischemic conditioning to protect against Ischemia-Reperfusion injury: a systematic review and Meta-Analysis[J].
PLoS One,2012, 7 (7) : e42179.
DOI: 10.1371/journal.pone.0042179. ( 0) 0)
|
| [20] |
谭永红, 徐世元, 范凤飞. 大鼠脊髓针刺损伤程度与脊髓功能变化的相关性研究[J].
南方医科大学学报,2012, 32 (003) : 333-6.
( 0) 0)
|
| [21] |
Staaf S, Franck MC, Marmigere FA, et al. Dynamic expression of the TRPM subgroup of ion channels in developing mouse sensory neurons[J].
Gene Expression Patterns,2010, 10 (1) : 65-74.
DOI: 10.1016/j.gep.2009.10.003. ( 0) 0)
|
| [22] |
umoza-toledo A. Penner R. TRPM2: a multifunctional ion Channel for Calcium signalling[J].
J Physiol,,2011, 589 (7) : 1515-25.
DOI: 10.1113/jphysiol.2010.201855. ( 0) 0)
|
| [23] |
Zierler S, Yao GM, Zhang Z, et al. Waixenicin a inhibits cell proliferation through magnesium-dependent block of transient receptor potential melastatin 7 (TRPM7) channels[J].
J Biol Chem,2011, 286 (45) : 39328-35.
DOI: 10.1074/jbc.M111.264341. ( 0) 0)
|
| [24] |
Knowlton WM, Daniels RL, Palkar R, et al. Pharmacological blockade of TRPM8 ion channels alters cold and cold pain responses in mice[J].
PLoS One,2011, 6 (9) : e25894.
DOI: 10.1371/journal.pone.0025894. ( 0) 0)
|
| [25] |
Liu HC, Zhang XJ, Du YY, et al. Leonurine protects brain injury by increased activities of UCP4, SOD, CAT and Bcl-2, decreased levels of MDA and Bax, and ameliorated ultrastructure of mitochondria in experimental stroke[J].
Brain Res,2012, 1474 : 73-81.
DOI: 10.1016/j.brainres.2012.07.028. ( 0) 0)
|
| [26] |
Vincent AM, Olzmann JA, Brownlee M, et al. Uncoupling proteins prevent glucose-induced neuronal oxidative stress and programmed cell death[J].
Diabetes,2004, 53 (3) : 726-34.
DOI: 10.2337/diabetes.53.3.726. ( 0) 0)
|
| [27] |
王仕丽, 吴强, 赵吉清, 等. 缺氧条件下梭曼中毒大鼠脑G 蛋白及 cAMP-PKA 信号系统的变化[J].
第三军医大学学报,2001, 23 (8) : 879-81.
( 0) 0)
|
| [28] |
孟培燕. 电针对血管性痴呆大鼠学习记忆相关信号通路影响的研究: 湖北中医学院[D], 2007.
( 0) 0)
|
| [29] |
李金艳, 常珊珊, 袁晋峰, 等. 亚慢性染毒B[C]. 贵阳: 第十届全国环境与职业医学研究生学术研讨会论文集, 29. 2, 2012: 110-8.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
