三阴性乳腺癌具有局部复发率高、远处转移率高、 预后差等临床特征[1]。丙泊酚作为最常用的静脉麻醉药,广泛用于包括乳腺癌在内的多种肿瘤切除手术的全身麻醉,可以抑制前列腺癌、肝癌、卵巢癌、乳腺癌等多种肿瘤细胞的侵袭和转移[2-5]。H19是最早发现的与肿瘤相关的长链非编码RNA (lncRNA)之一,在胃癌、肝癌、膀胱癌等多种肿瘤组织中存在异常表达,与肿瘤细胞的增殖、侵袭转移等相关[6-8]。研究表明,H19的表达量与三阴性乳腺癌MDA-MB-231细胞的恶性程度呈正相关[9]。丙泊酚可否通过影响H19在乳腺癌细胞中的表达而发挥抗肿瘤作用,未见报道。本研究,通过观察不同浓度丙泊酚对乳腺癌MDA-MB-231细胞H19表达量的变化及迁移和侵袭能力的影响,为研究丙泊酚的抗肿瘤作用及其机制提供依据。
1 材料和方法 1.1 材料 1.1.1 细胞株及细胞培养人乳腺癌MDA-MB-231细胞株是一种三阴性乳腺癌细胞株,由南方医科大学临床医学实验研究中心细胞库提供,原细胞株购于中国科学院上海细胞库,液氮保存。MDA-MB-231细胞复苏后, 于RPMI 1640 培养基(含10%胎牛血清,1×105 U/L青霉素,100 mg/L链霉素),置于37 ℃、饱和湿度、5% CO2 培养箱中培养;细胞会合达90%时,0.25%胰酶消化后传代培养。
1.1.2 主要试剂及仪器丙泊酚(propofol,批号:1001932584,Sigma)、二甲基亚砜(DMSO,批号: D2650,Sigma)、结晶紫(批号:C0075,Sigma);RPMI 1640 培养基(批号:C11875500BT,Gibco)、胎牛血清 (批号:10270-106,Gibco)、胰蛋白酶(批号:15050065, Gibco);Transwell 小室(批号:353097,Corning)、 Matrigel Matrix 基质胶(批号:356234,Corning); TaKaRa RNA提取(批号:9767)试剂盒、反转录(批号: RR036A)试剂盒、RT-PCR(批号:RR390A)试剂盒:宝生物工程(大连)有限公司;引物及Taqman 探针(批号: 9301918674,9301918675)合成:生工生物工程(上海)股份有限公司;CO2 培养箱(HEPAC CLASS105,美国 Thermo);荧光定量PCR 仪(LightCycle480,瑞士 Roche)。
1.2 方法 1.2.1 丙泊酚溶液的配制将丙泊酚溶于DMSO中,配制成100 mmol/L 的丙泊酚溶液,而后用无血清 RPMI 1640 培养基分别稀释成25、50、100 μmol/L;用无血清RPMI 1640 培养基稀释DMSO,DMSO浓度相于100 μmol/L丙泊酚溶液中DMSO的浓度。
1.2.2 实验分组及丙泊酚的处理取对数生长期MDA-MB-231 细胞,消化离心,用含10%胎牛血清的 RPMI 1640 培养基重悬并接种于六孔板中。按随机数字表法,将实验分为5组:空白对照组(C组),DMSO组 (S组),25 μmol/L丙泊酚组(P1组),50 μmol/L丙泊酚组(P2组),100 μmol/L丙泊酚组(P3组)。
1.2.3 方法和监测 1.2.3.1 荧光定量PCR(TaqMan探针法)实验待5组细胞会合达到80%左右,换无血清培养基饥饿处理细胞 12 h后,给予各组相应的DMSO或丙泊酚溶液处理,继续培养。将各组细胞处理24 h后,用RNA提取试剂盒提取总RNA并用分光光度计测定其浓度和纯度,然用逆转录试剂盒将RNA逆转录成cDNA。随后将所有样本进行荧光定量PCR,分别检测内参基因和目的基因的Ct值,采用2-ΔΔCt法计算出相对表达量,H19表达量的下调率/%=(1-相对表达量)×100%。引物和Taqman探针的序列(表 1)及ΔΔCt计算方法如下:
| $\begin{align} & F\left( 相对表达倍数 \right)={{2}^{-\Delta \Delta Ct}} \\ & \Delta \Delta Ct=\Delta Ct\left( {实验组} \right)-\Delta Ct\left( {对照组} \right) \\ & \Delta Ct\left( {实验组} \right)=Ct\left( {实验组} \right)-Ct\left( {内参} \right) \\ & \Delta Ct\left( {对照组} \right)=Ct\left( {对照组} \right)-Ct\left( {内参} \right) \\ \end{align}$ |
| 表 1 引物和Taqman探针的序列 Table 1 Primer and TaqMan probe sequences Oligo name |
待5组细胞长满六孔板底部时,用枪头于六孔板底部划痕,然后用PBS冲洗3次,去除划下的细胞,给予各组DMSO或丙泊酚处理。接着放入培养箱继续培养,24 h 后取样拍照。细胞运动抑制率/%=(1-实验组划痕缩小宽度/对照组划痕缩小宽度)×100%。
1.2.3.3 Transwell迁移实验待5组细胞会合达到80%左右,换无血清培养基饥饿处理细胞12 h 后,给予各组相应的DMSO或丙泊酚溶液处理,继续培养。将各组细胞处理24 h 后,消化离心,用无血清培养基重悬细胞至5×105/mL,每个Transwell 上室加入细胞悬液 200 μL,下室加入含10%胎牛血清的RPMI 1640 培养基900 μL,培养12 h后取出上室,用棉签擦去上室上层未迁移的细胞,无水甲醇室温固定10 min,0.1%结晶紫染色15 min,随机取6个400×视野显微镜下拍照。细胞迁移抑制率/%=(1-实验组迁移细胞数/对照组迁移细胞 数)×100%。
1.2.3.4 Transwell侵袭实验待5组细胞会合达到80%左右,换无血清培养基饥饿处理细胞12 h 后,给予各组相应的DMSO或丙泊酚溶液处理,继续培养。将各组细胞处理24 h后,消化离心,用无血清培养基重悬细胞至1×106/mL,每个Transwell 上室的PET 膜上铺 100 μL Matrigel Matrix 基质胶,其余操作同迁移实验。细胞侵袭抑制率/%=(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
1.2.4 统计学处理计量资料以均数±标准差表示,采用SPSS 13.0 软件进行单因素方差分析,各组间多重比较用双侧Dunnett-t 检验。当P<0.05 时,认为差异有统计学意义。
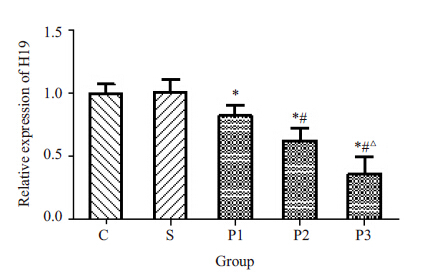
2 结果 2.1 丙泊酚对MDA-MB-231细胞H19表达的影响不同浓度的丙泊酚溶液处理乳腺癌MDA-MB-231 细胞24 h后,MDA-MB-231细胞H19的表达量明显降低。与C组相比,P1、P2、P3组细胞的H19表达量下调率分别为:17.83%、37.50%、63.67%(各组之间P<0.05); S组与C组相比无统计学差异(P>0.05,图 1)。
|
图 1 丙泊酚对MDA-MB-231细胞H19表达的影响 Figure 1 Effect of propofol on H19 mRNA expression in MDA-MB-231 cells. *P<0.05 vs group C; #P<0.05 vs group P1; △P<0.05 vs group P2 group C: Basal medium group; group S: DMSO group; P1,P2,P3: Propofol groups (25,50,100 μmol/L). |
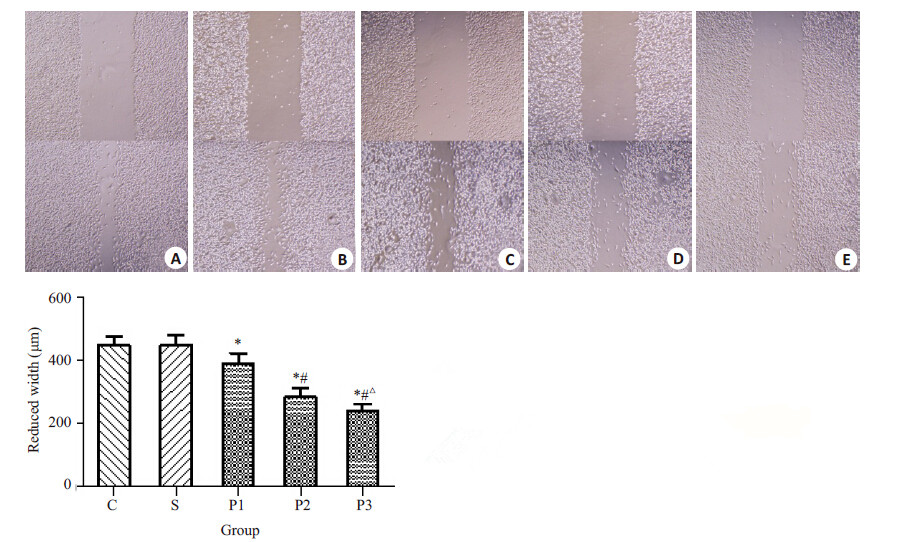
不同浓度的丙泊酚溶液处理乳腺癌MDA-MB-231 细胞24 h后,细胞的运动能力明显减弱。与C组相比, P1、P2、P3 组的细胞运动抑制率分别为:13.46%、 36.54%、46.17%(各组之间P<0.05);S组与C组相比无统计学差异(P>0.05,图 2)。
|
图 2 丙泊酚对MDA-MB-231细胞运动能力的影响 Figure 2 Effect of propofol on motility of MDA-MB-231 cells (Original magnification: × 100). A: Group C; B: Group S; C: Group P1; D: Group P2; E: Group P3. *P<0.05 vs group C; #P<0.05vsgroup P1; △P<0.05 vs group P2 group. |
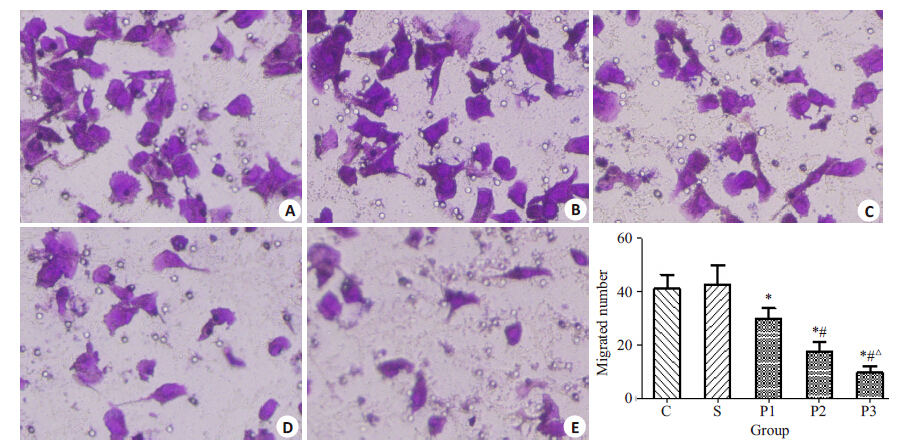
不同浓度的丙泊酚溶液处理乳腺癌MDA-MB-231 细胞24 h 后,MDA-MB-231 细胞的迁移能力明显减弱。与C组相比,P1、P2、P3组的细胞迁移抑制率分别为:27.93%、57.90%、76.51%(各组之间P<0.05);S组与 C组相比无统计学差异(P>0.05,图 3)。
|
图 3 丙泊酚对MDA-MB-231细胞迁移能力的影响 Figure 3 Effect of propofol on the migration of MDA-MB-231 cells (×400). A: Group C; B: Group S; C: Group P1; D: Group P2; E: Group P3. *P<0.05 vs group C; #P<0.05 vs group P1; △P<0.05 vs group P2 group. |
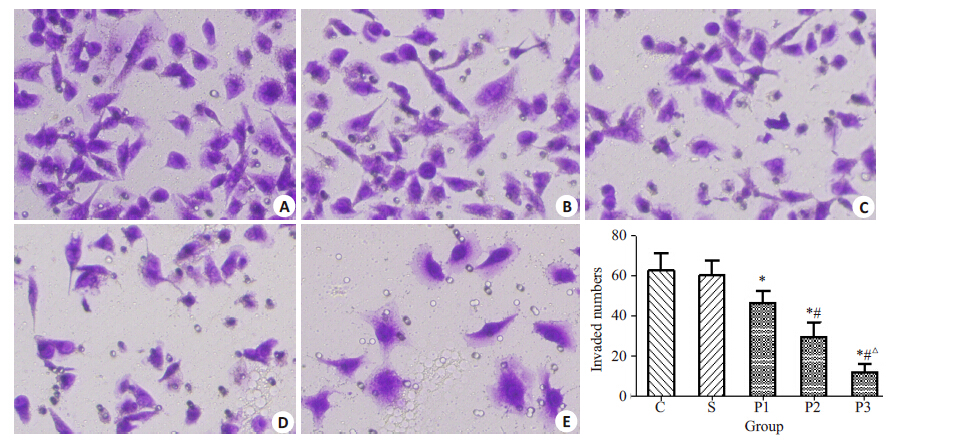
不同浓度的丙泊酚溶液处理乳腺癌MDA-MB-231 细胞24 h 后,MDA-MB-231 细胞的侵袭能力明显减弱。与C组相比,P1、P2、P3组的细胞侵袭抑制率分别为:25.72%、53.32%、81.43%(各组之间P<0.05);S组与 C组相比无统计学差异(P>0.05,图 4)。
|
图 4 丙泊酚对MDA-MB-231细胞侵袭能力的影响 Figure 4 Effect of propofol on invasion of MDA-MB-231 cells (×400). A: Group C; B: Group S; C: Group P1; D: Group P2; E: Group P3. *P<0.05 vs group C; #P<0.05 vs group P1; △P<0.05 vs group P2 group. |
肿瘤的侵袭和转移是一个复杂的生物学过程,受许多基因和蛋白的调控以及其它很多因素的影响。目前手术切除仍然是多数实体肿瘤的主要治疗选择,但难以避免术后复发和转移。丙泊酚作为目前最常用于肿瘤切除手术的静脉麻醉药,其对肿瘤的影响受到了广泛关注。Mammoto等[10]首次提出丙泊酚可以直接抑制人宫颈癌HeLa、骨肉瘤HOS、纤维肉瘤HT1080和黑色素瘤 RPMI-7951细胞系的侵袭能力。许多研究表明,丙泊酚对不同肿瘤细胞的作用机制有所不同。丙泊酚通过抑 A549肺腺癌上皮细胞中基质金属蛋白酶MMP-2和 9的表达,减弱细胞的侵袭和转移能力;通过减少Slug 的表达,抑制卵巢癌细胞的侵袭和转移[4]。上述研究表明,丙泊酚可以通过不同的作用途径抑制不同类型肿瘤细胞的侵袭和转移。
三阴性乳腺癌是雌激素受体、孕激素受体、人表皮生长因子受体表达均为阴性的特殊乳腺癌,约占乳腺癌发病率的15%,易转移、易复发、预后差。MDA-MB- 231细胞是三阴性乳腺癌细胞中研究得最多最充分的细胞,具有代表性。Li等[5]的研究表明丙泊酚能够通过抑制NF-κB 通路降低人乳腺癌MDA-MB-231 细胞 MMP的表达水平,从而显著地抑制了乳腺癌细胞的迁移和侵袭。研究还发现,丙泊酚能通过下调NET1基因的表达抑制人乳腺癌MDA-MB-231细胞的迁移[11]。我们前期研究表明,丙泊酚可抑制乳腺癌MADB106细胞的肺转移,下调转移瘤组织中MTA1和Wnt1的表达[12]。 可见,丙泊酚可抑制乳腺癌细胞的侵袭和转移,而且对不同类型的乳腺癌细胞,可能有不同的作用机制。细胞运动和细胞外基质的降解是乳腺癌细胞侵袭转移进程中的关键步骤。本研究通过划痕实验和Transwell小室模拟在体三阴性乳腺癌细胞的侵袭迁移过程,发现丙泊酚可明显抑制乳腺癌MDA-MB-231 细胞的运动能力、迁移和侵袭能力,而且浓度越高,丙泊酚的抑制作用越明显,呈剂量依赖性。丙泊酚的临床麻醉相关血药浓度单独应用为25~98 μmol/L[13]。本研究证实当丙泊酚浓度高于25 μmol/L时即能显著抑制乳腺癌MDA-MB-231细胞的侵袭和迁移,表明本研究所选择的丙泊酚细胞水平受试浓度的可行性,且具有临床参考价值。
某些肿瘤的侵袭和转移能力与特定的lncRNA的表达失调有关[14-15]。H19 是最早发现与肿瘤相关的 lncRNA之一。Yan等[16]发现H19通过降低let-7的生物学效应,上调c-Myc、Hmga2和Imp3的表达来促进人卵巢癌细胞的迁移和侵袭。H19 还可通过调节 mir-194-5p 使其靶蛋白AKT2 上调来促进胆囊癌细胞的增殖[17]。有学者发现,H19的表达量与乳腺癌细胞、 胃癌细胞的恶性程度均呈正相关[9, 18]。新的研究发现, H19通过调节下游的miR-675和泛素连接酶E3家族来影响乳腺癌MDA-MB-231细胞的侵袭和转移能力,且 H19的表达量与其侵袭和转移能力呈正相关[19]。提示下调H19 在肿瘤细胞的表达可抑制肿瘤的侵袭和转移。我们因此观察了丙泊酚对乳腺癌MDA-MB-231细胞H19表达量的变化及迁移和侵袭能力的影响。研究表明,丙泊酚呈剂量依赖性下调乳腺癌MDA-MB-231 细胞H19的表达,从而抑制MDA-MB-231细胞的侵袭和迁移能力。本研究将H19对肿瘤细胞的影响引入丙泊酚的抗肿瘤作用机制的研究,为探索丙泊酚的抗肿瘤作用及其机制提供新的研究方向。
综上所述,静脉全麻药物丙泊酚,可剂量依赖性下调人乳腺癌MDA-MB-231细胞H19的表达,来抑制其迁移和侵袭进程。但丙泊酚通过什么途径下调MDA-MB-231细胞H19的表达有待进一步研究。丙泊酚应用于乳腺癌切除手术,需要进一步的动物和临床观察作支持。
| [1] |
Prat A, Adamo B, Cheang MC, et al. Molecular characterization of basal-like and non-basal-like triple-negative breast cancer[J].
Oncologist,2013, 18 (2) : 123-33.
DOI: 10.1634/theoncologist.2012-0397. ( 0) 0)
|
| [2] |
Huang H, Benzonana LL, Zhao H, et al. Prostate cancer cell malignancy via modulation of HIF-1α pathway with isoflurane and propofol alone and in combination[J].
Br J Cancer,2014, 111 (7) : 1338-49.
DOI: 10.1038/bjc.2014.426. ( 0) 0)
|
| [3] |
Zhang J, Shan WF, Jin TT, et al. Propofol exerts anti-hepatocellular carcinoma by microvesicle-mediated transfer of miR-142-3p from macrophage to cancer cells[J].
J Transl Med,2014, 12 (5) : 279.
( 0) 0)
|
| [4] |
Wang P, Chen J, Mu LH, et al. Propofol inhibits invasion and enhances paclitaxel-induced apoptosis in ovarian cancer cells through the suppression of the transcription factor slug[J].
Eur Rev Med Pharmacol Sci,2013, 17 (13) : 1722-9.
( 0) 0)
|
| [5] |
Li Q, Zhang L, Han Y, et al. Propofol reduces MMPs expression by inhibiting NF-κB activity in human MDA-MB-231 cells[J].
Biomedi Pharmacothera,2012, 66 (1) : 52-6.
DOI: 10.1016/j.biopha.2011.10.006. ( 0) 0)
|
| [6] |
Yang C, Tang R, Ma X, et al. Tag SNPs in long non-coding RNA H19 contribute to susceptibility to gastric cancer in the Chinese Han population[J].
Oncotarget,2015, 6 (17) : 15311-20.
DOI: 10.18632/oncotarget. ( 0) 0)
|
| [7] |
Conigliaro A, Costa V, Lo Dico A, et al. CD90+ liver cancer cells modulate endothelial cell phenotype through the release of exosomes containing H19 lncRNA[J].
Mol Cancer,2015, 14 (5) : 155.
( 0) 0)
|
| [8] |
Verhaegh GW, Verkleij L, Vermeulen SH, et al. Polymorphisms in the H19 gene and the risk of bladder cancer[J].
Eur Urol,2008, 54 (5) : 1118-26.
DOI: 10.1016/j.eururo.2008.01.060. ( 0) 0)
|
| [9] |
Lottin S, Adriaenssens E, Dupressoir T, et al. Overexpression of an ectopic H19 gene enhances the tumorigenic properties of breast cancer cells[J].
Carcinogenesis,2002, 23 (11) : 1885-95.
DOI: 10.1093/carcin/23.11.1885. ( 0) 0)
|
| [10] |
Mammoto T, Mukai M, Mammoto A, et al. Intravenous anesthetic, propofol inhibits invasion of cancer cells[J].
Cancer Lett,2002, 184 (2) : 165-70.
DOI: 10.1016/S0304-3835(02)00210-0. ( 0) 0)
|
| [11] |
Ecimovic P, Murray D, Doran P, et al. Propofol and bupivacaine in breast cancer cell function in vitro-role of the NET1 gene[J].
Anticancer Res,2014, 34 (3) : 1321-31.
( 0) 0)
|
| [12] |
张雅静, 林春水, 汪威, 等. 丙泊酚对荷瘤大鼠肿瘤肺转移及MTA1和 Wnt1表达的影响[J].
南方医科大学学报,2014 (7) : 1011-5.
( 0) 0)
|
| [13] |
Kazama T, Ikeda K, Morita K. Reduction by fentanyl of the Cp50 values of propofol and hemodynamic responses to various noxious stimuli[J].
Anesthesiology,1997, 87 (2) : 213-27.
DOI: 10.1097/00000542-199708000-00007. ( 0) 0)
|
| [14] |
Ma Y, Yang Y, Wang F, et al. Long non-coding RNA CCAL regulates colorectal cancer progression by activating Wnt/β-catenin signalling pathway via suppression of activator protein 2α[J].
Gut,2015, 16 (5) : 8-12.
( 0) 0)
|
| [15] |
Xing Z, Lin A, Li C, et al. lncRNA directs cooperative epigenetic regulation downstream of chemokine signals[J].
Cell,2014, 159 (5) : 1110-25.
DOI: 10.1016/j.cell.2014.10.013. ( 0) 0)
|
| [16] |
Yan L, Zhou J, Gao Y, et al. Regulation of tumor cell migration and invasion by the H19/let-7 axis is antagonized by metformininduced DNA methylation[J].
Oncogene,2015, 34 (23) : 3076-84.
DOI: 10.1038/onc.2014.236. ( 0) 0)
|
| [17] |
Wang SH, Wu XC, Zhang MD, et al. Long noncoding RNA H19 contributes to gallbladder cancer cell proliferation by modulated miR-194-5p targeting AKT2[J].
Tumour Biol,2016, 4 (1) : 32-6.
( 0) 0)
|
| [18] |
Li H, Yu B, Li J, et al. Overexpression of lncRNA H19 enhances carcinogenesis and metastasis of gastric cancer[J].
Oncotarget,2014, 5 (8) : 2318-29.
DOI: 10.18632/oncotarget. ( 0) 0)
|
| [19] |
Vennin C, Spruyt N, Dahmani F, et al. H19 non coding RNAderived miR-675 enhances tumorigenesis and metastasis of breast cancer cells by downregulating c-Cbl and Cbl-b[J].
Oncotarget,2015, 6 (30) : 29209-23.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
