2. 澳门大学健康科学学院,中国澳门 999078
2. Faculty of Health Sciences, University of Macau, Macau 999078, China
糖尿病足是糖尿病患者最严重的慢性并发症之一, 糖尿病患者发生足部溃疡的终生风险高达25%[1]。目 前针对糖尿病足缺乏有效的临床治疗手段,间充质干细 胞(MSCs)能促进新生血管形成、恢复缺血肢体的血流 灌注,是治疗糖尿病足的新选择[2-3]。缺血性疾病的主要 病因是内皮功能障碍,治疗性血管新生的传统理念是通 过注射内皮细胞和生长因子来促进组织修复,然而,由 于免疫原性和细胞来源的限制,大多数情况下内皮细胞 用于血管治疗并不可行[4]。间充质干细胞具备低免疫 原性、多分化潜能的特征,在组织工程的血管新生中发 挥重要作用。研究最早、最广泛的是骨髓间充质干细胞 (BMSCs),但抽取骨髓是高度侵入性操作,且BMSCs 只占骨髓细胞的0.01%~0.001%,抽取骨髓量大,对病人 造成创伤较大[5]。而脂肪干细胞(ASCs)从脂肪组织中 分离出来,具有来源广泛、容易获得的特征,ASCs占脂 肪抽吸物有核细胞的2%[6],且研究显示ASCs的增殖能 力比BMSCs更强[7]。两者均具备多向分化潜能,但对 于分化为血管治疗最有价值的内皮细胞方面,尚无研究 比较两者的强弱。因此,本研究拟诱导ASCs分化为内 皮细胞,并与“金标准”BMSCs对比,有助于选出有利于 组织工程血管新生的间充质干细胞来源,有利于血管疾 病细胞疗法的发展。
1 材料和方法 1.1 材料和试剂SPF级200~250 g SD大鼠10只,购于南方医科大学实验动物中心,动物合格证编号:SCXK(粤)2011-0015。 主要试剂:胎牛血清购自德国PAN,DMEM/F12培养基购自Gibco,VEGF165和bFGF购自PeproTech,Anti-Rat CD29 FITC、Anti-Rat CD90 PE、Anti-Rat CD45 APC 购自eBioscience,PECAM-1(M-20)购自Santa Cruz, Trizol购自Invitrogen,CCK-8法细胞增殖检测试剂盒、 DAPI染液购自南京凯基生物,Dil-乙酰化低密度脂蛋白购自广州奕源生物。
1.2 实验方法 1.2.1 大鼠脂肪干细胞的分离、培养SD大鼠用3%戊巴比妥钠腹腔注射麻醉,取双侧腹股沟部脂肪组织, PBS缓冲液清洗,眼科剪剪碎,加入2倍体积的0.1%Ⅰ 型胶原酶混匀,于37 ℃振荡消化60 min。消化结束后, 加入全培(10%FBS,DMEM/F12,1%青链霉素混合液) 终止消化,吹打混匀,800 g 离心5 min,沉淀用全培重悬,相继用100 μm、70 μm的细胞筛网过滤,收集滤液, 细胞接种于培养皿中,置于37 ℃,5% CO2,饱和湿度的培养箱中培养。24 h后首次换液,以后每2~3 d换液,细胞汇合达80%~90%时进行传代培养。
1.2.2 大鼠骨髓间充质干细胞的分离、培养SD大鼠用3%戊巴比妥钠麻醉后断颈处死,75%酒精浸泡5 min, 取双侧胫骨、股骨,去除表面肌肉,PBS液反复冲洗,剪断股骨、胫骨两端,用全培反复冲洗骨髓腔至变白,收集冲洗液,800 g离心5 min,沉淀用全培重悬,接种于培养皿中,置于37 ℃,5% CO2,饱和湿度的细胞培养箱中培养。24 h后首次换液,以后每2~3 d换液,细胞汇合达 80%~90%时进行传代培养。
1.2.3 流式细胞仪鉴定BMSCs和ASCs细胞表面标志物取生长旺盛的第3代BMSCs和ASCs,制成1×105/mL 的细胞悬液,PBS洗涤2次,加入100 μL含0.1%BSA的 PBS 液,每管相继加入FITC-CD29,PE-CD90,APCCD45 抗大鼠抗体,充分混匀后冰上避光孵育30 min,用含0.1%BSA的PBS 液洗涤2 次,250 g 离心5 min,加 200 μL 0.1%BSA的PBS液重悬,混匀,流式细胞分析仪上样检测。
1.2.4 CCK-8 法绘制细胞生长曲线取第3 代BMSCs和ASCs,制成5×104/mL的单细胞悬液,在96孔板加入 100 μL/孔,置于细胞培养箱培养24 h,于第1~7天每天统一时间点行CCK-8 法检测细胞增殖,每次取3 个孔,加3个单纯完全培养基复孔,每孔加入CCK-8 10 μL, 培养箱孵育3 h,酶标仪在450 nm波长处检测每孔的A 值,其余孔每2 d换液1次。以时间为横轴,A值为纵轴绘制生长曲线。
1.2.5 诱导BMSCs 和ASCs 向内皮细胞分化制备BMSCs和ASCs单细胞悬液,以2.5×105/孔密度接种在 6孔板培养,待细胞生长密度达到80%后,加入内皮细胞诱导液(含DMEM,10% FBS,50 μg/L VEGF165,10 μg/L bFGF),3 d换液1次,诱导21 d,或延长诱导,定期于倒置相差显微镜下观察细胞的形态变化。
1.2.6 内皮细胞的鉴定 1.2.6.1 细胞形态观察诱导期间用倒置相差显微镜观察细胞的形态变化,拍照记录。
1.2.6.2 qPCR 检测内皮细胞特异性标志物CD31、KDR、vWF mRNA的表达情况经内皮诱导21 d后,提取细胞RNA,进行qPCR检测,每组细胞设有3个平行复孔。Primer5.0设计引物,以GAPDH作为内参基因, 设计的引物见表 1。
| 表 1 荧光定量PCR引物序列 Table 1 Primer sequence for real-time PCR |
将诱导后的细胞均匀铺于玻底培养皿中,培养箱孵育24 h, 去全培,4%多聚甲醛固定15 min,PBS清洗3 次,加入 500 μL 3% BSA封闭非特异性抗原,30 min后去掉封闭液,加入1∶50的CD31抗大鼠抗体,4 ℃孵育过夜。第2 天取培养皿,吸走一抗,PBS清洗3次,加入1∶50的二抗, 避光孵育1 h。去掉二抗,PBS液清洗3次,加入500 μL DAPI工作液染色15 min,弃去染色液,PBS清洗,滴加 300 μL甘油,在激光共聚焦显微镜下观察、拍照。
1.2.6.4 荧光显微镜检测内皮样细胞摄取Dil-Ac-LDL的能力将诱导的BMSCs和ASCs以5×104/孔的密度均匀铺于24孔板,至细胞铺满孔80%以上,更换含Dil 标记的乙酰化低密度脂蛋白20 mg/L 的完全培养基, 5% CO2、37 ℃培养箱孵育4 h,去掉培养基,4%多聚甲醛固定15 min,PBS液清洗3次,加入DAPI工作液染色 10 min,PBS液清洗后于倒置荧光显微镜下观察拍照, 红色荧光表示摄取了Dil-Ac-LDL的细胞,蓝色荧光表示细胞核。
1.2.6.5 Matrigel成管实验取出Matrigel于4 ℃过夜融化,96孔板、枪头盒均4 ℃过夜预冷;次日在冰盒上进行铺胶,96 孔板每孔加入50 μL Matrigel,诱导组和未诱导组各3个复孔,于4 ℃平衡10 min后,置于37 ℃孵育 60 min;每孔加入细胞约2×104个,置于37 ℃孵育6 h 后,于倒置显微镜下观察拍照。
1.2.7 统计方法采用SPSS 21.0统计软件分析数据,数据以均数±标准差表示,进行正态性、方差齐性检验,两 样本均数比较采用独立样本t检验,以P<0.05为差异有 统计学意义。
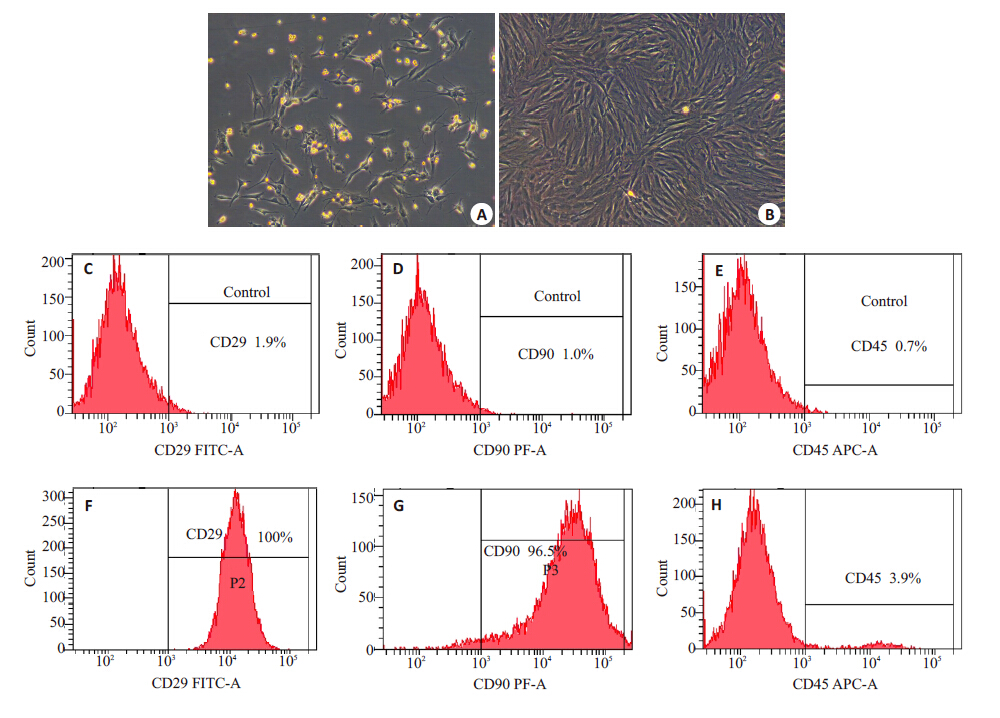
2 结果 2.1 大鼠骨髓间充质干细胞的分离培养全骨髓贴壁法培养原代细胞,接种后镜下可见大量大小不一呈圆形或类圆形的混合细胞;24 h首次换液后可见部分细胞贴壁,第3天可见细胞克隆团块形成;约 10 d,细胞密度汇合达80%。第3代细胞呈均一的长梭形,类成纤维细胞样形态,流式细胞仪检测间充质干细胞表面标志物CD29、CD90 均为阳性(100%、96.5%), 造血系细胞表面标志物CD45阴性(3.9%)(图 1)。
|
图 1 骨髓间充质干细胞的鉴定 Figure 1 Identification of bone marrow mesenchymal stem cells. A: Microscopic images of BMSCs on day 3 (Original magnification: ×100); B: Passage 3 of BMSCs (×100); C-H: Flow cytometry for identification of the phenotype of BMSCs. |
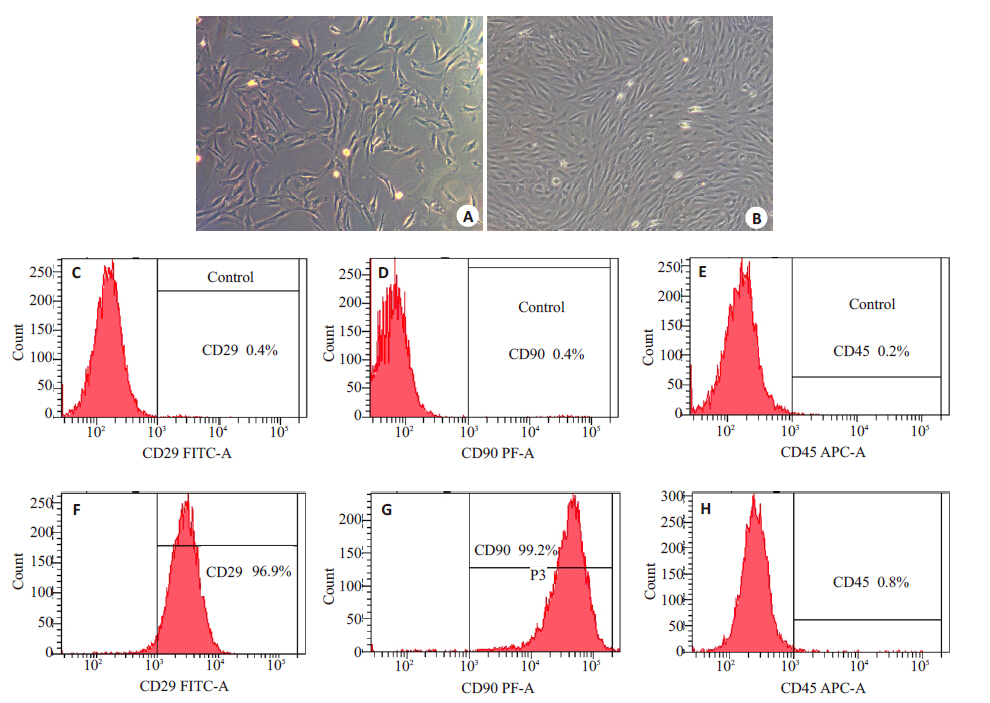
贴壁法培养原代细胞,接种后镜下可见大量大小不一呈圆形或类圆形的混合细胞;24 h首次换液后可见部分细胞贴壁,第3天可见较多长梭形样的贴壁细胞;约7d,细胞密度汇合即达80%。第3代细胞呈均一的长梭形,类成纤维细胞样形态,流式细胞仪检测间充质干细胞表面标志物CD29、CD90均为阳性(96.9%和99.2%), 造血系细胞表面标志物CD45阴性(0.8%)(图 2)。
|
图 2 脂肪干细胞的鉴定 Figure 2 Identification of adipose-derived stem cells. A: Microscopic images of ASCs on day 3 (×100); B: Passage 3 of ASCs (×100); C-H: Flow cytometry for identification of the phenotype of ASCs. |
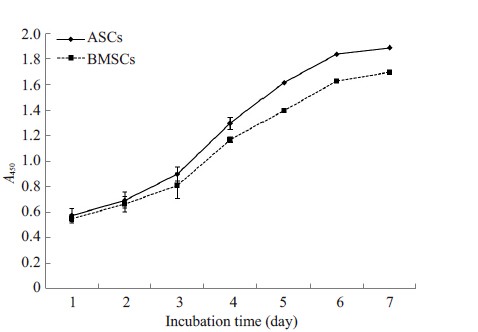
采用CCK-8法检测1~7 d ASCs和BMSCs的A值 和单纯完全培养基的A值,两者相减得出最后的A值。 经独立样本t检验分析数据,结果如图 3所示,除第1、2、 3天和第7天外,第4、5、6天两组细胞的A值均有统计学 差异(P<0.05),说明ASCs增殖能力强于BMSCs。
|
图 3 ASCs和BMSCs的生长曲线 Figure 3 Cell growth curve of ASCs and BMSCs. CCK-8 proliferation experiment showed that ASCs proliferated more quickly than BMSCs (P<0.05). |
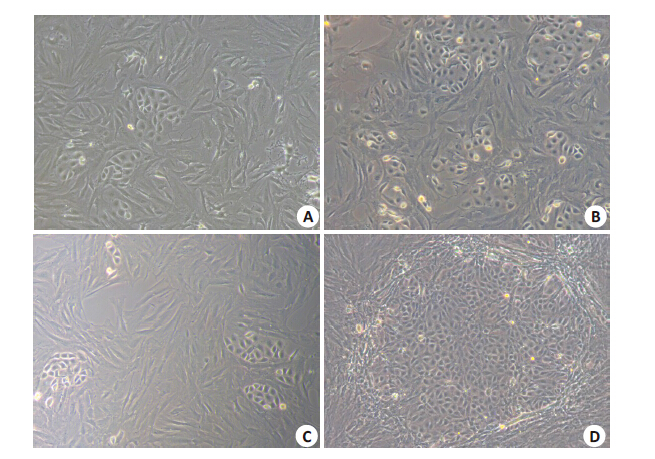
诱导4 d后,BMSCs和ASCs出现多角形,11 d 后,细胞开始变圆,21 d 后,BMSCs 和 ASCs出现“岛状的”典型内皮细胞“铺路石”样排列,继 续培养35 d后,可见细胞广泛由长梭形变成类圆形样的 细胞,整体成“铺路石”状,镜下观察ASCs分化成类圆形 的细胞面积比BMSCs更大(图 4)。
|
图 4 向内皮诱导后的BMSCs和ASCs Figure 4 Endothelial differentiation of BMSCs and ASCs. A: Microscopic images showing endothelial differentiation of BMSCs at 21 days (×100); B: Endothelial differentiation of BMSCs at 35 days (× 100); C: Endothelial differentiation of ASCs at 21 days (× 100); D: Endothelial differentiation of ASCs at 35 days (×100). |
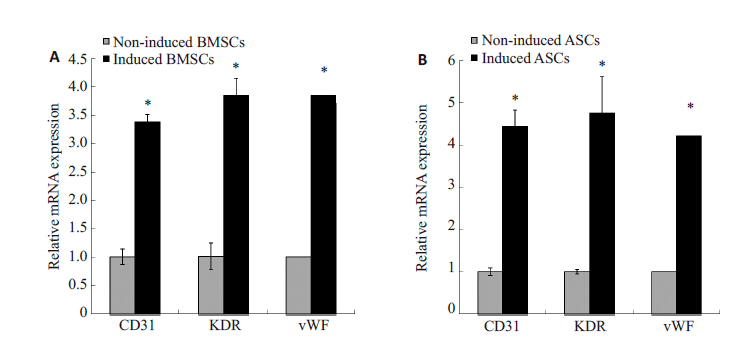
vWF mRNA相对表达量本研究采用ΔΔCT法,以未诱导组的表达量为参照,分别测定两个诱导组的MSCs相对未诱导组的CD31、KDR、vWF mRNA表达水平。采用独立样本t检验对数据进行统计分析,结果如图 5所示,BMSCs、ASCs 经内皮诱导后,表达CD31、KDR、 vWF mRNA的水平比未诱导组增高,差异有统计学意义(P<0.05)。
|
图 5 Real-time PCR分析BMSCs和ASCs内皮相关因子表达水平 Figure 5 Real-time PCR analysis of expressions of endothelial-related factors in BMSCs (A) and ASCs (B). The results are expressed as fold increase compared with the expression in non-induced cells. Values are expressed as Mean±SD (n=3). *P<0.05. |
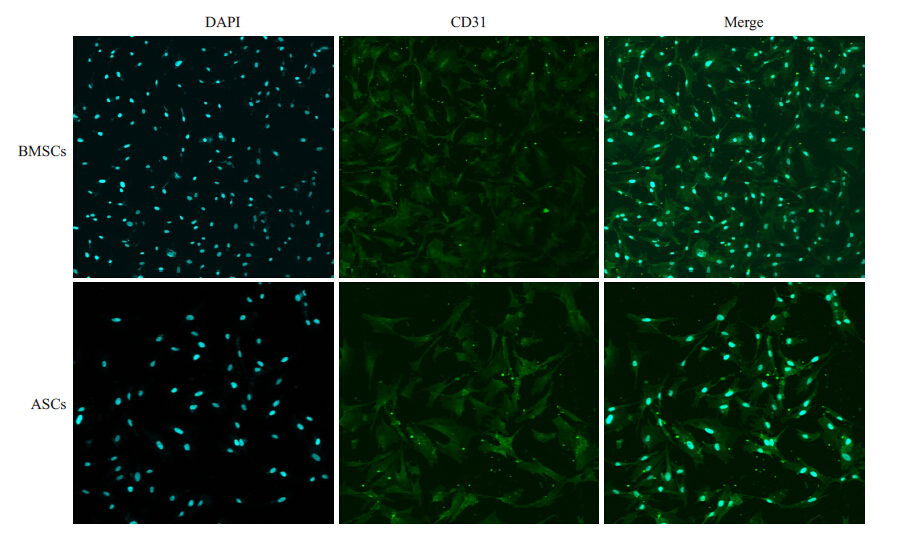
光染色CD31 抗原,激光共聚焦显微镜下观察可见 CD31抗原(FITC,绿色荧光)表达在MSCs的细胞膜表面,诱导组ASCs和BMSCs均表达CD31抗原,进一步证实ASCs和BMSCs均可诱导为内皮样细胞(图 6)。
|
图 6 诱导组BMSCs和ASCs表达CD31抗原 Figure 6 Confocal images of CD31 (green) expressed on BMSCs and ASCs after endothelial differentiation (×100). Cell nuclei are counterstained with DAPI (blue). |
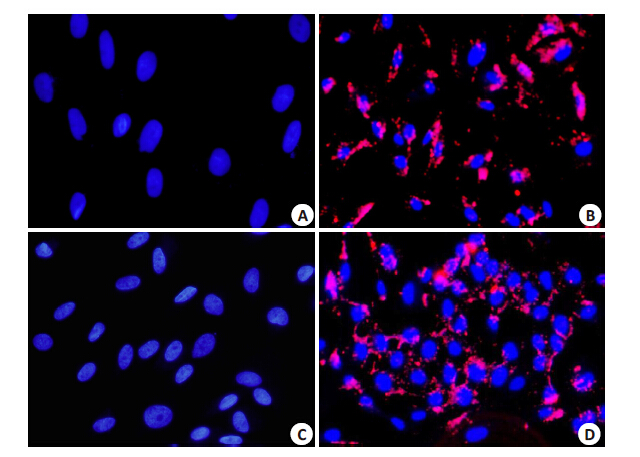
能力荧光显微镜下观察,蓝色荧光代表细胞核,红色荧光代表摄取了Dil-Ac-LDL的细胞,结果显示,未诱导组的MSCs均不具备摄取Dil-Ac-LDL的能力,而诱导组的BMSCs和ASCs均能够摄取Dil-Ac-LDL,进一步证实诱导后的细胞为内皮样细胞(图 7)。
|
图 7 诱导组BMSCs和ASC摄取Ac-LDL的能力 Figure 7 Immunocytochemical staining of BMSCs and ASCs (× 100). Cell nuclei are counterstained with DAPI (blue), and red fluorescence in the cells indicates Ac-LDL uptake. A: Control BMSCs; B: BMSCs after endothelial differentiation; C: Control ASCs; D: ASCs after endothelial differentiation. |
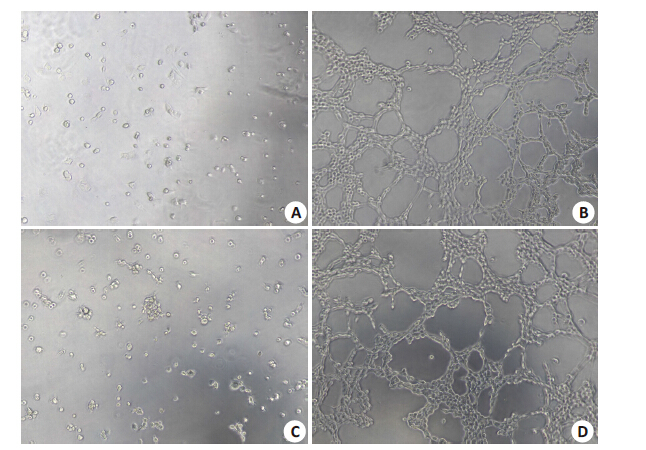
后,倒置显微镜下观察可见未诱导组细胞呈球状聚拢, 而诱导组ASCs和BMSCs均成管样结构,进一步证实 ASCs和BMSCs均可诱导为内皮细胞(图 8)。
|
图 8 Matrigel成管试验 Figure 8 Ability of BMSCs and ASCs after endothelial differentiation for tube formation on Matrigel (Original magnification: × 50). A: Control BMSCs; B: BMSCs after endothelial differentiation; C: Control ASCs; D: ASCs after endothelial differentiation. |
骨髓间充质干细胞和脂肪干细胞作为研究最广泛的成体干细胞[8],两者均具有间充质干细胞的典型特征, 能进行自我更新、多向分化潜能[9]。本研究从SD大鼠中原代提取BMSCs和ASCs,通过流式鉴定膜蛋白的表达证实获得的细胞为间充质干细胞,提示全骨髓贴壁法和0.1%I型胶原酶消化法提取的BMSCs和ASCs质量较佳,能获得比较纯的间充质干细胞,呈经典的成纤维细胞样形态,可用于后续MSCs的研究。通过CCK-8法绘制BMSCs和ASCs的生长曲线,结果表明,ASCs的增殖能力更强,这与大多数学者的研究结果一致[7, 10],再加上ASCs更容易获得,来源丰富等特征,提示ASCs比 BMSCs更具有应用前景。
为解决糖尿病足溃疡以及外周动脉闭塞性疾病等下肢循环差、血管供应不足的问题,需要新生的血管内皮细胞恢复缺血组织的血管化[11],本研究诱导SD大鼠骨髓间充质干细胞和脂肪干细胞向内皮细胞分化,使用最经典的、研究最深入的VEGF和bFGF作为内皮细胞诱导液[12]。结果证实来源于中胚层的BMSCs和ASCs 不仅能分化为文献报道的成骨、脂肪、软骨等中胚层细胞[13],还能分化成内皮细胞,通过qPCR和免疫荧光检测证实其具备成熟内皮细胞的特定标志物,进一步的验证也表明诱导后的细胞具备摄取Ac-LDL的能力以及成血管的能力,证实BMSCs和ASCs可以分化成功能型的内皮细胞。功能型的内皮细胞能快速形成新生血管[14],是组织工程成功的前提[15],因此间充质干细胞是治疗血管性疾病具有前景的干细胞来源。而与 BMSCs相比较,相同培养条件下ASCs的增殖能力更强、细胞状态更好,相同诱导条件下ASCs广泛分化为内皮细胞的时间更短,提示其能力更强,更适合用于治疗糖尿病足溃疡这种全身基础条件差、血运重建难的情况[16]。而且抽取骨髓对于患者是较大的创伤, BMSCs的增殖潜能、多向分化潜能会随着年龄的增长而下降[17]。脂肪组织从抽脂术中废弃的脂肪组织中获得,研究显示年龄、性别、肥胖、肾功能衰竭和血管疾病不影响分离的有效性[18],本文创新性地比较BMSCs和 ASCs向内皮分化的能力,有利于选出对于组织工程血管新生更优的间充质干细胞来源,结果表明ASCs是干细胞移植治疗糖尿病足更合适的来源。
目前也有大量的临床前研究探索脂肪干细胞治疗糖尿病伤口模型的有效性,证实其可通过分泌多种生长因子和细胞因子,改善慢性炎症,整合到微血管循环中, 从而加快伤口愈合[19-21],而利用脂肪干细胞及相关细胞产品注册的临床试验也日益增多[22-24]。与骨髓单个核细胞对比,脂肪组织干细胞的治疗性血管新生的作用还体现在促进局部抗炎因子IL-10的表达、释放M2型巨噬细胞等[25]。随着研究的更广泛和深入,更充分证实 ASCs在组织工程应用中具有广阔的前景。
| [1] |
Bowling FL, Rashid ST, Boulton AJ. Preventing and treating foot complications associated with diabetes mellitus[J].
Nat Rev Endocrinol,2015, 11 (10) : 606-16.
DOI: 10.1038/nrendo.2015.130. ( 0) 0)
|
| [2] |
Tao H, Han Z, Han ZC, et al. Proangiogenic features of mesenchymal stem cells and their therapeutic applications[J].
Stem Cells Int,2016, 23 (6) : 1314709.
( 0) 0)
|
| [3] |
Liew A, Bhattacharya V, Shaw J, et al. Cell therapy for critical limb ischemia: a Meta-Analysis of randomized controlled trials[J].
Angiology,2016, 67 (5) : 444-55.
DOI: 10.1177/0003319715595172. ( 0) 0)
|
| [4] |
Davis GE, Norden PR, Bowers SL. Molecular control of capillary morphogenesis and maturation by recognition and remodeling of the extracellular matrix: functional roles of endothelial cells and pericytes in health and disease[J].
Connect Tissue Res,2015, 56 (5) : 392-402.
DOI: 10.3109/03008207.2015.1066781. ( 0) 0)
|
| [5] |
Yousefi AM, James PF, Akbarzadeh R, et al. Prospect of stem cells in bone tissue engineering: a review[J].
Stem Cells Int,2016 : 6180487.
( 0) 0)
|
| [6] |
Bajek A, Gurtowska N, Olkowska J, et al. Adipose-Derived stem cells as a Tool in Cell-Based therapies[J].
Arch Immunol Ther Exp (Warsz),2016 : 13.
( 0) 0)
|
| [7] |
Izadpanah R, Trygg C, Patel B, et al. Biologic properties of mesenchymal stem cells derived from bone marrow and adipose tissue[J].
J Cell Biochem,2006, 99 (5) : 1285-97.
DOI: 10.1002/(ISSN)1097-4644. ( 0) 0)
|
| [8] |
Das M, Sundell IB, Koka PS. Adult mesenchymal stem cells and their potency in the cell-based therapy[J].
J Stem Cells,2013, 8 (1) : 1-16.
( 0) 0)
|
| [9] |
Teng M, Huang Y, Zhang H. Application of stems cells in wound healing--an update[J].
Wound Repair Regen,2014, 22 (2) : 151-60.
DOI: 10.1111/wrr.12152. ( 0) 0)
|
| [10] |
De Ugarte DA, Morizono K, Elbarbary A, et al. Comparison of multi-lineage cells from human adipose tissue and bone marrow[J].
Cells Tissues Organs,2003, 174 (3) : 101-9.
DOI: 10.1159/000071150. ( 0) 0)
|
| [11] |
Klar AS, Güven S, Zimoch J, et al. Characterization of vasculogenic potential of human adipose-derived endothelial cells in a threedimensional vascularized skin substitute[J].
Pediatr Surg Int,2016, 32 (1) : 17-27.
DOI: 10.1007/s00383-015-3808-7. ( 0) 0)
|
| [12] |
Freiman A, Shandalov Y, Rozenfeld D, et al. Adipose-derived endothelial and mesenchymal stem cells enhance vascular network formation on three-dimensional constructs in vitro[J].
Stem Cell Res Ther,2016, 7 (1) : 5.
DOI: 10.1186/s13287-015-0251-6. ( 0) 0)
|
| [13] |
Caruana G, Bertozzi N, Boschi E, et al. Role of adipose-derived stem cells in chronic cutaneous wound healing[J].
Ann Ital Chir,2015, 86 (1) : 1-4.
( 0) 0)
|
| [14] |
Liu X, Qi J, Xu X, et al. Differentiation of functional endothelial cells from human induced pluripotent stem cells: A novel, highly efficient and cost effective method[J].
Differentiation,2016, 3 (15) : 30074-8.
( 0) 0)
|
| [15] |
Huang NF, Li S. Mesenchymal stem cells for vascular regeneration[J].
Regen Med,2008, 3 (6) : 877-92.
DOI: 10.2217/17460751.3.6.877. ( 0) 0)
|
| [16] |
Dash SN, Dash NR, Guru B, et al. Towards reaching the target: clinical application of mesenchymal stem cells for diabetic foot ulcers[J].
Rejuvenation Res,2014, 17 (1) : 40-53.
DOI: 10.1089/rej.2013.1467. ( 0) 0)
|
| [17] |
Stenderup K, Justesen J, Clausen C, et al. Aging is associated with decreased maximal Life span and accelerated senescence of bone marrow stromal cells[J].
Bone,2003, 33 (6) : 919-26.
DOI: 10.1016/j.bone.2003.07.005. ( 0) 0)
|
| [18] |
Volz AC, Huber B, Kluger PJ. Adipose-derived stem cell differentiation as a basic tool for vascularized adipose tissue engineering[J].
Differentiation,2016, 92 (1/2) : 52-64.
( 0) 0)
|
| [19] |
Nambu M, Kishimoto S, Nakamura S, et al. Accelerated wound healing in Healing-Impaired db/db mice by autologous adipose Tissue-Derived stromal cells combined with atelocollagen matrix[J].
Ann Plast Surg,2009, 62 (3) : 317-21.
DOI: 10.1097/SAP.0b013e31817f01b6. ( 0) 0)
|
| [20] |
Lee SH, Lee JH, Cho KH. Effects of human adipose-derived stem cells on cutaneous wound healing in nude mice[J].
Ann Dermatol,2011, 23 (2) : 150-5.
DOI: 10.5021/ad.2011.23.2.150. ( 0) 0)
|
| [21] |
Amos PJ, Kapur SK, Stapor PC, et al. Human adipose-derived stromal cells accelerate diabetic wound healing: impact of cell formulation and delivery[J].
Tissue Eng Part A,2010, 16 (5) : 1595-606.
DOI: 10.1089/ten.tea.2009.0616. ( 0) 0)
|
| [22] |
Ebrahimian TG, Pouzoulet F, Squiban C, et al. Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing[J].
Arterioscler Thromb Vasc Biol,2009, 29 (4) : 503-10.
DOI: 10.1161/ATVBAHA.108.178962. ( 0) 0)
|
| [23] |
Yoshimura K, Suga H, Eto H. Adipose-derived stem/progenitor cells: roles in adipose tissue remodeling and potential use for soft tissue augmentation[J].
Regen Med,2009, 4 (2) : 265-73.
DOI: 10.2217/17460751.4.2.265. ( 0) 0)
|
| [24] |
Han SK, Kim HR, Kim WK. The treatment of diabetic foot ulcers with uncultured, processed lipoaspirate cells: a pilot study[J].
Wound Repair Regen,2010, 18 (4) : 342-8.
DOI: 10.1111/wrr.2010.18.issue-4. ( 0) 0)
|
| [25] |
Hao C, Shintani S, Shimizu Y, et al. Therapeutic angiogenesis by autologous adipose-derived regenerative cells: comparison with bone marrow mononuclear cells[J].
Am J Physiol Heart Circ Physiol,2014, 307 (6) : H869-79.
DOI: 10.1152/ajpheart.00310.2014. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
