2. 滨州医学院附属医院,山东烟台 264003 ;
3. 滨州医学院附属医院,山东烟台 264003 胸外科 ;
4. 中心实验室,山东 滨州 256600 ;
5. 滨州医学院附属医院,妇产科,山东 烟台 264003 ;
6. 上海交通大学医学院,上海 200025
2. Department of Thoracic Surgery,Binzhou Medical College, Yantai 264003, China ;
3. Department of Central Laboratory,Thoracic Surgery,Binzhou Medical College, Yantai 264003, China ;
4. Binzhou Medical College Hospital, Binzhou 256600, China ;
5. Department of obstetrics, Binzhou Medical College Hospital, Yantai 264003, China ;
6. Shanghai Jiaotong University Hospital, Shanghai 200025, China
麦胚凝集素(WGA)是一种可凝集细胞的蛋白质, 可以从多种谷类中提取[1]。WGA可介导体内多种生理过程,其通过诱导细胞膜表面上的糖类和蛋白质的相互作用参与了宿主细胞被细菌和病毒感染的初始步骤、胚胎发育中的细胞分化过程以及肿瘤转化相关过程[2],其对生物化学、细胞生物学、免疫学、组织器官学以及医学研究都有重要意义[3]。WGA的外源性功能包括对脂肪代谢的影响、对细胞膜通透性的影响、对成纤维细胞增殖的抑制、对免疫反应的调节作用等[4-5],WGA是研究细胞表面结构受体等的重要探针[6]。
有实验采取基因工程的方法,将WGA-cDNA片段转入质粒载体中,用腺病毒包装后感染细胞,当导入的目的基因在神经元特异的启动子表达后即可通过观察 WGA以达到示踪的效果[7]。实验在小鼠和果蝇上都取得了预期的效果[8]。而在一些神经退行性疾病如阿尔兹海默病、肌萎缩侧索硬化以及常见的运动神经元损伤疾病和脊髓损伤疾病的研究和治疗中,能够标记到相关的神经元进行追踪尤为重要[9-10]。本研究是运用基因工程的方法将WGA 导入到慢病毒载体Plvx-IRESZsGreen1 中,再用慢病毒包装,将构建好的质粒和其他三种包装质粒(RPEV、PRRE、VSVG)在293T细胞中进行共转染,获取病毒液后感染人源脂肪干细胞 (hADSCs),并将感染后的hADSCs注入小鼠的脑卒中模型的大脑损伤部位,2 周后取小鼠脑损伤部位制作冰冻切片,免疫荧光鉴定以达到追踪hADSCs的目的。 为hADSCs对脑损伤的细胞治疗效果,提供显色追踪的方法。
1 材料和方法 1.1 材料293T细胞(人胚肾细胞)、hADSCs(人源脂肪干细胞)、DH5α 感受态细胞、WGA-d 质粒、plvx-ires- ZsGreen1载体质粒(均为滨州医学院生物技术实验室提供);DMEM培养基、DMEM/F12培养基、磷酸盐缓冲液、胎牛血清、0.25%胰蛋白酶(均为美国Gibco 产品); Sorvall ST 16R 高速冷冻离心机(ThermoFisher), Sorvall Legend Micro 17R 微量高速冷冻离心机 (Thermo Scientific),PowerPac通用电泳仪(Bio-Rad), GelDoc XR型凝胶成像系统(BioRad),JB-CJ-2FX洁净工作台(苏州佳宝净化工程设备),电热恒温培养箱(上海福玛),高温灭菌锅(上海博讯),电子天平(北京 Sartorius,NanoDrop 2000 超微量分光光度计(赛默飞世尔),荧光显微镜(奥林巴斯,BX53),激光共聚焦显微镜(Leica,TCS SP5 Ⅱ)。
1.2 方法 1.2.1 重组慢病毒表达载体Plvx-WGA-IRES-ZsGreen1的构建分别用限制性内切酶EcoRⅠ酶切目的片段模板质粒WGA-d 和慢病毒载体质粒Plvx-IRESZsGreen1, 经琼脂糖凝胶电泳分离,回收并纯化目的条带,用DNA连接酶将纯化的WGA片段与Plvx-IRESZsGreen1 载体片段连接。连接产物转化DH5α感受态细胞,挑选阳性克隆,酶切鉴定,最终测序鉴定。
1.2.2 293T 细胞及hADSCs 的培养293T 细胞用含10% 胎牛血清的DMEM 培养基培养;健康吸脂脂肪剪成糜状,0.075% Ⅰ型胶原酶37 ℃振荡消化50 min,离心,去上清,DMEM/F12+10% FBS重悬沉淀,hADSCs 用含10%胎牛血清的DMEM/F12培养基培养。两种细胞均在37 ℃、5% CO2恒温培养箱中培养。
1.2.3 慢病毒包装将构建好的重组质粒Plvx-WGAIRES-ZsGreen1 以及其他3 种包装质粒RPEV、PRRE、 VSVG质粒在293T细胞中进行共转染。然后放置到 37 ℃,5% CO2恒温培养箱中培养过夜。24 h后用新鲜培养基更换细胞培养液,于37 ℃、5% CO2培养箱中继续培养48 h。荧光显微镜下观察病毒包装效果。
1.2.4 感染hADSCs转染72 h后,取共转染的293T细胞的培养液于新的离心管中。用0.45 μm的滤器过滤病毒液于无菌的干净收集管中。取出生长状态良好,汇合率70%左右hADSCs,弃去原培养基,向hADSCs中加入原培养液体积的过滤后的病毒液。
1.2.5 免疫荧光染色检测感染效果将24孔板细胞的培养液弃去,用500 μL 4%的多聚甲醛溶液固定20 min。 1mL 0.2%吐温-20 ℃处理10 min。封闭液处理60 min 后,加入一抗anti-WGA 500 μL,4 ℃过夜。PBS洗涤3 次后,加入500 μL二抗处理120 min。避光加入DAPI (1 μg/mL)500 μL,室温下处理15 min。荧光显微镜下检测感染效果。
1.2.6 免疫组织化学染色O感染后hADSCs植入MCA小鼠模型,制备脑冰冻切片并进行免疫组织化学染色常规制备C57/BL6雌性小鼠大脑中动脉阻塞MCAO模型,MCAO术后7 d,进行WGA慢病毒感染后hADSCs 移植。采用原位注射方式缓慢均匀微量多点地将细胞 (108/只)注入脑卒中造成的脑梗死损伤区域,注射完停顿30 s,缓慢退出,以防止细胞悬液外溢,确保细胞数量。2周后取小鼠脑损伤部位制作冰冻切片,免疫组织化学染色观察感染后的hADSCs在体内的存活情况。
2 结果 2.1 重组慢病毒表达载体Plvx-WGA-IRES-ZsGreen1的构建分别将WGA-d 质粒和慢病毒载体Plvx-IRESZsGreen1 进行酶切(图 1),1号泳道是酶切后的原WGA-d 质粒,2 号泳道是酶切后的Plvx-IRES-ZsGreen1 载体。 在1 号泳道处可以看到4 个条带,其中图片最下方的 1000 bp左右的是需要切胶回收的WGA片段。2号泳道共有两个条带,图片下方较亮的是没有切开的质粒, 上方的是切开一个缺口的质粒,即需要胶回收的目的条带。将酶切后的目的片段WGA和慢病毒载体质粒 Plvx-IRES-ZsGreen1进行纯化、回收连接反应后,转化感受态细胞,挑选阳性克隆,最终测序鉴定。测序结果表明Plvx-WGA-IRES-ZsGreen1 中的WGA 序列与 WGA-d质粒中的WGA序列完全一致,没有突变。

|
图 1 WGA质粒和Plvx-IRES-ZsGreen1 质粒的酶切结果 Figure 1 Enzyme digestion of WGA and Plvx- IRES-ZsGreen1. 0: DNA marker; 1: Products of enzyme digestion of WGA-d; 2: Product of enzyme digestion of Plvx-IRES-ZsGreen1. |
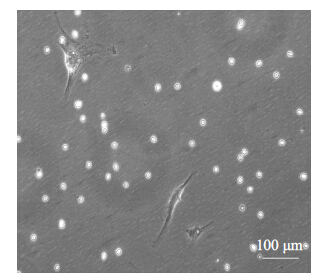
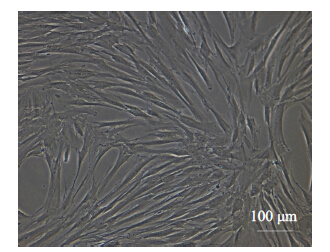
人源糜状健康吸脂脂肪经过0.075% I 型胶原酶 37 ℃振荡消化50 min后,离心,沉淀,去上清,DMEM/ F12+10% FBS重悬沉淀,37 ℃ 5% CO2培养24 h,有成纤维样细胞出现(图 2),7 d左右达80%铺满状态(图 3)。
|
图 2 培养24 h的原代人源脂肪干细胞 Figure 2 hADSCs in primary culture at 24 h. |
|
图 3 培养7 d的原代人源脂肪干细胞 Figure 3 hADSCs in primary culture at 7 days. |
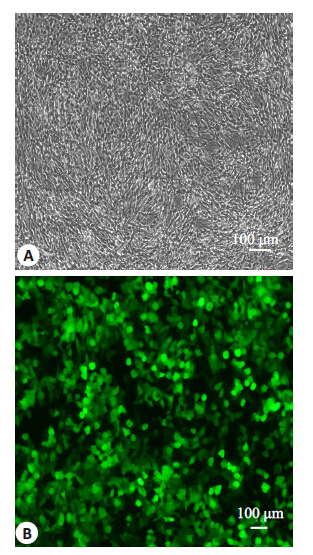
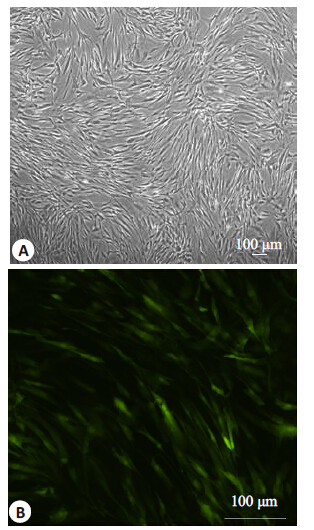
构建好的Plvx-WGA-IRES-ZsGreen1 载体是一种慢病毒表达载体,可以将插入的蛋白即WGA蛋白和ZsGreen1 在hADSCs 内进行共表达。ZsGreen1 是一种绿色荧光蛋白,可以作为标记蛋白。将vx- WGA-IRES-ZsGreen1 质粒、RPEV、PRRE、VSVG 质粒在293T细胞中进行共转染,转染72 h 后,荧光显微镜下发现293T细胞中含有大量带有绿色荧光蛋白的病毒颗粒(图 4),说明慢病毒包装成功。收取病毒液,感染宿主细胞hADSCs,在细胞质基质中发现大量绿色荧光蛋白(图 5),推测WGA蛋白在hADSCs 中得到成功表达。
|
图 4 共转染后的293T细胞 Figure 4 293T cells co-transfected with WGA recombinant plasmid and 3 other packaging plasmids (RPEV, PRRE, and VSVG). A: 293T cells before co-transfected by WGA recombinant plasmid and 3 other packaging plasmids (RPEV, PRRE, and VSVG). B: 293T cells co-transfected with WGA recombinant plasmid and 3 other packaging plasmids (RPEV, PRRE, and VSVG). |
|
图 5 感染后的hADSCs Figure 5 hADSCs infected by the recombinant lentivirus. A: hADSCs before infected by the recombinant lentivirus; B: hADSCs infected by the recombinant lentivirus. |
为了更加准确的显示hADSCs内WGA蛋白的表达情况,进一步利用免疫染色的方法进行检测。红色荧光代表被WGA抗体染色后的WGA蛋白表达情况(图 6A),蓝色荧光代表DAPI 染色后的细胞核(图6B),合并后发现Plvx-WGA-IRES-ZsGreen1 重组载体同时表达出绿色荧光蛋白ZsGreen1 和红色荧光蛋白WGA(图 6C),WGA蛋白成功在hADSCs 中得到大量表达。
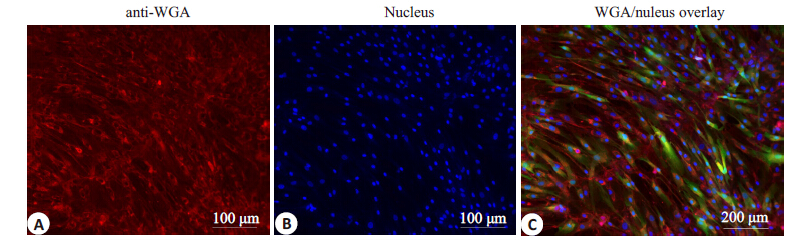
|
图 6 免疫荧光染色检测WGA蛋白 Figure 6 Detection of WGA in infected hADSCs by immunofluorescence staining. A: hADSCs stained with anti-WGA antibody; B: DAPI staining of the cells; C: Merged image. |
Plvx-WGA-IRES-ZsGreen1 感染的hADSCs 植入 MCAO小鼠模型后一个月,经心灌注后、取脑、固定,制备冰冻切片,再进行免疫组织化学染色来追踪hADSCs 在小鼠体内的存活和迁移情况。红色荧光代表被WGA 抗体染色后的WGA蛋白表达情况(图 7A),绿色荧光代表Plvx-WGA-IRES-ZsGreen1重组载体表达出绿色荧光蛋白ZsGreen1(图 7B),蓝色荧光代表DAPI染色后的细胞核(图 7C),图 7D为合并后结果。实验结果表明外源性hADSCs在小鼠体内有较强的迁移和生存能力。
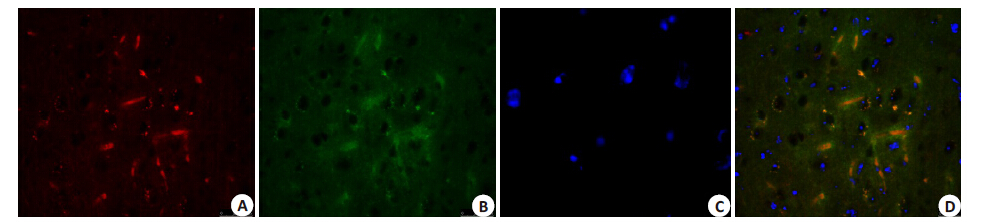
|
图 7 免疫染色追踪MCAO小鼠模型脑损伤区的hADSCs Figure 7 Tracing hADSCs in the infarct area in the brain of MCAO mouse model by immunofluorescence staining (Original magnification: × 400). A: hADSCs stained with anti-WGA antibody; B: hADSCs expressing green fluorescent protein ZsGreen1; C: hADSCs stained by DAPI; D: Merged image. |
慢病毒包装WGA蛋白的方法可以作为一种高效 的示踪技术广泛应用于各类细胞。特别是WGA对神经元细胞具有特异性,又能够跨突触传递,这使得运用慢病毒包装WGA来进行神经元示踪具有特别的优越性[11]。一方面可以进行原位注射病毒的办法追踪神经元的生长和迁移,另一方面WGA的神经元特异性和顺行逆行的特性可用于追踪和标记功能和结构相关的神经通路[12-13]。这都使得关于神经系统的研究更为准确、 快捷。此外,采用慢病毒包装WGA进行干细胞的体内分化示踪研究也具有一定优势。 本实验通过现代基因工程的方法将WGA蛋白的序列成功的插入到慢病毒载体pLVX-IRES-ZsGreen1 中,成功地构建了WGA的慢病毒表达载体。并将该表达载体和其他三种包装质粒(RPEV、PRRE、VSVG)通过与293T细胞进行共转染,包装成病毒颗粒。收取病毒液后,用其感染hADSCs,显微镜下检测感染成功后, 再用免疫荧光染色技术,染色观察WGA蛋白。结果显示,WGA蛋白在hADSCs中实现了高效表达。MCAO 小鼠模型脑冰冻切片免疫组织化学染色结果显示 Plvx-WGA-IRES-ZsGreen1 病毒感染的hADSCs 可在小鼠体内迁移和存活,这与前人报道一致[14-15]。
近年来,神经系统科学越来越关注于破译在正常和非正常状态的表型中的神经元网络潜在的行为。为了能够做到这些,在细胞和电生理水平上具有一些能够显示和操作这些网络的工具是很重要的。研究者们使用过的工具包括,可注射的示踪蛋白和示踪物的向量式表达到追踪神经连接关系的病毒的使用,用来显示突触和神经元之间的连接[16-19]。研究表明,WGA在脑部中的表达,是在接近轴突和树突的部位被双向运输的,通过胞吐作用出现在突触之间的缝隙中,接着下一个细胞通过受体介导的胞吞作用摄取它[5],本研究基于WGA的这种跨神经元运输功能,来示踪脂肪干细胞对于神经损伤的修复能力,故同时开展的工作为hADSCs移植术后每天用5级评分法对小鼠进行神经功能评分,细胞移植术后30 d行Morris test动物行为学评分,评估小鼠学习记忆能力的改变,通过TTC染色观察脑梗死面积大小的改变评估hADSCs移植治疗对动物神经功能的修复效果,通过神经元标记物MAP2、星形细胞标记物GFAP 的免疫染色结果评估hADSCs在小鼠体内的分化能力, 为临床有效治疗脑卒中疾病进行有益的探索。
| [1] |
Kristiansen A, Nysæter A, Grasdalen H, et al. Quantitative studies of the binding of wheat germ agglutinin (WGA) to chitinoligosaccharides and partially N-acetylated chitosans suggest inequivalence of binding sites[J].
Carbohydrate Polymers,1999, 38 (5) : 23-32.
( 0) 0)
|
| [2] |
Libbrecht S, Van Den Haute C, Malinouskaya L, et al. Evaluation of WGA-Cre-dependent topological transgene expression in the rodent brain[J].
Brain Struct Funct,2016, 141 (7) : 267-91.
( 0) 0)
|
| [3] |
Monsigny M, Mayer R, Roche AC. Sugar-lectin interactions: sugar clusters, lectin multivalency and avidity[J].
Carbohydr Lett,2000, 4 (1) : 35-52.
( 0) 0)
|
| [4] |
Yoshihara Y, Mizuno T, Nakahira M, et al. A genetic approach to visualization of multisynaptic neural pathways using plant lectin transgene[J].
Neuron,1999, 22 (1) : 33-41.
DOI: 10.1016/S0896-6273(00)80676-5. ( 0) 0)
|
| [5] |
Fabian RH, Coulter JD. Transneuronal transport of lectins[J].
Brain Res,1985, 344 (1) : 41-8.
DOI: 10.1016/0006-8993(85)91187-4. ( 0) 0)
|
| [6] |
Deshpande A, Bergami M, Ghanem A, et al. Retrograde monosynaptic tracing reveals the temporal evolution of inputs onto new neurons in the adult dentate gyrus and olfactory bulb[J].
Proc Natl Acad Sci USA,2013, 110 (12) : E1152-61.
DOI: 10.1073/pnas.1218991110. ( 0) 0)
|
| [7] |
Emde B, Heinen A, G?decke A, et al. Wheat germ agglutinin staining as a suitable method for detection and quantification of fibrosis in cardiac tissue after myocardial infarction[J].
Eur J Histochem,2014, 58 (4) : 2448.
( 0) 0)
|
| [8] |
Espinosa JF, Asensio JL, García JL, et al. NMR investigations of protein-carbohydrate interactions binding studies and refined three-dimensional solution structure of the complex between the B domain of wheat germ agglutinin and N, N', N"-triacetylchitotriose[J].
Eur J Biochem,2000, 267 (13) : 3965-78.
DOI: 10.1046/j.1432-1327.2000.01415.x. ( 0) 0)
|
| [9] |
Gradinaru V, Zhang F, Ramakrishnan C, et al. Molecular and cellular approaches for diversifying and extending optogenetics[J].
Cell,2010, 141 (1) : 154-65.
DOI: 10.1016/j.cell.2010.02.037. ( 0) 0)
|
| [10] |
Junyent F, Kremer EJ. CAV-2--why a canine virus is a neurobiologist's best friend[J].
Curr Opin Pharmacol,2015, 24 (3) : 86-93.
( 0) 0)
|
| [11] |
Kelsch W, Lin CW, Mosley CP, et al. A critical period for activity-dependent synaptic development during olfactory bulb adult neurogenesis[J].
J Neurosci,2009, 29 (38) : 11852-8.
DOI: 10.1523/JNEUROSCI.2406-09.2009. ( 0) 0)
|
| [12] |
Lanciego JL, Wouterlood FG. A half century of experimental neuroanatomical tracing[J].
J Chem Neuroanat,2011, 42 (3) : 157-83.
DOI: 10.1016/j.jchemneu.2011.07.001. ( 0) 0)
|
| [13] |
Whitman MC, Greer CA. Synaptic integration of adult-generated olfactory bulb granule cells: basal axodendritic centrifugal input precedes apical dendrodendritic local circuits[J].
J Neurosci,2007, 27 (37) : 9951-61.
DOI: 10.1523/JNEUROSCI.1633-07.2007. ( 0) 0)
|
| [14] |
Fei Zhou GS, Wang Lin EA. Human adipose-derived stem cells partially rescue the stroke syndromes by promoting spatial learning and memory in mouse middle cerebral artery occlusion model[J].
Stem Cell Res Ther,2015, 6 (1) : 92-8.
DOI: 10.1186/s13287-015-0078-1. ( 0) 0)
|
| [15] |
S Gao PZ, C Lin EA. Differentiation of human adipose-derived stem cells intoneuron-like cells which are compatible with photocurable three-dimensional scaffolds[J].
Tissue Eng Part A,2014, 20 (7/8) : 1271-84.
( 0) 0)
|
| [16] |
Borges LF, Sidman RL. Axonal transport of lectins in the peripheral nervous system[J].
J Neurosci,1982, 2 (5) : 647-53.
( 0) 0)
|
| [17] |
Kinoshita N, Mizuno T, Yoshihara Y. Adenovirus-mediated WGA gene delivery for transsynaptic labeling of mouse olfactory pathways[J].
Chem Senses,2002, 27 (3) : 215-23.
DOI: 10.1093/chemse/27.3.215. ( 0) 0)
|
| [18] |
Ruda M, Coulter JD. Axonal and transneuronal transport of wheat germ agglutinin demonstrated by immunocytochemistry[J].
Brain Res,1982, 249 (8) : 237-46.
( 0) 0)
|
| [19] |
Yoshihara Y. Visualizing selective neural pathways with WGA transgene: combination of neuroanatomy with gene technology[J].
Neurosci Res,2002, 44 (2) : 133-40.
DOI: 10.1016/S0168-0102(02)00130-X. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
