2. 深圳市坪山新区人民医院 皮肤科,深圳 518118
2. Department of Dermatology,People's Hospital of Pingshan, Shenzhen 518118, China
鬼臼毒素(POD)是从小檗科植物桃耳七、八角莲或六角莲的根及根茎中提取分离得到的木脂素类化合物, 具有抗肿瘤及抗病毒作用[1]。0.5%的POD 溶液和 0.15%的POD乳膏是推荐治疗尖锐湿疣的一线药物[2-3], 但局部用药后易出现红斑、水疱、溃烂及继发感染,且应用于黏膜部位后可能出现系统吸收,引起严重的全身毒副作用[4]。因此,WHO不推荐将POD酊剂、乳膏应用于黏膜部位[2, 5-6],为了改善传统剂型的不足,对POD新型制剂研制是重要的医学问题。纳米脂质载体(NLC)是第2代脂质纳米粒,是在固体脂质纳米粒(SLN)中引入液态脂质材料后所形成的纳米载体,多用于包裹脂溶性物质,在药物传递系统广泛应用[7-8]。NLC应用于经皮给药具有闭合作用、生理相容性好、提高药物稳定性、缓控释作用、皮肤靶向性等优点,因而可降低系统吸收及减少用药局部皮肤黏膜刺激。我们推测鬼臼毒素纳米脂质载体(POD-NLC)可以避免POD传统剂型具有局部刺激及系统吸收的缺点,用于黏膜部位。本研究利用前期成功制备的0.5% POD-NLC,选用西藏小型猪为研究动物模型,观察0.5% POD-NLC黏膜给药后局部黏 膜刺激性、药物分布和系统吸收规律。
1 材料和方法 1.1 实验动物12只健康西藏小型猪(SPF级,雌性,6月龄,平均体质量25 kg),南方医科大学实验动物中心提供。预实验结果显示:涂空白NLC的黏膜组织切片在本研究扫描参数条件下没有荧光性。开始实验后,按照随机对照原则分为实验组及对照组,各6只。
1.2 试药与仪器POD购于Sigma公司,含量98.8%;0.5%POD-NLC 及空白NLC制备及理化性质考察参考文献[9];0.5% POD酊剂由0.5g的POD溶于100 mL的75%乙醇制备得到;其他化学试剂均为分析纯。ECLIPSETE300型荧光倒置显微镜由日本NIKON公司制造,激光共聚焦显微成像仪由日本奥林巴斯公司制造,Malvern粒径分析仪由英国Malvern公司制造,LC-20A型高效液相色谱仪由日本岛津公司提供。
1.3 实验方法 1.3.1 0.5% POD-NLC实验动物血清检测高效液相色谱(HPLC)法进行测定,色谱柱:ODS-C18(4.6 mm× 250 mm,5 μm)不锈钢柱;流动相:甲醇-0.6%冰醋酸(52 ∶48),流速为1 mL/min,进样量20 μL,柱温为40 ℃,紫外检测波长为291 nm。标准曲线的绘制参考文献[10]。
1.3.2 涂药方法将实验组小型猪麻醉后,仰卧位固定于操作台,使用一次性无菌窥阴器打开阴道,选取宫颈1 周作为涂药区。使用0.5% POD-NLC,每只涂药量0.5mL。用小玻璃棒轻轻涂抹药物约20s,使药物在宫颈表面分布均匀。对照组用0.5% POD酊剂,用药方法同对照组。
1.3.3 局部涂药后黏膜刺激性观察和药物分布情况分别于取标本前4、8、12、16、20、24 h单剂量涂药,观察给药后宫颈黏膜外观变化;采用空气栓塞法处死实验小型猪,剪取3块不同涂药区域宫颈黏膜组织,使用福尔马林液固定,石蜡包埋处理。用常规石蜡切片技术连续切片,片厚3~4 mm,不染色,树脂封片后使用激光共聚焦显微成像仪观察,激发光谱为290 nm紫外光,以发射光波长400~604 nm的波段进行扫描,测定荧光强度。
1.3.4 黏膜给药后POD系统吸收情况分别在涂药1、2、4、6、8、10、12、24 h后通过实验小型猪前腔静脉采血 3~ 4 mL。血样4 ℃离心(10 000 r/min,15 min),取离心血清2 mL,加入等量乙酸乙酯。混合液经漩涡器振荡分为上下2层,下层为血清,上层为含有鬼臼毒素的乙酸乙酯。长针注射器吸净乙酸乙酯,余下血清按此法重复萃取2次,所得萃取液以40 ℃水浴挥发,乙酸乙酯挥发干净后所剩残渣按照“1.3.1”HPLC法测定鬼臼毒素血清含量。
1.3.5 统计学分析资料均采用均数±标准差表示,采用SPSS13.0统计软件进行统计分析。两组间比较使用t 检验。当P<0.05时认为差异有统计学意义。根据测定结果,采用3P97软件拟合模型,选择最适模型,计算鬼臼毒素血药浓度的曲线下面积(AUC)。
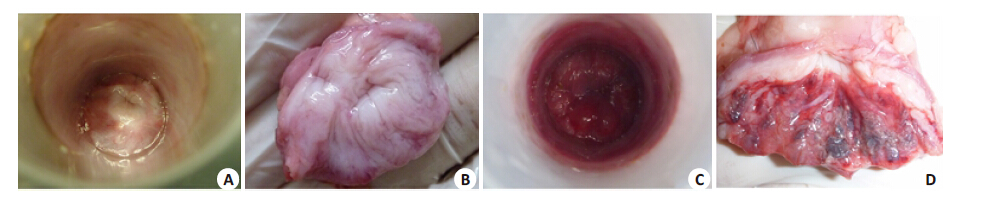
2 结果 2.1 局部给药后黏膜外观涂药后连续观察24 h,POD-NLC组宫颈黏膜外观正常,无红斑、丘疹、糜烂等改变;而对照组在涂药1 min 后即出现红肿,24 h后宫颈出现水疱、血疱、糜烂、破溃等改变(图 1)。
|
图 1 涂药1 min (A,C)、24 h (B,D)后宫颈黏膜外观图 Figure 1 Cervical mucosa at 1 min (A,C) and 24 h (B,D) after topical application of POD-NLC or POD tincture. A,B: POD-NLC group; C, D: Control group. A B C D |
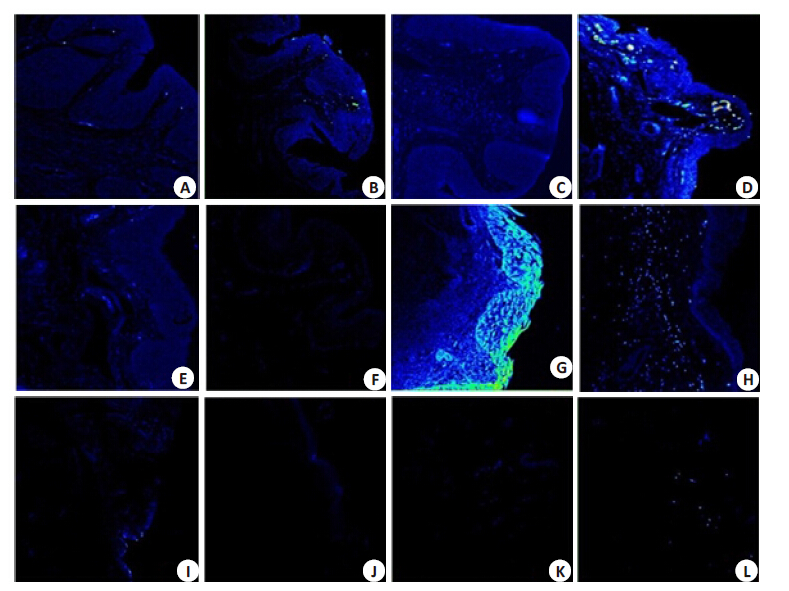
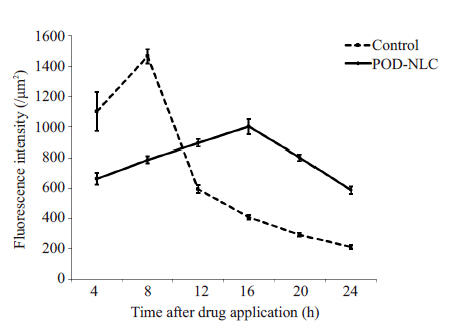
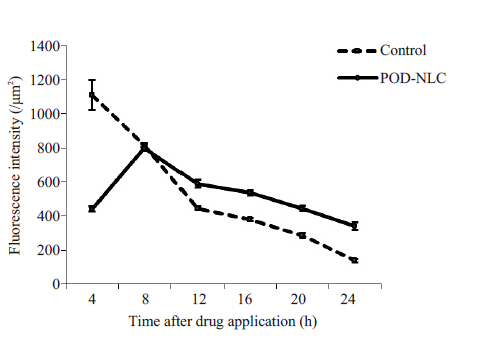
POD具有荧光活性,荧光强度代表组织内POD浓度,使用激光共聚焦显微成像仪观察POD在表皮和真皮的分布情况(图 2)。除真皮内涂药8 h后,其他各时间点真表皮内2组间荧光强度均有统计学差异(P<0.05, 图 3、4)。对照组在涂药8 h和4 h后表皮和真皮中的荧光值分别达到最高,其后即迅速降低;而实验组,POD荧光值上升慢,在8 h和16 h表皮和真皮分别达到最大值, 其后逐渐降低(图 3、4)。涂药后的12~24 h,表皮内实验组的POD荧光值持续高于对照组(P<0.05),涂药24 h 实验组表皮内的荧光值为(588.45±25.02/μm2),对照组为(213.62±14.06/μm2);实验组真皮中最大荧光值为 (799.25±19.55/μm2),对照组为(1109.37±88.30/μm2)。
|
图 2 两组小型猪给药后宫颈黏膜层POD荧光强度检测结果 Figure 2 Fluorescent images of cervical mucosa treated with POD-NLC or POD tincture (Original magnification:× 40). A-F: Test group at 4,8,12,16,20 and 24 h after drug application,respectively; G-L: Control group at 4,8, 12,16,20 and 24 h,respectively. |
|
图 3 两组小型猪给药后24 h表皮中POD荧光强度-时间曲线 Figure 3 Variations of fluorescent intensity of POD in the epidermis in 24 h after topical application of POD tincture or POD-NLC. |
|
图 4 两组小型猪给药后24 h真皮中POD荧光强度-时间曲线 Figure 4 Fluorescent intensity values of POD in dermis during 24 hours when POD tincture or POD-NLC was applied in two groups. |
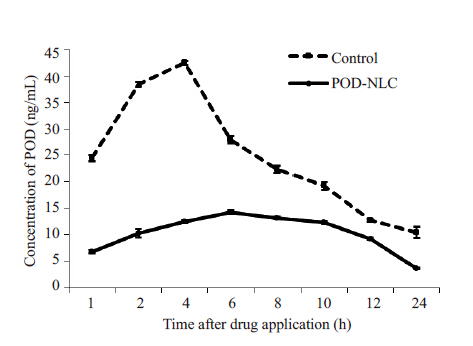
血样萃取处理后HPLC 法测定不同时间点POD 血药浓度。对照组POD的血药浓度快速在4 h 升至峰值(42.46±0.32 ng/mL),24 h 内血药浓度在(10.47±1.09ng/mL)至(42.46±0.32ng/mL)范围内;而实验组的血药浓度范围是(3.67±0.13 ng/mL)至(14.28±0.33 ng/mL), 且上升平缓,6 h 达峰值。在所有测试时间点,实验组的血药浓度均低于对照组,且差异有统计学意义(P< 0.05,图 5)。鬼臼毒素的AUC结果显示:对照组的AUC (355.45 ± 34.43 ng/mL ·h)是实验组AUC(258.13 ± 29.16 ng/mL·h)的1.38倍。
|
图 5 两组小型猪宫颈给药后24 h血药浓度-时间曲线 Figure 5 Changes of blood POD concentration over time within 24 h after topical application of POD tincture or POD-NLC. |
近年来迅速发展的纳米载药系统(NDC)为POD 外用的新剂型开发提供了思路。外用药物特别是经黏膜给药,靶向性和安全性尤为重要。女性尖锐湿疣好发于宫颈及阴道内壁[11],传统的POD外用制剂用于治疗女性尖锐湿疣,由于明显的局部刺激、药物分布和系统吸收等危险因素,而受到极大的限制。 宫颈黏膜表面几乎没有角质层覆盖,药物很容易渗透进入血液引起系统毒性,所以对外用药物安全性的考虑必须基于药物应用于生殖器黏膜可能被系统吸收量的基础上[12]。西藏小型猪皮肤和黏膜的组成及结构与人的最相似[13],所以选择西藏小型猪作为实验模型。因此,本研究观察和评价了POD-NLC在西藏小型猪宫颈黏膜给药后的局部刺激反应、药物分布和系统吸收等安全性指标,为探讨可用于治疗女性宫颈及阴道内壁尖锐湿疣的安全性外用制剂提供动物实验依据。
2000 年Maia 和Jenning等[14-15]提出了SLN具有皮肤和表皮靶向,可促进药物在皮肤层或表皮层的渗透吸收,降低药物的系统吸收。在SLN 基础上发展起来的NLC局部用药后同样可以在表皮内形成药物储库,使药物缓慢释放,直接而持久地对病变细胞起治疗作用,从而提高治疗效果[16]。本研究使用西藏小型猪作为动物模型,通过观察POD-NLC给药后宫颈黏膜外观变化,表明与NLC制剂相比酊剂作用温和, 对动物宫颈黏膜很少刺激性。通过激光共聚焦显微成像仪观察POD-NLC 给药后表皮和真皮内POD的荧光强度结果表明POD-NLC 具有表皮靶向性和缓释效应,与酊剂相比进入真皮层的POD 更少,因此 POD-NLC 具有更强的局部作用和更低的系统毒性。 同样曾抗等[17]观察脂质体鬼臼毒素混悬液在皮肤表皮和真皮中的分布规律,也证明脂质体制剂具有缓释效应,但其报道表皮和真皮中鬼臼毒素荧光值均在12 h 达峰值,与本研究在16 h 和8 h 分别在表皮和真皮达到最大值有差异,考虑与NLC本身的结构特性及宫颈黏膜特点有关。宫颈黏膜表面覆盖着一层由杯状细胞和黏膜下腺分泌的黏液,这种具有黏附性及黏弹性的液体,是给药系统发挥作用的天然屏障,可通过黏附作用快速清除异物颗粒和疏水性分子,保护机体不受外物侵扰,因此增加了药物在黏膜的滞留时间[18-19];同时,NLC作为黏膜局部给药时,可在黏膜表面形成一层黏附性膜,可防止药物被黏液清除,较脂质体药物在黏膜的滞留时间进一步延长。
本研究显示,POD-NLC应用于小型猪宫颈后测定的各个时间点血药浓度均低于酊剂组,且血药浓度上升缓慢,用药6 h后血药浓度达到峰值;而酊剂组的血药浓度上升迅速,4 h 后血药浓度即达到峰值。另外PODNLC 组AUC 也显著低于酊剂组,结果表明制备的 POD-NLC制剂确实能使POD在宫颈黏膜内缓慢释放, 提高药物在局部黏膜组织中的浓度,降低系统吸收而引起的全身毒副作用。Garazi等[20]对rhEGF-NLC治疗皮肤创面愈合的研究发现rhEGF在血浆中几乎检测不到, 系统吸收极少。
综上所述,本研究表明与传统的酊剂相比,PODNLC 具有缓释、黏膜组织局部蓄积、无刺激和系统吸收少的优点,NLC是POD局部皮肤、黏膜给药的良好载体。本研究为POD-NLC临床应用于治疗女性宫颈及阴道内壁尖锐湿疣提供了良好动物实验依据,但其外用后的实际临床效能尚有待进一步研究,希望在保证安全的情况下具有传统POD制剂的临床疗效。
| [1] |
姜飞, 田海妍, 张建龙, 等. 八角莲的化学成分研究[J].
中草药,2011, 42 (4) : 634-9.
( 0) 0)
|
| [2] |
Lacey CJ, Woodhall SC, Wikstrom A, et al. 2012 European guideline for the management of anogenital warts[J].
J Eur Acad Dermatol Venereol,2013, 27 (3) : e263-70.
DOI: 10.1111/jdv.2013.27.issue-3. ( 0) 0)
|
| [3] |
Workowski KA, Bolan GA. Sexually transmitted diseases treatment guidelines, 2015[J].
MMWR Recomm Rep,2015, 64 (Rr/03) : 1-137.
( 0) 0)
|
| [4] |
Handley J, Dinsmore W. Treatment of anogenital warts[J].
J Eur Acad Dermatol Venereal,1994 (3) : 251-65.
( 0) 0)
|
| [5] |
Hermanns-Lê T, Arrese JE, Goffin V, et al. Podophyllotoxin-induced acantholysis and cytolysis in a skin equivalent model[J].
Eur J Morphol,1998, 36 (3) : 183-7.
DOI: 10.1076/ejom.36.3.0183. ( 0) 0)
|
| [6] |
Lacey CJ, Goodall RL, Tennvall GR, et al. Randomised controlled trial and economic evaluation of podophyllotoxin solution, podophyllotoxin cream, and podophyllin in the treatment of genital warts[J].
Sex Transm Infect,2003, 79 (4) : 270-5.
DOI: 10.1136/sti.79.4.270. ( 0) 0)
|
| [7] |
Pardeike J, Hommoss A, Müller RH. Lipid nanoparticles (SLN, NLC) in cosmetic and pharmaceutical dermal products[J].
Int J Pharm,2009, 366 (1/2) : 170-84.
( 0) 0)
|
| [8] |
Müller RH, Shegokar R, Keck CM. 20 years of lipid nanoparticles (SLN and NLC): present state of development and industrial applications[J].
Curr Drug Discov Technol,2011, 8 (3) : 207-27.
DOI: 10.2174/157016311796799062. ( 0) 0)
|
| [9] |
韩凯, 王春慧, 种树彬, 等. 0.5%鬼臼毒素纳米脂质载体的制备及理化性质考察[J].
皮肤性病诊疗学杂志,2012, 19 (1) : 10.
( 0) 0)
|
| [10] |
王春慧, 韩凯, 种树彬, 等. 0.5%鬼臼毒素纳米脂质载体包封率的测定[J].
皮肤性病诊疗学杂志,2012, 19 (1) : 14-6.
( 0) 0)
|
| [11] |
郑商联, 周珏. 女性尖锐湿疣115例调查[J].
浙江预防医学,1999, 35 (2) : 19-20.
( 0) 0)
|
| [12] |
Heath A, Mellstrand T, Ahlmén J. Treatment of podophyllin poisoning with resin hemoperfusion[J].
Hum Toxicol,1982, 1 (4) : 373-8.
DOI: 10.1177/096032718200100402. ( 0) 0)
|
| [13] |
Maia CS, Mehnert W, Sch?fer-Korting M. Solid lipid nanoparticles as drug carriers for topical glucocorticoids[J].
Int J Pharm,2000, 196 (2) : 165-7.
DOI: 10.1016/S0378-5173(99)00413-5. ( 0) 0)
|
| [14] |
武志强, 管宇, 何宏华, 等. 小型猪皮肤组织结构及其初期收缩的研究[J].
实用美容整形外科杂志,1997, 8 (3) : 113-5.
( 0) 0)
|
| [15] |
Jenning V, Gysler A, Schafer-Korting M, et al. Vitamin a loaded solid lipid nanoparticles for topical use: occlusive properties and drug targeting to the upper skin[J].
Eur J Pharm Biopharm,2000, 49 (3) : 211-8.
DOI: 10.1016/S0939-6411(99)00075-2. ( 0) 0)
|
| [16] |
Müller RH, Radtke M, Wissing SA. Solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) in cosmetic and dermatological preparations[J].
Adv Drug Deliv Rev,2002, 54 (Suppl 1) : S131-55.
( 0) 0)
|
| [17] |
曾抗, 张三泉, 江彬彬, 等. 脂质体鬼臼毒素混悬液在大鼠表皮及真皮的分布规律初探[J].
中华皮肤科杂志,2003, 36 (6) : 329-31.
( 0) 0)
|
| [18] |
Boddupalli BM, Mohammed ZN, Nath RA, et al. Mucoadhesive drug delivery system: An overview[J].
J Adv Pharm Technol Res,2010, 1 (4) : 381-7.
DOI: 10.4103/0110-5558.76436. ( 0) 0)
|
| [19] |
林东海, 李刚, 孙秀燕. 药物微粒载体在黏膜给药中的黏液屏障与传递策略[J].
国际药学研究杂志,2010, 37 (6) : 435-8.
( 0) 0)
|
| [20] |
Gainza G, Bonafonte DC, Moreno B, et al. The topical administration of rhEGF-loaded nanostructured lipid carriers (rhEGF-NLC) improves healing in a porcine full-thickness excisional wound model[J].
J Control Release,2015, 197 (9) : 41-7.
( 0) 0)
|
 2016, Vol.
2016, Vol. 
