宫颈癌是女性生殖系统中最常见的恶性肿瘤[1]。 放射治疗是治疗宫颈癌的主要方法之一,但肿瘤放疗抵抗的产生严重影响了其疗效,进而发生放疗失败、肿瘤复发和转移等情况。寻找能在宫颈癌放疗前预测放疗敏感性的指标,对于制定个体化的治疗方案,合理进行综合治疗具有重要意义。目前研究发现,许多基因、细胞因子、mi-RNA 等,如14-3-3δ、LC3、P16、S100A9 和 MCL1等[2-4],通过影响细胞增殖、凋亡、细胞周期进程、 DNA修复、血管生成或自噬等过程参与了宫颈癌放疗抵抗的发生。但至今尚缺乏明确的基因作为宫颈癌细胞放疗敏感性的预测指标。
Spl是一个调控管家基因转录的普遍存在的转录因子,是细胞生物活动,包括分化、生长代谢、凋亡、衰老、 免疫反应、血管生成、DNA损伤和染色质重塑等过程中的重要蛋白[5]。近年来研究发现[6-7],Sp1蛋白在许多肿瘤中高表达,譬如乳腺癌、宫颈癌、胰腺癌、肺癌、结肠癌等,且与肿瘤分期、转移和不良预后密切相关。最新研究[8-9]指出,Sp1表达水平与肿瘤放疗的关系密切,下调 Sp1可以增加骨肉瘤及白血病的放疗敏感性,Sp1磷酸化的增多则促进骨肉瘤及白血病放疗的DNA损伤修复能力。然而,Sp1在宫颈癌放疗中的作用和分子机制目前尚未见报道。本研究通过检测不同的宫颈癌细胞株 Sp1 的基础表达水平,及通过构建稳定过表达与沉默 Sp1 的宫颈癌细胞株,根据其对电离辐射敏感性的分析,以期发现Sp1与宫颈癌放射抵抗或敏感形成的相关性,为阐明影响宫颈癌放射敏感的分子机制奠定基础。
1 材料和方法 1.1 材料 1.1.1 主要试剂兔抗人Spl单克隆抗体购自美国SantaCruz 公司,小鼠抗人GAPDH 单克隆抗体购自美国 Santa Cruz公司,辣根标记山羊抗兔IgG和辣根标记山羊抗小鼠IgG 购自北京中杉金桥生物技术有限公司; SDS.PAGE凝胶配制试剂盒、蛋白提取试剂盒、蛋白定量分析试剂盒购自上海碧云天生物技术研究所;TriZol 试剂、逆转录试剂盒和荧光定量PCR检测试剂盒购自 Takara。
1.1.2 细胞系6种人宫颈癌细胞(SiHa、HeLa、Caski、Me180、Ms751、C33a)购自中国科学院上海细胞库。
1.1.3 照射条件采用Varian2100C直线加速器6MV-X线照射,单次吸收剂量0~10 Gy,剂量率200 cGy/min, 源皮距100 cm,照射野10 cm×10 cm,并用有机玻璃组织补偿。
1.2 方法 1.2.1 Spl 稳定干扰及过表达细胞模型的构建靶向SP1基因的慢病毒shRNA载体及过表达载体由上海吉玛基因化学技术有限公司构建,shRNA序列为:949: 5'-CCAGCAACATGGGAATTAT-3'。宫颈癌细胞系 Me180及HeLa常规培养至对数生长期,按0.5×105接种于24 孔板中,以MOI(multiplicityofinfection)值为100 进行转染,详细步骤参见试剂盒说明书(转染细胞分为4 组:Me180/shSP1,Me180/scramble及HeLa/SP1,HeLa/ mock)。转染72 h后,荧光显微镜下检测绿色荧光报告蛋白分析转染效率,并加puromycin(终浓度2 μg/mL) 筛选稳定表达株,利用Western blotting检测Sp1的表达情况以确定干扰/过表达效果。
1.2.2 Western blotting检测肿瘤细胞Spl蛋白水平的表达蛋白提取、浓度检测严格按照试剂盒进行操作, 样品-80 ℃保存备用。将蛋白样品进行SDS-PAGE 凝胶电泳后,电转到聚偏二氟乙烯(PVDF)膜上,5% 的脱脂牛奶封闭2 h;一抗4 ℃孵育过夜,l×PBST漂洗5 min×5 次;二抗室温孵育2 h,1×PBST漂洗5 min×6次;曝光,显影。
1.2.3 RT-qPCR检测肿瘤细胞Spl RNA水平的表达收集各组宫颈癌细胞,采用Trizol 试剂盒提取总RNA, Takara逆转录试剂盒合成cDNA,然后进行qRT-PCR反应。反应条件:预变性95 ℃15 s,之后每一步预变性 95 ℃ 5 s,退火延伸60 ℃ 30 s,共40个循环。PCR引物自行设计并交由英潍捷基(上海)贸易有限公司合成 (SP1 上游引物:5'-GTGGAGGCAACATCATTGCT G-3',下游引物:5'-GCCACTGGTACATTGGTCACA T-3';GAPDH 上游引物:5'-CCATCAATGACCCCTT CATTGACC-3',下游引物:5'-GAAGGCCATGCCAGT GAGCTTCC-3')。
1.2.4 克隆形成实验取对数生长期的细胞,经胰酶消化制成单细胞悬液,按不同的辐射剂量将不同的细胞数接种于6孔板中,待细胞贴壁生长后给予单次吸收剂量分别为0、2、4、6、8和10 Gy的X射线照射。照射后 14 d,停止培养,弃去培养液,用1×PBS洗2遍,甲醇固定15 min后,结晶紫染色15 min,双蒸水轻轻洗去残余的染液,自然晾干。计数含>50个细胞的克隆数。克隆形成率(PE,%)=克隆数/接种细胞数×100%,对照组克隆形成率设为100%,各组细胞存活分数(SF)=各组克隆形成率/对照组克隆形成率。以3次照射的存活分数均值进行分析,运用GraphPad Prism 5.0软件进行L-Q模型和多靶单击模型曲线拟合,绘制剂量存活曲线,并计算L-Q 模型参数α、β、α/β、SF2(Survival Fractionat2Gy) 和多靶单击模型参数D0、Dq和N,其中logN=Dq/D0,计算放射增敏比SER(Sensitization Enhancement Ratio), SER=沉默前组SF2/沉默后组SF2。
1.2.5 统计学处理实验数据以均数±标准差表示,以SPSS20.0统计软件处理,组间差异采用t检验,P<0.05 为差异具有统计学意义。
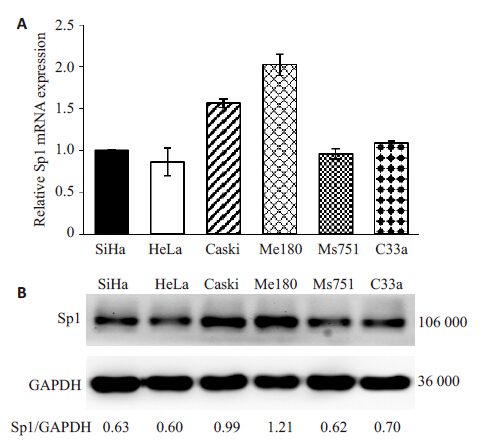
2 结果 2.1 Sp1在不同的宫颈癌细胞株中的基础表达情况选取宫颈癌不同的细胞株SiHa,HeLa,Caski, C33a,Me180,Ms751,利用RT-PCR 和Western Blot 检测其Sp1的mRNA及蛋白基础表达情况。Spl在6种细胞中的RNA表达水平不完全一致,从高到低分别为: Me180>Caski>C33a>SiHa>Ms751>HeLa(图 1A)。经 Western Blotting检测,6种宫颈癌细胞Spl的蛋白水平与mRNA表达水平一致,由Quantity one 软件分析得出,6种细胞(SiHa、HeLa、Caski、Me180、Ms751、C33a) 的相对表达值分别为(0.63,0.60,0.99,1.21,0.62,0.70), 其中Me180细胞的表达水平高于其他细胞,而HeLa细胞的表达量最低(图 1B)。
|
图 1 检测不同宫颈癌细胞系中Spl的表达水平 Figure 1 The expression of Sp1 in different cervical cancer cell lines. A: The results detected by RT-PCR; B: The results detected by western blot. |
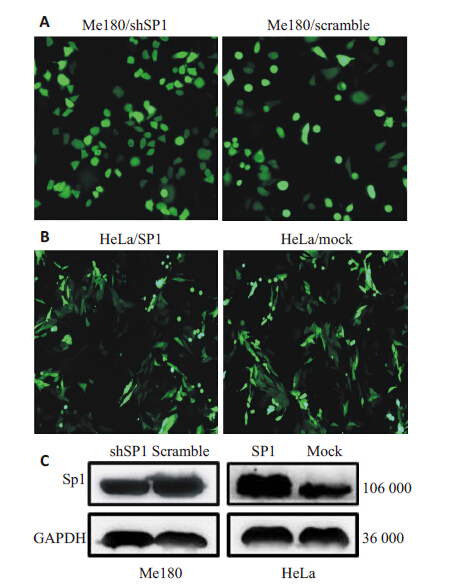
选择Sp1高表达细胞株Me180,分别转染沉默Sp1 基因表达的shSP1RNA慢病毒载体及其对照载体(图 2A)。Western Blotting验证shSP1稳定株构建效果,成功构建稳定沉默Sp1 表达的宫颈癌细胞株(Me180/ shSP1)及其对照组细胞(Me180/scramble,图 2C)。选择Sp1低表达细胞株HeLa,分别转染过表达Sp1基因的慢病毒载体及其对照载体(图 2B)。Western Blot验证 Sp1过表达稳定株构建效果,成功构建稳定过表达Sp1 的宫颈癌细胞株(HeLa/SP1)及其对照细胞(HeLa/ mock,图 2C)。
|
图 2 构建稳定过表达及沉默Sp1表达的宫颈癌细胞株 Figure 2 Lentivirus-mediated shRNA and over-expression vectors of sp1 successfully stably trnsfected into Me180 and HeLa respectively. A: Detection of GFP expression in lentivirus-mediated shRNA vector and control vector transfected Me180 cells by fluorescence microscope; B: Detection of GFP expression in lentivirus-mediated over-expression vectors and control vector transfected HeLa cells by fluorescence microscope; C: Detection of Sp1 expression inlentivirus-mediated shRNA vectortransfected Me180 cells and lentivirus-mediated over-expression vector transfected HeLa cells by Western blotting. |
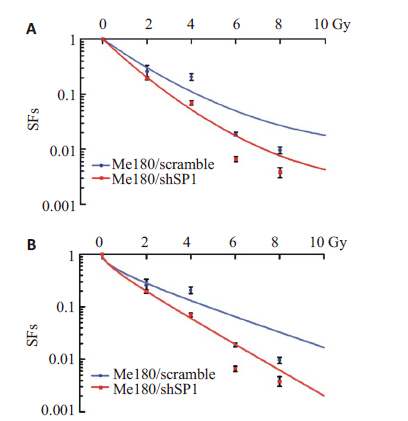
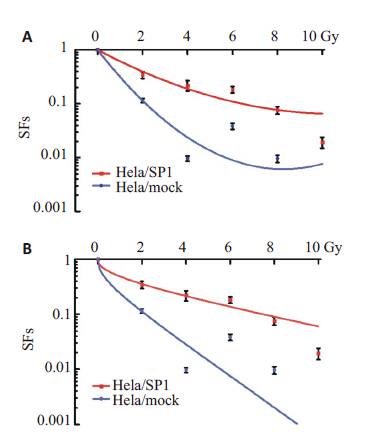
图 3克隆形成实验后,L-Q模型及多靶单击模型拟合细胞存活曲线结果显示,电离辐射作用后,Me180/ scramble和Me180/shSP1细胞的存活分数呈剂量依赖性0、2、4、6、8和10 Gy降低,但在相同剂量下,靶向抑制 Spl的表达可以使Me180细胞的存活分数更进一步降低(P<0.05);L-Q模型及多靶单击模型各放射生物学参数如表 1所示,Sp1沉默后放射增敏比SER=1.3189。经不同剂量X射线作用后,HeLa细胞的存活分数快速下降,而稳定过表达Sp1(HeLa/Sp1)细胞存活分数较同剂量高(P<0.05,图 4);L-Q模型及多靶单击模型各放射生物学参数如表 2 所示,Sp1 过表达后放射增敏比 SER=0.192。
|
图 3 Me180细胞中Sp1沉默前后细胞存活曲线 Figure 3 Cell survival curves in the Me180/shSP1 cells and Me180/scramblecells. A: LQ model; B: SHMT model. |
| 表 1 Me180细胞中Sp1沉默前后放射生物学参数比较 Table 1 Comparison of the radiation biological parameters between Me180/shSP1 cells and Me180/scramble cells (n=3, Mean±SD) |
|
图 4 HeLa细胞中Sp1过表达前后细胞存活曲线 Figure 4 Cell survival curves in the HeLa/SP1 cells and HeLa/mock cells. A: LQ model; B: SHMT model. |
| 表 2 HeLa细胞中Sp1过表达前后放射生物学参数比较 Table 2 Comparison of the radiation biological parameters between HeLa/SP1 cells and HeLa/mock cells (n=3, Mean±SD) |
放射治疗是宫颈癌的重要治疗方法之一。80% 的宫颈癌患者接受单独或辅助性放射治疗,其中 30%~50%的晚期宫颈癌患者因放疗抵抗而导致治疗失败[10]。随着分子生物学的发展,对宫颈癌辐射抗性的研究已进入分子水平,一些癌基因、转录因子、miRNA 的调控与其密切相关,但是由于放疗过程中大量基因和细胞分子的参与及反应,放疗抵抗或放疗敏感的机制在很大程度上仍然是未解之题。
转录调控因子Spl是一个具有序列特异性的DNA 结合蛋白,能启动许多靶基因的转录,参与细胞增殖、凋亡、分化和肿瘤形成等过程。有研究表明[11-12],Spl的异常表达与肿瘤的发生发展以及预后等密切相关。 Hoppe-Seyler等[13-15]发现Sp1是调控宫颈癌HPV 18 E6/ 7的重要转录因子,且Sp1表达的减少可以抑制宫颈癌的增殖能力,达到抑癌作用。且有研究表明[16-17],Spl可以分别通过调控靶基因p21、VEGF降低永生化的上皮细胞、头颈部鳞状细胞癌和肺癌细胞的放疗敏感。因此,Sp1可能是影响宫颈癌放疗敏感的一个重要因子。
本研究发现,Sp1与宫颈癌放疗敏感性密切相关。 我们通过检测发现6种宫颈癌细胞的Spl表达水平并不完全相同,其中Me180细胞的表达量最高,HeLa细胞表达量最低,这可能与细胞组织来源不同有关,提示Spl的表达具有细胞特异性。有研究表明[16],用重组慢病毒质粒沉默肿瘤细胞Sp1的表达后,可以通过促进DNA损伤修复下调肿瘤细胞的放疗敏感性。因此,我们利用慢病毒载体分别构建了Sp1高表达细胞株和沉默Sp1表达的稳定细胞株,并通过检测绿色荧光蛋白(GFP)和 Sp1的表达证实稳定株构建成功。进一步采用克隆形成实验和曲线拟合及相关生物放射学参数对宫颈癌细胞株沉默/过表达后的放疗敏感性进行分析,D0反映细胞在相对高剂量区对射线的敏感性,D0值愈大,细胞对放射愈抗拒;Dq反映亚致死性损伤修复能力的大小,Dq 值小则修复能力弱;α值决定低剂量照射下损伤的程度, α值越大,说明细胞对辐射越敏感,β值的贡献随照射剂量增大而增大,组织的α/β值高,对损伤修复能力弱[18]。 结果显示,宫颈癌Me180细胞存活分数呈剂量依赖性降低,但在相同剂量下,Me180/shSP1 的存活分数较 Me180/scramble 细胞显著下降,同时,与Me180/ scramble 相比,Me180/shSP1 的SF2、D0、Dq值亦相对降低,α/β值则相对增高,提示抑制Sp1的表达可以增强宫颈癌细胞的放射敏感性;相类似,宫颈癌细胞HeLa的存活分数也呈剂量依赖性降低,而相同剂量下,Hela/SP1 的存活分数较Hela/mock显著上升,同时,与Hela/mock 相比,Hela/SP1的SF2、D0、Dq显著升高,α/β值则显著降低,提示Sp1的过表达能够增加宫颈癌的放疗抵抗能力 (即削弱放疗敏感性)。这与前期研究[7-8]所报道的下调 Sp1能增加放疗敏感性的结果一致。我们证实,过表达 Sp1能够使宫颈癌细胞产生放疗抵抗,而沉默Sp1的表达能够增加宫颈癌细胞的放疗敏感。
据报道,Sp1可以通过多个途径影响肿瘤细胞的放疗敏感性。Olofsson等[19]发现Sp1促进DNA损伤部位发生SQ/TQ区域磷酸化从而减轻DNA损伤,降低肿瘤细胞凋亡。且多项研究[8, 20]表明辐射诱导的DNA双链断裂会增加SP1与DNA的结合能力,从而促进DNA损伤修复相关的蛋白及细胞周期蛋白的转录活性。此外, Sp1还可以与CDK4结合激活miR-141和miR-146b-5p 的转录活性[21]、促进凋亡抑制蛋白NFBD1的表达[22]、上调STK38 的表达[23]、促进凋亡抑制蛋白survivin 的表达[24-25]等。因此,我们认为Sp1是与肿瘤放疗抵抗有关的关键调控因子,其诱导肿瘤细胞的放疗抵抗可能与其增加肿瘤细胞DNA损伤修复及抑制肿瘤细胞凋亡等有关。那么,Sp1是通过什么机制来影响宫颈癌的放疗敏感性的呢?在后续研究中,我们将对Sp1调控宫颈癌放疗敏感性进行机制研究及体内实验,为肿瘤放疗生物标志物的研究提供科学依据。
| [1] |
Vaccarella S, Lortet-Tieulent J, Plummer M, et al. Worldwide trends in cervical cancer incidence: impact of screening against changes in disease risk factors[J].
Eur J Cancer,2013, 49 (15) : 3262-73.
DOI: 10.1016/j.ejca.2013.04.024. ( 0) 0)
|
| [2] |
胡乐林, 王俊杰. 食管癌放射敏感性标志物的研究进展[J].
癌症进展,2015 (6) : 593-6.
( 0) 0)
|
| [3] |
李玲. 宫颈癌放疗敏感相关因子的初步研究[J].
临床和实验医学杂志,2010 (4) : 253-4.
( 0) 0)
|
| [4] |
Zhao L, Lu X, Cao Y. MicroRNA and signal transduction pathways in tumor radiation response[J].
Cell Signal,2013, 25 (7) : 1625-34.
DOI: 10.1016/j.cellsig.2013.04.004. ( 0) 0)
|
| [5] |
Vizcaíno C, Mansilla S, Portugal J. Sp1 transcription factor: A long-standing target in cancerchemotherapy[J].
Pharmacol Ther,2015, 152 : 111-24.
DOI: 10.1016/j.pharmthera.2015.05.008. ( 0) 0)
|
| [6] |
ChoJH, Lee RH, Jeon Y, et al. Roleof transcription factor Sp1 in the 4-O-methylhonokiol-mediated apoptotic effect on oral squamous cancer cells and xenograft[J].
Int J Biochem Cell Biol,2015, 64 : 287-97.
DOI: 10.1016/j.biocel.2015.05.007. ( 0) 0)
|
| [7] |
Hedrick E, Cheng YT, Jin UH, et al. Specificity protein (Sp) transcription factors Sp1, Sp3 and Sp4 are non-oncogene addiction genes in cancer cells[J].
Oncotarget,2016, 7 (16) : 22245-56.
( 0) 0)
|
| [8] |
Iwahori S, Yasui Y, Kudoh A, et al. Identification of phosphorylation sites on transcription factorSp1 in response to DNA damage and its accumulation at damaged sites[J].
Cell Signal,2008, 20 (10) : 1795-803.
DOI: 10.1016/j.cellsig.2008.06.007. ( 0) 0)
|
| [9] |
Nishida Y, Mizutani N, Inoue M, et al. Phosphorylated Sp1 is the regulator of DNA-PKcs and DNA ligase IV transcription of daunorubicin-resistant leukemia cell lines[J].
Biochim Biophys Acta,2014, 1839 (4) : 265-74.
DOI: 10.1016/j.bbagrm.2014.02.004. ( 0) 0)
|
| [10] |
Dizon DS, Mackay HJ, Thomas GM, et al. State of the science in cervical cancer: where we are Today and where we need to go[J].
Cancer,2014, 120 (15) : 2282-8.
DOI: 10.1002/cncr.28722. ( 0) 0)
|
| [11] |
Safe S, Abdelrahim M. Sp transcription factor family and its role in cancer[J].
Eur J Cancer,2005, 41 (16) : 2438-48.
DOI: 10.1016/j.ejca.2005.08.006. ( 0) 0)
|
| [12] |
Zhang J, Zhu ZG, Ji J, et al. Transcription factor Sp1 expression in gastric cancer and its relationship to long-term prognosis[J].
World J Gastroenterol,2005, 11 (15) : 2213-7.
DOI: 10.3748/wjg.v11.i15.2213. ( 0) 0)
|
| [13] |
Hoppe-Seyler F, Butz K. Activation of human papillomavirus type 18 E6-E7 oncogene expression by transcription factor Sp1[J].
Nucleic Acids Res,1992, 20 (24) : 6701-6.
DOI: 10.1093/nar/20.24.6701. ( 0) 0)
|
| [14] |
Choi ES, Nam JS, Jung JY, et al. Modulation of specificity protein 1 by mithramycin A as a novel therapeutic strategy for cervical cancer[J].
Sci Rep,2014, 4 : 7162.
DOI: 10.1038/srep07162. ( 0) 0)
|
| [15] |
Wang F, Li Y, Zhou J, et al. miR-375 is down-regulated in squamous cervical cancer and inhibits cell migration and invasion via targeting transcription factor SP1[J].
Am J Pathol,2011, 179 (5) : 2580-8.
DOI: 10.1016/j.ajpath.2011.07.037. ( 0) 0)
|
| [16] |
Kweon MH, Afaq F, Bhat KM. Setaluri V and mukhtar H.A novel antioxidant 3-O-Caffeoyl-1-methylquinic acid enhances ultraviolet a-mediated apoptosis in immortalized HaCaT keratinocytes via Sp1-dependent transcriptional activation of p21(WAF1/Cip1)[J].
Oncogene,2007, 26 (24) : 3559-71.
DOI: 10.1038/sj.onc.1210135. ( 0) 0)
|
| [17] |
Pore N. Nelfinavir down-regulates Hypoxia-Inducible factor 1 and VEGF expression and increased tumor oxygenation: implications for radiotherapy[J].
Cancer Res,2006, 66 (18) : 9252-9.
DOI: 10.1158/0008-5472.CAN-06-1239. ( 0) 0)
|
| [18] |
沈瑜, 糜福顺.
肿瘤放射生物学[M]. 北京: 中国医药科技出版社, 2001 : 64 -8.
( 0) 0)
|
| [19] |
Olofsson BA, Kelly CM, Kim J, et al. Phosphorylation of Sp1 in response to DNA damage by ataxia telangiectasia-mutated kinase[J].
Mol Cancer Res,2007, 5 (12) : 1319-30.
DOI: 10.1158/1541-7786.MCR-07-0374. ( 0) 0)
|
| [20] |
Beishline K, Kelly CM, Olofsson BA, et al. Sp1 facilitates DNA Double-Strand break repair through a NontranscriptionalMechanism[J].
Mol Cell Biol,2012, 32 (18) : 3790-9.
DOI: 10.1128/MCB.00049-12. ( 0) 0)
|
| [21] |
Al-Khalaf HH, Mohideen P, NallarSC, et al. The cyclin-dependent kinase inhibitor p16INK4a physically interacts with transcription factor Sp1 and cyclin-dependent kinase 4 to Transactivate MicroRNA-141 and MicroRNA-146b-5p spontaneously and in response to ultraviolet light-induced DNA damage[J].
J Biol Chem,2013, 288 (49) : 35511-25.
DOI: 10.1074/jbc.M113.512640. ( 0) 0)
|
| [22] |
Bu YQ, Suenaga Y, Ono S, et al. Sp1-mediated transcriptional regulation of NFBD1/MDC1 plays a critical role in DNA damage response pathway[J].
Genes Cells,2008, 13 (1) : 53-66.
( 0) 0)
|
| [23] |
Enomoto A, Fukasawa T, Takamatsu N, et al. The HSP90 inhibitor 17-allylamino-17-demethoxygeldanamycin modulates radiosensitivity by downregulating serine/threoninekinase 38 via Sp1 inhibition[J].
Eur J Cancer,2013, 49 (16) : 3547-58.
DOI: 10.1016/j.ejca.2013.06.034. ( 0) 0)
|
| [24] |
Li Y, Xie M, Yang J, et al. The expression of antiapoptotic protein survivin is transcriptionally upregulated by DEC1 primarily through multiple sp1 binding sites in the proximal promoter[J].
Oncogene,2006, 25 (23) : 3296-306.
DOI: 10.1038/sj.onc.1209363. ( 0) 0)
|
| [25] |
Xu R, Zhang P, Huang J, et al. Sp1 and Sp3 regulate basal transcription of the surviving gene[J].
Biochem Biophys Res Commun,2007, 356 (1) : 286-92.
DOI: 10.1016/j.bbrc.2007.02.140. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
