2. 河北联合大学附属开滦总医院风湿免疫科,河北 唐山 063000 ;
3. 兰州大学第二医院风湿免疫科,甘肃 兰州 730030
2. Department of Rheumatology and Immunology, Kailuan General Hospital Affiliated to Hebei United University, Tangshan 063000, China ;
3. Department of Rheumatology and Immunology, Second Hospital of Lanzhou University, Lanzhou 730030, China
类风湿关节炎(RA)是一种慢性自身免疫性疾病,以关节滑膜炎症为主要病理特征。引起RA发生的早期事件仍未清楚,但抗瓜氨酸化蛋白抗体(ACPAs)的形成被认为是其关键的致病事件,因为RA相关的致病性自身抗体先于临床症状出现[1] 。近来有研究指出中性粒细胞胞外网状陷阱(NETs)是瓜氨酸化自身抗原的来源且其本身可能是自身抗体的靶点[2-3] 。RA患者中性粒细胞能通过一种新的死亡方式即NETosis 自发形成NETs[4] ,使瓜氨酸化的波形蛋白和ɑ-烯醇化酶外化,此外还能诱导成纤维滑膜细胞表达和分泌促炎症细胞因子如IL-8等,反过来又可进一步增强NETosis[5] ,扩大瓜氨酸化自身抗原暴露和促进易感个体自身抗体形成。体外形成的NETs能被脱氧核糖核酸酶Ⅰ(DNaseⅠ)和健康者血浆降解,而自身血浆则不能或不完全能降解[6-7] ,说明体内NETs降解受损可能与DNaseⅠ异常有关。DNaseⅠ活性受损与狼疮性肾炎相关也支持了该观点[8-9] 。NETosis在RA中是增强的,如果DNaseⅠ活性存在异常而不能有效降解NETs,势必会增加NETs的暴露,加重ACPAs 的异常形成,且进一步诱发炎症反应而使关节炎症恶化。本研究拟通过测定血清和关节液DNaseⅠ活性,分析其活性是否存在异常及与NETs 在RA 致病是否相关。并对关节液中NETs 标记物(cfDNA)进行测定,进一步分析DNaseⅠ与NETs的关系。DNaseⅠ活性异常可能是RA发病中的一个中心环节,因此对其机制的阐明能为RA治疗提供新的理论基础。
1 资料和方法 1.1 研究对象纳入我院住院RA患者83例,其中女性63例,男性20 例,年龄27~86 岁,平均59±13 岁,所有患者均符合1987年ACR修订的RA分类诊断标准。同期纳入年龄和性别匹配健康对照者60名。血清标本来自以上患者和健康者。关节液来自2014年7月~2015年11月我院住院和门诊患者,其中RA患者27例,女性23例,男性4例,年龄22~68 岁,平均53±11 岁;OA患者23 例,女性16例,男性7例,年龄42~80岁,平均57±11岁;AS患者9例,女性4例,男性5例,年龄17~46岁,平均27±10岁;GA患者6例,全为男性,年龄33~64岁,平均44±11岁。
1.2 标本采集和资料收集血清标本采集:清晨空腹抽取RA和健康者全血5 mL,3000 r/min离心10 min,分离血清并取0.5 mL分装后-30 ℃冻存,用于检测血清DNaseⅠ活性。关节液标本采集:膝关节穿刺术抽取RA和其他炎症性关节炎患者关节液,300 r/min 离心10 min 后取上清液放入Eppendorf管-80 ℃保存待测。收集RA患者标本采集时的临床资料,包括病程、ESR、CRP、DAS28评分、中性粒细胞计数、RF和抗CCP抗体。
1.3 DNaseI活性的测定采用辐射状酶扩散法测DNaseⅠ活性。该法基于对底物dsDNA的降解,配制含有dsDNA(Sigma)和核酸染料Sybr Green(Sigma)的琼脂糖(Biowest)凝胶,用血清/关节液扩散降解底物dsDNA后用凝胶成像系统测量扩散面积。具体步骤为:牛甲状腺dsDNA 用蒸馏水溶解为5 mg/mL的溶液,取1.86 mL的dsDNA溶液加入18.14 mL 的DNaseⅠ缓冲液(10 mmol/L Tris-HClpH7.5,10 mmol/L MgCl2,2 mmol/L CaCl2和50 mmol/LNaCl)中,并加入电泳级Sybr Green(1/1000)10 μL,混匀后加热至40~50 ℃。同时用DNaseⅠ缓冲液配制20 mL的2%的琼脂糖凝胶,待温度降至40~50 ℃时与配制好的dsDNA混合液混匀,将胶倒入96孔细胞培养板的板盖中,待胶凝固后在每孔中央用10 μL吸头加入2 μL 血清/关节液,用已知浓度的DNaseⅠ配制标准品,每孔加入从1.1 U/mL 倍比稀释到0.034 U/mL 的DNaseⅠ标准品各2 μL,胶用自封袋封口后避光37 ℃温箱孵育12 h。采用PCR凝胶成像系统拍照,IPP6.0软件定量分析。
1.4 关节液cfDNA的测定采用PicoGreen 试剂盒测定关节液cfDNA 含量。该法基于荧光核酸染料PicoGreen 可特异性结合dsDNA,结合后经488 nm荧光激发后可发出520 nm 荧光,荧光酶标仪可准确读数。用已知浓度的LambdaDNA作为标准品,根据标准品可推算出样品浓度。简要步骤为:经离心的关节液稀释40倍后取100 μL加入黑色96 孔微孔板,加入经200 倍稀释的PicoGreen 100 μL,室温孵育10 min后使用荧光酶标仪测定荧光值。
1.5 统计学处理采用Graphpad Prism5 软件制图,SPSS 19.0 软件进行分析,符合正态分布的计量资料用均数±标准差表示,组间比较应用独立样本t检验;不满足正态分布的计量资料用M(P25,P75)表示,组间比较应用Mann-Whitney U 检验;两变量之间的相关性应用Pearson 和Spearman相关分析。P<0.05认为差异有统计学意义。
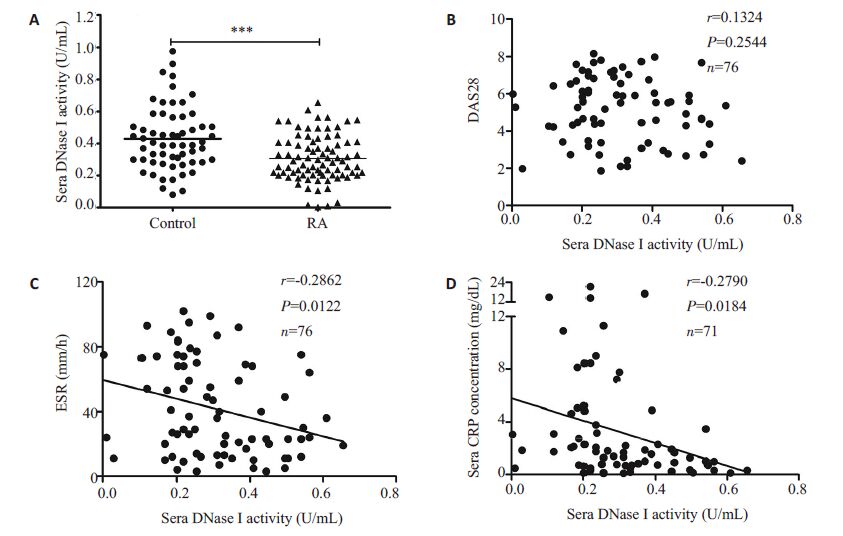
2 结果 2.1 RA血清DNaseⅠ活性降低与疾病活动度的关系RA 血清DNase Ⅰ活性显著低于健康对照组(0.3065±0.1436 U/mL vs 0.4289±0.1976 U/mL,P<0.001),差异有统计学意义(图 1A);进一步分析RA 血清DNase I 活性与临床指标的相关性发现其与ESR(r=-0.2862,P=0.0122,图 1C)、CRP(r=-0.2790,P=0.0184,图 1D)和中性粒细胞计数(r=-0.287,P=0.011)呈负相关,而与DAS28(r=-0.1324,P=0.2544,图 1B)、RF、抗CCP抗体无关(表 1)。
|
图 1 血清DNase I活性分布及其与疾病活动的关系 Figure 1 Distribution of serum DNase I activity and its relationship with disease activity. |
| 表 1 RA血清DNaseⅠ活性与临床指标的相关性 Table 1 Correlation between serum DNase I activity of RA and clinical parameters |
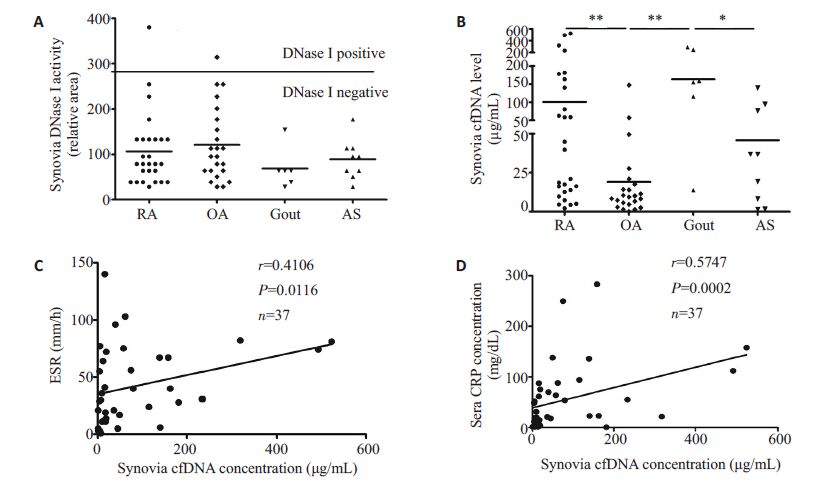
活性关节液中DNaseⅠ活性的测定同样采用辐射状酶扩散法,该法基于测定DNaseⅠ降解琼脂糖凝胶的面积来推算其活性。由于根据标准品计算出的DNaseⅠ活性在炎症性关节炎中只有2例阳性,其中1例为RA,1例为OA,故通过比较DNaseⅠ降解琼脂糖的面积大小来比较各组间是否有差异。如图 2A所示,DNaseⅠ活性在各组间无统计学差异。可见DNaseⅠ在这些炎症性关节炎关节液中几乎是无活性的。
|
图 2 关节液DNase I和cfDNA分布以及cfDNA和炎症指标间的相关性 Figure 2 Distribution of synovial fluid DNase I and cfDNA and the correlation between cfDNA and inflammatory markers. |
RA组关节液cfDNA水平显著高于OA组(100.81±142.98 μg/mL vs 18.98±31.40 μg/mL,P=0.002,图 2B),其水平与病程、ESR、CRP、DAS28、中性粒细胞计数、RF-IgG、RF-IgA、RF-IgM及抗CCP抗体无关(表 2)。RA组关节液cfDNA水平较AS组(45.85±47.67 μg/mL,P=0.428)高,较GA 组(162.95±97.49 μg/mL,P=0.132)低,但差异均无统计学意义。与OA组和AS组相比,GA组cfDNA 水平显著升高(162.95±97.49 μg/mL vs 18.98±31.40 μg/mL,P<0.001);(162.95±97.49 μg/mL vs 45.85 ± 47.67 μg/mL,P=0.008);而OA 和AS 组间cfDNA水平无差异。对所有炎症性关节炎患者关节液cfDNA水平与炎症指标间的相关性分析发现其水平与ESR(r=0.4106,P=0.0116)和CRP(r=0.5747,P=0.0002)呈显著正相关(图 2C,D)。
| 表 2 RA关节液cfDNA水平与临床指标的相关性 Table 2 Correlation between synovial fluid cfDNA level and clinical parameters in RA patients |
我们的研究发现血清DNaseⅠ活性在RA中是受损的,而关节液DNaseⅠ活性比血清低。血清DNaseⅠ活性与炎症指标ESR和CRP及中性粒细胞计数呈负相关。可见DNaseⅠ活性不足是NETs调控异常的一个重要因素,而关节液中异常增高的NETs标记物(cfDNA)提示关节炎症中大量形成的NETs不能被DNaseⅠ降解可能是重要的自身抗原来源。
虽然中性粒细胞在凋亡和其他炎症细胞在NETosis相关的过程中可能释放它们的染色质,但关节液cfDNA可能更多来源于NETosis。因为在早期RA患者关节液中中性粒细胞凋亡水平是显著减少的[10] ,且只有极少量嗜酸性细胞和肥大细胞存在于RA患者关节液中[11] 。我们的研究发现RA关节液cfDNA水平是升高的,而关节液DNaseⅠ活性是显著降低的,说明RA关节中NETs形成是增强的,DNaseⅠ活性降低使NETs过度形成和持续存在。推测NETs在RA中的致病作用是由于DNase Ⅰ活性降低或缺陷不能及时降解NETosis 过程中形成的染色体DNA网状物,使瓜氨酸化自身抗原暴露,机体对自身抗原丧失免疫耐受导致特异性自身抗体形成和炎症反应,该炎症坏境反过来又高度有利于NETosis的产生,造成一个恶性循环。
本研究显示RA关节液cfDNA水平与疾病活动度无相关性,这可能与疾病处于不同时期、药物干预等因素有关。但在炎症性关节炎关节液中均存在不同程度cfDNA 水平且与ESR 和CRP 呈显著正相关。说明NETs在这些疾病关节液中都有形成,而瓜氨酸化蛋白不仅存在于RA患者关节液中,在其他炎症性关节炎关节液中也存在[12] ,因此蛋白瓜氨酸化可能是一种炎症相关的表现。此外在痛风性关节炎患者中关节液cfDNA水平是显著升高的,其是所有炎症性关节炎中发病急、炎症程度最强的,在急性期单钠尿酸盐结晶沉积在关节液和滑膜,可使大量中性粒细胞聚集并活化导致NETs聚合物形成[13-14] 。
DNaseⅠ对中性粒细胞NETs形成具有负向调节作用,其是浓度依赖型的[15] ,此外NETs还能通过巨噬细胞的吞噬作用被清除,该调节机制是表型和时间依赖型的。M1型巨噬细胞在与NETosis相互作用下能增加其自身cfDNA的释放,但最后能被其完全降解[16] 。巨噬细胞功能紊乱是否参与RA的发病机制还未知,但RA关节液cfDNA水平与巨噬细胞数量无关而与中性粒细胞计数显著相关[17] ,说明关节液NETs增强可能主要以DNaseⅠ活性受损为主。表达DNaseⅠ的病原微生物能抑制后期中性粒细胞活性氧簇(reactive oxygenspecies,ROS)的产生,进而逃离NETs捕杀[18] 。RA中性粒细胞NETosis依赖ROS的产生,DNaseⅠ在RA中的作用在某方面上可能是通过抑制ROS 的产生减少NETs形成及促进已形成NETs降解。
总之,蛋白瓜氨酸化参与RA的发病,NETs是瓜氨酸化蛋白的来源之一,而DNase I 活性不足可能导致NETs来源的瓜氨酸化蛋白暴露,引起异常免疫应答和炎症的发生。也许外源性给予DNaseⅠ或抑制诱导NETosis的信号转导级联中的成分能为RA的治疗提供新的思路和靶点。
| [1] |
Holers VM. Autoimmunity to citrullinated proteins and the initiation of rheumatoid arthritis[J].
Curr Opin Immunol,2013, 25 (6) : 728-35.
DOI: 10.1016/j.coi.2013.09.018. ( 0) 0)
|
| [2] |
Khandpur R, Carmona-Rivera C, Vivekanandan-Giri A, et al. NETs are a source of citrullinated autoantigens and stimulate inflammatory responses in rheumatoid arthritis[J].
Sci Transl Med,2013, 5 (178) : 12.
( 0) 0)
|
| [3] |
Pratesi F, Dioni I, Tommasi C, et al. Antibodies from patients with rheumatoid arthritis target citrullinated histone 4 contained in neutrophils extracellular traps[J].
Ann Rheum Dis,2014, 73 (7) : 1414-22.
DOI: 10.1136/annrheumdis-2012-202765. ( 0) 0)
|
| [4] |
Sur Chowdhury C, Giaglis S, Walker UA, et al. Enhanced neutrophil extracellular trap Generation in rheumatoid arthritis: analysis of underlying signal transduction pathways and potential diagnostic utility[J].
Arthritis Res Ther,2014, 16 (3) : R122.
DOI: 10.1186/ar4579. ( 0) 0)
|
| [5] |
Gupta AK, Hasler P, Holzgreve W, et al. Induction of neutrophil extracellular DNA lattices by placental microparticles and IL-8 and their presence in preeclampsia[J].
Hum Immunol,2005, 66 (11) : 1146-54.
DOI: 10.1016/j.humimm.2005.11.003. ( 0) 0)
|
| [6] |
Jimenez-Alcazar M, Napirei M, Panda R, et al. Impaired DNase1- mediated degradation of neutrophil extracellular traps is associated with acute thrombotic microangiopathies[J].
J Thromb Haemost,2015, 13 (5) : 732-42.
DOI: 10.1111/jth.2015.13.issue-5. ( 0) 0)
|
| [7] |
Li J, Zhang Y, Zhou X, et al. Establishment and evaluation of an in vitro method for neutrophil extracellular trap Generation and degradation[J].
J Cell Molecular Immunol,2014, 30 (9) : 986-8.
( 0) 0)
|
| [8] |
Hakkim A, Fuernrohr BG, Amann K, et al. Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis[J].
Proc Natl Acad Sci USA,2010, 107 (21) : 9813-8.
DOI: 10.1073/pnas.0909927107. ( 0) 0)
|
| [9] |
Martinez-Valle F, Balada E, Ordi-Ros J, et al. DNase1 activity in systemic lupus erythematosus patients with and without nephropathy[J].
Rheumatol Int,2010, 30 (12) : 1601-4.
DOI: 10.1007/s00296-009-1199-6. ( 0) 0)
|
| [10] |
Raza K, Scheel-Toellner D, Lee CY, et al. Synovial fluid leukocyte apoptosis is inhibited in patients with very early rheumatoid arthritis[J].
Arthritis Res Ther,2006, 8 (4) : R120.
DOI: 10.1186/ar2009. ( 0) 0)
|
| [11] |
Freemont AJ, Denton J. Disease distribution of synovial fluid mast cells and cytophagocytic mononuclear cells in inflammatory arthritis[J].
Ann Rheum Dis,1985, 44 (5) : 312-5.
DOI: 10.1136/ard.44.5.312. ( 0) 0)
|
| [12] |
Kinloch A, Lundberg K, Wait R, et al. Synovial fluid is a site of citrullination of autoantigens in inflammatory arthritis[J].
Arthritis Rheum,2008, 58 (8) : 2287-95.
DOI: 10.1002/art.v58:8. ( 0) 0)
|
| [13] |
Mauer?der C, Kienh?fer D, Hahn J, et al. How neutrophil extracellular traps orchestrate the local immune response in gout[J].
J Mol Med,2015, 93 (7) : 727-34.
DOI: 10.1007/s00109-015-1295-x. ( 0) 0)
|
| [14] |
Schett G, Schauer C, Hoffmann M, et al. Why does the gout attack stop?A roadmap for the immune pathogenesis of gout[J].
RMD Open,2015 (Suppl 1) : e000046.
( 0) 0)
|
| [15] |
Meng W, Paunel-G?rgülü A, Flohé S, et al. Deoxyribonuclease is a potential counter regulator of aberrant neutrophil extracellular traps formation after major trauma[J].
Mediators Inflamm,2012 (1) : 149560.
( 0) 0)
|
| [16] |
Nakazawa D, Shida H, Kusunoki Y, et al. The responses of macrophages in interaction with neutrophils that undergo NETosis[J].
J Autoimmun,2016, 67 (9) : 19-28.
( 0) 0)
|
| [17] |
Spengler J, Lugonja B, Ytterberg AJ, et al. Release of active peptidyl arginine deiminases by neutrophils can explain production of extracellular citrullinated autoantigens in RA synovial fluid[J].
Arthritis Rheumatol,2015, 67 (12) : 3135-45.
DOI: 10.1002/art.v67.12. ( 0) 0)
|
| [18] |
Munafo DB, Johnson JL, Brzezinska AA, et al. DNase I inhibits a late phase of reactive Oxygen species production in neutrophils[J].
J Innate Immun,2009, 1 (6) : 527-42.
DOI: 10.1159/000235860. ( 0) 0)
|
 2006, Vol. 36
2006, Vol. 36
