溃疡性结肠炎(UC)是一种病因及发病机制尚不十分清楚的慢性非特异性肠道炎症性疾病,由基因、环境、感染、免疫因素共同作用所致[1-5]。UC在西方国家属常见病,年发病率为8~14/10万,患病率为120-200/10万;亚洲和中东国家年发病率约为6.3/10万,明显低于西方国家。近20年来,发病率也逐渐上升[6-8],并逐渐成为消化科的常见病。黏液脓血便作为UC最常见的症状[9],严重影响患者生活质量。UC缺乏诊断的金标准,主要根据临床表现、内镜和病理组织学,在排外感染性和其他非感染性结肠炎的基础上做出诊断[10]。UC临床治疗难度较大、花费高[11],其治疗原则为活动期诱导缓解治疗,以及缓解期维持缓解治疗[12]。
云南白药是祖国传统医药,具有止血、化瘀、抗炎、生肌、愈创等作用,长期临床经验发现云南白药在UC的治疗中具有明显疗效[13]。研究表明,云南白药具有抑制淋巴细胞生长和促炎因子表达作用,从而促进肠粘膜修复愈合[14]。目前云南白药对于UC的治疗尚缺乏随机对照研究的循证医学证据。本研究将针对具有黏液脓血便的UC患者在不改变其原有治疗方案的基础上使用云南白药辅助治疗,以期尽快改善患者症状,加强原治疗方案的疗效,从而达到辅助诱导缓解作用。
1 对象和方法 1.1 研究对象2013~2015年期间在南方医科大学南方医院消化内科住院、确诊为活动期UC的221例患者,所有患者均具有黏液脓血便这一临床表现。纳入标准为:(1)年龄≥18 岁,≤70 岁;(2)临床确诊的初发型或复发型活动期UC患者;(3)无严重合并症:心力衰竭、呼吸衰竭、肾衰等;(4)自愿加入本研究并签署知情同意书的患者。排除标准:(1)年龄<18岁,>70岁;(2)患有精神疾病,包括严重的癔症,不具备自主能力;(3)最近3个月参加过其他临床试验;(4)对云南白药过敏或不耐受者;(5)妊娠或哺乳期妇女,或准备妊娠妇女;(6)有严重合并症:心力衰竭、呼吸衰竭、肾衰等;(7)对本研究有顾虑者。
1.2 研究方法将入组患者按照病变范围、病情活动程度、治疗方案进行分组,病变范围采用蒙特利尔分型分为:E1 型(直肠型)、E2型(左半结肠型)、E3型(广泛结肠型);疾病活动程度按照改良Mayo评分标准进行评估:评分≤2分且无单个分项评分>1分为临床缓解;3~5分为轻度活动;6~10分为中度活动;11~12分为重度活动[9]。标准治疗有美沙拉嗪、激素、类克三种方案。各方案具体用药如下:美沙拉嗪方案(美沙拉嗪颗粒1 g 口服3/d);激素方案(泼尼松片1 mg/kg 晨起顿服);类克方案(英夫利西单抗5~10 mg/kg 静滴第0、2、6、14、22周);其中激素以及类克治疗的同时联合应用硫唑嘌呤(50 mg/kg口服1/d)。云南白药组在标准治疗方案的基础上辅助应用云南白药(0.5 g 口服3/d)至患者黏液脓血便症状缓解。治疗开始后每周电话或门诊随访,记录患者大便次数及性状,每4周门诊或住院复查,包括肠镜及血常规、血生化等指标,随访26周,根据改良Mayo评分判断是否达到缓解,记录患者达到诱导缓解的时间。
1.3 统计分析采用SPSS19.0统计软件对数据进行分析。T检验用于计量资料的统计分析。Kaplan-Meier方法对分类变量进行分析,log-rank比较各分类变量之间的差异是否具有统计学意义。利用Cox比例风险模型进行多因素分析,确定对诱导缓解时间的独立影响因素。对于所有检验均为双侧检验,P<0.05认为具有统计学差异。
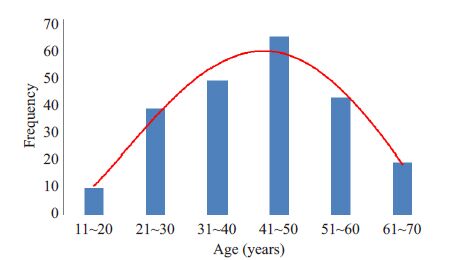
2 结果 2.1 一般人口学特征共有221例活动期UC患者纳入本次研究,年龄在18~70 周岁,其中男性130 例(58.8%),女性91 例(41.2%),男女比例为1.43∶1,本研究纳入的UC患者的年龄分布如图 1所示,呈明显的单峰分布,高峰年龄为41~50岁,中位年龄为43岁。221例患者中体型消瘦者(BMI<18.5)55 例(24.9%),正常体型(18.5≤BMI<24)125例(56.6%),偏胖体型(24≤BMI<28)37例(16.7%),肥胖体型(BMI≥28)4例(1.8%)。
|
图 1 221例UC患者年龄分布图 Figure 1 Distribution of age in 221 patients with UC. |
221例患者病变范围为E1型42例(19%),其中轻度活动期UC18 例(42.9%),中度活动期UC23 例(54.8%),重度活动期UC1 例(2.3%)。E2 型61 例(27.6%),其中轻度活动期UC9例(占14.8%),中度活动期UC46例(75.4%),重度活动期UC6例(9.8%)。E3型118例(53.4%),其中轻度活动期18例(15.3%),中度活动期76例(64.4%),重度活动期24例(20.3%)。所有患者均具有不同程度的黏液脓血便症状。
2.3 临床治疗及实验室检查221例初发型或复发型活动期UC患者中,采用美沙拉嗪诱导缓解治疗的有104例(47.1%),其中35例患者还采用了云南白药辅助诱导缓解治疗;使用激素诱导缓解治疗的有79例(35.7%),其中31例患者还使用了云南白药辅助治疗;使用类克(英夫利西单抗)诱导缓解治疗的有38例(17.2%),其中有12例患者使用云南白药辅助诱导缓解治疗。分析云南白药对于血清学指标的影响(表 1),发现诱导缓解治疗后云南白药组患者白细胞较对照组高,差异具有统计学意义(P=0.001),血红蛋白、血小板、CRP差异无统计学意义。
| 表 1 云南白药辅助诱导缓解治疗后血清学指标改变 Table 1 Effect of YNBY on serological indices before and after treatment |
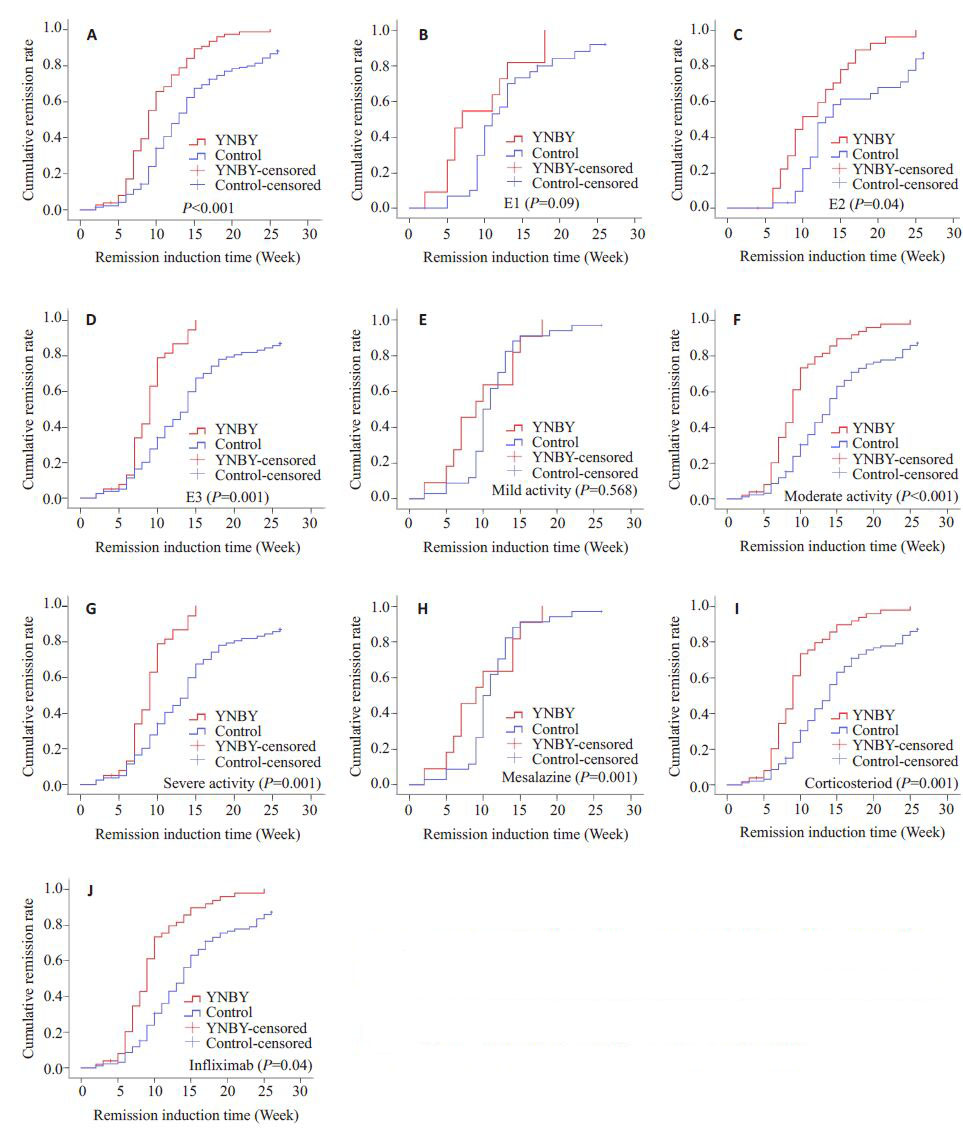
221例UC患者总体中位诱导缓解时间为11周,单变量分析年龄、性别、BMI、病变范围、活动度、治疗方案各变量对于诱导缓解时间的影响,且各变量在云南白药组与对照组中分布均衡。结果如表 2所示,性别、BMI、治疗方案与诱导缓解时间无关,云南白药组中病变范围、对照组中年龄及活动度各组诱导缓解时间差异具有统计学意义(P<0.05),推测年龄、病变范围、活动度可能与诱导缓解时间相关。使用云南白药辅助诱导缓解治疗的患者可以更快达到缓解,中位诱导缓解时间为9周,对照组中位诱导缓解时间为13周,差异具有统计学意义(P<0.001),云南白药组与对照组诱导缓解曲线如图 2A所示。云南白药对诱导缓解时间关系如表 3所示。对于不同病变范围云南白药组与对照组的中位诱导缓解时间为:E1型分别为7周和11周(P=0.09);E2型分别为10周和13周(P=0.04);E3型分别为9周和14周(P<0.001);诱导缓解曲线如图 2B~D所示。对于不同病情活动度云南白药组与对照组的中位诱导缓解时间为:轻度活动期分别为9周和10周(P=0.568);中度活动期分别为9周和14周(P<0.001);重度活动期分别为11 周和20 周(P=0.001);诱导缓解曲线如图 2E~G所示。对于不同治疗方案云南白药组与对照组的中位诱导缓解时间为:美沙拉嗪组分别为9 周和12 周(P<0.001);激素组分别为9周和13周(P=0.001);类克组分别为7 周和14 周(P=0.04);诱导缓解曲线如图 2H~J所示。
| 表 2 各变量与诱导疾病缓解时间的关系 Table 2 Relationship between clinical variables and remission induction time |
|
图 2 Kaplan-Meier法绘制的云南白药组(红线)与对照组(蓝线)的诱导缓解曲线图 Figure 2 Comparison of cumulative remission rate between YNBY group (red) and control group (blue) with Kaplan-Meier method. A: Overall cumulative remission rate between YNBY group and control group. Graphs described cumulative remission rate between YNBY group and control group for different lesion extent (B-D), different activity (E-G), and different treatment plans (H-J). |
| 表 3 云南白药与诱导疾病缓解时间的关系 Table 3 Relationship between YNBY and median remission induction time in the two groups |
进一步应用COX比例风险回归模型分析预测UC患者诱导缓解治疗的独立相关因素,将年龄、性别、BMI、病变范围、活动度、治疗方案、云南白药作为临床变量纳入多变量分析模型中进行分析,应用Wald检验各个临床变量有无统计学差异。结果如表 4所示,疾病的活动度、云南白药为活动期溃疡性结肠炎诱导缓解时间的相关因素(P值分别为0.006,<0.001)。最后通过逐步回归模型进行参数估计,结果可知,活动度为活动期UC患者诱导缓解治疗的风险因素,且活动程度越高,风险越大,诱导缓解治疗的时间越长(HR 0.695,95% CI0.547-0.884,P=0.003);云南白药是活动期UC患者诱导缓解治疗的保护因素,应用云南白药辅助治疗的患者诱导缓解时间较未使用者缩短2.283 倍(95%CI:1.697-3.070,P<0.001)。
| 表 4 多变量分析UC诱导缓解时间的相关因素 Table 4 Multivariate analysis of risk factors for UC remission induction time |
本研究发现,云南白药对于活动期UC患者诱导缓解治疗起着重要的辅助作用,能够早期缓解症状,更快达到诱导病情缓解的目的。
黏液脓血便为溃疡性结肠炎的最主要的临床表现,本研究针对UC患者这一临床表现,给予云南白药辅助治疗,使患者黏液血便症状尽早得到改善,从而早期达到病情缓解。云南白药是我国的传统中药,具有止血、化瘀、抗炎、生肌、愈创等作用。其临床应用广泛,对于口腔疾病、上消化道出血、围手术期、妇科疾病等均具有很好的疗效[15-19]。目前国内有不少关于云南白药用于治疗UC的临床研究,提示云南白药在UC治疗中具有一定的疗效[20-24]。有研究比较了云南白药联合锡类散(实验组,30例)治疗溃疡性结肠炎较庆大霉素、灭滴灵、柳氮磺胺吡啶(对照组,30例)的疗效,实验组与对照组临床疗效及肠镜疗效总有效率均为为96%与90%,疗效具有统计学差异[25]。另有研究采用云南白药灌肠(60例)对比庆大霉素灌肠(60例)在UC治疗中的疗效,根据临床表现及乙状结肠镜下黏膜改善作为观察标准,实验组与对照组的有效率分别为80%与56%,疗效差异具有统计学意义[26]。本研究共纳入221 例活动期UC患者,将临床症状、血清学检查、内镜下表现纳入最后的疗效评价,将患者按病变范围(E1型、E2型、E3型)、活动度(轻、中、重)、标准治疗方案(美沙拉嗪、激素、类克)各分为不同的小组,在每一个组别下分别将云南白药组与对照组进行比较分析。结果如表 3所示,云南白药组中位缓解时间明显小于对照组,差异具有统计学意义(P<0.05)。其中E1型、轻度活动期患者云南白药组与对照组诱导缓解时间差异无统计学意义(P值分别为0.09,0.568),可能是由于病变范围为E1型、轻度活动期UC患者病变局限、病情较轻,未能显示出云南白药的临床疗效;也可能是由于本次研究E1型、轻度活动期病例数较少,未能显现出统计学差异;具体还待进一步研究明确。最终的COX风险比例回归模型分析纳入了疾病的活动程度、云南白药作为影响UC诱导缓解时间的独立相关因素。疾病的活动程度越高,说明病情越严重,诱导缓解治疗时间越长。云南白药的应用可使活动期UC患者更快达到缓解可能与云南白药以下作用机制相关:(1)促进血小板释放,缩短凝血时间,达到止血的作用;(2)对金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、绿脓杆菌等具有抑制作用;(3)促进皮质激素分泌,抑制炎症过程中炎症介质(前列腺素E2 和组织胺)的释放;(4)促进机体碱性成纤维细胞生长因子和血管内皮生长因子的表达,从而促进成纤维细胞及血管内皮细胞生成,加速血管的生长及结缔组织增生,促进肠上皮细胞组织的增生分裂,达到促进溃疡愈合的作用[23, 27]。
本次研究证实了云南白药在UC的治疗中发挥着重要的辅助作用,对于UC的临床治疗有着一定的指导意义,为进一步明确云南白药在UC中的作用奠定了一定的基础。考虑本研究尚存在一些不足之处,还需更加严谨的多中心前瞻性临床研究加以证实。
| [1] |
Podolsky DK. Inflammatory bowel disease[J].
N Engl J Med,2002, 347 (347) : 417-29.
( 0) 0)
|
| [2] |
Chamaillard M, Philpott D, Girardin SE, et al. Gene-environment interaction modulated by allelic heterogeneity in inflammatory diseases[J].
Proc Natl Acad Sci USA,2003, 100 (6) : 3455-60.
DOI: 10.1073/pnas.0530276100. ( 0) 0)
|
| [3] |
Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease[J].
Nature,2007, 448 (7152) : 427-34.
DOI: 10.1038/nature06005. ( 0) 0)
|
| [4] |
Hayashi R, Tahara T, Yamaaki T, et al. -449 C>G polymorphism of NFKB1 gene, coding nuclear factor-kappa-B, is associated with the susceptibility to ulcerative colitis[J].
World J Gastroenterol,2012, 18 (47) : 6981-6.
DOI: 10.3748/wjg.v18.i47.6981. ( 0) 0)
|
| [5] |
Shanahan F. 99th dahlem conference on infection, inflammation and chronic inflammatory disorders: host-microbe interactions in the gut: target for drug therapy, opportunity for drug discovery[J].
Clin Exp Immunol,2010, 160 (1) : 92-7.
DOI: 10.1111/j.1365-2249.2010.04135.x. ( 0) 0)
|
| [6] |
Cosnes J, Gower-rousseau C, Seksik P, et al. Epidemiology and natural history of inflammatory bowel diseases[J].
Gastroenterology,2011, 140 (6) : 1785-94.
DOI: 10.1053/j.gastro.2011.01.055. ( 0) 0)
|
| [7] |
Molodecky NA, Soon IS, Rabi DM, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review[J].
Gastroenterology,2012, 142 (1) : 46-54.
DOI: 10.1053/j.gastro.2011.10.001. ( 0) 0)
|
| [8] |
Thia KT, Loftus EV, Sandborn WJ, et al. An update on the epidemiology of inflammatory bowel disease in Asia[J].
Am J Gastroenterol,2008, 103 (12) : 3167-82.
DOI: 10.1111/ajg.2008.103.issue-12. ( 0) 0)
|
| [9] |
中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].
胃肠病学,2012, 17 (12) : 763-81.
( 0) 0)
|
| [10] |
Wang Y, Ouyang Q, APDW 2004 Chinese IBD working group. Ulcerative colitis in China: retrospective analysis of 3100 hospitalized patients[J].
J Gastroenterol Hepatol,2007, 22 (9) : 1450-5.
DOI: 10.1111/jgh.2007.22.issue-9. ( 0) 0)
|
| [11] |
Blomqvist P, Feltelius N, L?fberg R, et al. A 10-year survey of inflammatory bowel diseases-drug therapy, costs and adverse reactions[J].
Aliment Pharmacol Ther,2001, 15 (4) : 475-81.
DOI: 10.1046/j.1365-2036.2001.00942.x. ( 0) 0)
|
| [12] |
Kornbluth A, Sachar DB. Erratum:ulcerative colitis practice guidelines in adults:American college of gastroenterology, practice parameters committee[J].
Am J Gastroenterol,2004, 99 (7) : 1371-85.
DOI: 10.1111/ajg.2004.99.issue-7. ( 0) 0)
|
| [13] |
Yang B, Xu ZQ, Zhang H, et al. The efficacy of Yunnan Baiyao on haemostasis and antiulcer: a systematic review and meta-analysis of randomized controlled trials[J].
Int J Clin Exp Med,2014, 7 (3) : 461-82.
( 0) 0)
|
| [14] |
Li R, Alex P, Ye M, et al. An old herbal medicine with a potentially new therapeutic application in inflammatory bowel disease[J].
Int J Clin Exp Med,2011, 4 (4) : 309-19.
( 0) 0)
|
| [15] |
李霞, 于佳玥, 张峰, 等. 云南白药在口腔科中的临床应用[J].
中国医药指南,2012, 10 (16) : 284-5.
( 0) 0)
|
| [16] |
金宝灿, 广跃乾, 刘厚鹏, 等. 云南白药联合泮托拉唑治疗急性上消化道出血[J].
中国实验方剂学杂志,2012, 18 (14) : 257-9.
( 0) 0)
|
| [17] |
唐正龙, 王兴, 伊彪. 口服云南白药对正颌外科术中出血量影响的随机双盲对照研究[J].
中华口腔医学杂志,2008, 43 (9) : 542-5.
( 0) 0)
|
| [18] |
王雨来, 杜国安, 刘邦强. 云南白药现代医学应用概述[J].
时珍国医国药,2006, 17 (12) : 2580-2.
( 0) 0)
|
| [19] |
聂全芳, 王月容, 李凡国. 云南白药预防宫颈leep术后创面出血180例临床分析[J].
医学临床研究,2007, 24 (11) : 1971-2.
( 0) 0)
|
| [20] |
刘宏晶, 苗德芳. 云南白药、八味锡类散及盐酸小檗碱片联合美沙拉秦灌肠液治疗慢性非特异性溃疡性结肠炎80例疗效观察[J].
河北中医,2014 (11) : 1667-8.
( 0) 0)
|
| [21] |
何飞龙, 金玉弟, 袁金仁, 等. 康复新液、云南白药联合柳氮磺吡啶保留灌肠治疗溃疡性结肠炎[J].
长春中医药大学学报,2014, 30 (1) : 114-6.
( 0) 0)
|
| [22] |
程燕红, 郭玉宏. 地塞米松+云南白药保留灌肠对溃疡性结肠炎治疗效果的观察[J].
医药前沿,2015 (10) : 186-7.
( 0) 0)
|
| [23] |
陶娜, 杨幼林. 云南白药治疗溃疡性结肠炎的临床应用及作用机制研究概述[J].
中国中医药科技,2011, 18 (6) : 544-5.
( 0) 0)
|
| [24] |
史代萌. 观察健脾止泻宁颗粒联合云南白药治疗溃疡性结肠炎的临床疗效[J].
中国卫生标准管理,2015 (25) : 150-1.
( 0) 0)
|
| [25] |
周乐平, 吴彤, 赵兴远, 等. 云南白药锡类散灌肠液治疗溃疡性结肠炎的临床观察[J].
浙江临床医学,2004, 6 (12) : 1066-7.
( 0) 0)
|
| [26] |
于生河. 云南白药保留灌肠治疗慢性溃疡性结肠炎的疗效观察[J].
临床合理用药杂志,2014, 7 (7) : 21-2.
( 0) 0)
|
| [27] |
余美琼. 云南白药的现代药理作用及其临床新用途[J].
中国民族民间医药,2009, 18 (9) : 64-5.
( 0) 0)
|
 2006, Vol. 36
2006, Vol. 36
