原发性胃肠道淋巴瘤(primary gastrointestinallymphoma,PGIL)占全部非霍奇金淋巴瘤(non-Hogdkin's lymphoma,NHL)的20%~40%,但过半数的PGIL发生于胃(50~60%),原发于小肠及大肠的NHL仅分别占14~38%与10~20%[1],临床上较罕见,其临床表现常无特异性,诊断较困难。常规检查方法如消化道造影、超声、内镜及腹部CT等虽对本病诊断具有一定的价值,但各自仍有不足之处[2-3]。18F-FDG PET/CT对于淋巴瘤的诊断、分期、疗效评价及监测复发方面的独特优势已得到肯定[4],但目前关于PIL 的18F-FDGPET/CT显像表现的研究仍较少,尤其是不同细胞类型PIL 的18F-FDG PET/CT的影像学征象是否存在差别,尚未见文献对其进行阐述。本文回顾性分析23例PIL患者的18F-FDG PET/CT资料,对其18F-FDG PET/CT显像表现进行探讨,以加深对该病诊断及鉴别诊断的认识。
1 资料和方法 1.1 研究对象收集2005 年01 月~2016 年01 月间所有到本中心行18F-FDG PET/CT检查并经病理组织学明确的肠淋巴瘤患者的临床及图像资料。研究对象的纳入根据PIL的诊断标准(Dawson's标准)[5]:(1)无浅表淋巴结肿大;(2)胸部影像学检查未见纵隔淋巴结肿大;(3)外周血白细胞总数及分类计数正常;(4)手术时除原发的肠道病灶和区域淋巴结外,无其他肉眼可见的侵犯;(5)无肝、脾累及。排除标准为:(1)病理诊断为淋巴瘤但未经免疫组织化学检查明确其具体细胞类型者;(2)在PET/CT检查前已进行与淋巴瘤相关的治疗患者;(3)不符合Dawson's 标准的肠淋巴瘤患者。经筛选后,最终纳入PIL患者23例。
1.2 仪器及显像剂15 例患者采用Discovery LS PET/CT(美国,GE公司),8例患者采用Biograph mCTx(德国,Siemens公司)扫描仪进行PET/CT检查。18F-FDG由PETtrace 回旋加速器(美国,GE公司)和18F-FDG化学合成模块(美国,GE公司)自动合成,放化纯>95%。
1.3 显像方法患者空腹6 h以上,平静状态下按质量通过三通管经静脉注射18F-FDG 270~410 MBq(5.55 MBq/kg),暗室内静卧约1 h,排尿后行PET/CT显像。显像包括CT平扫及PET发射扫描,扫描范围从大腿中段至颅顶,必要时加扫双下肢。Discovery LS 采集参数:CT 电压140 kV、电流160 mA、螺距0.75、球管单圈旋转时间0.8>s,层厚为5 mm;PET发射扫描采用二维采集,3 min/床位。Biograph mCTx采集参数:CT电压120 kV、电流为自动毫安、螺距0.55、球管单圈旋转时间为1.0 s,层厚为3 mm;PET发射扫描采用三维采集,2 min/床位。
1.4 图像重建PET 重建采用有序子集最大期望值迭代法(OSEM),图像衰减校正采用CT扫描数据。CT图像采用标准法重建,重建层厚为4.25 mm(Dishbcovery LS)和2.0 mm(Biograph mCTx)。将PET和CT图像传送到Xeleris和Syngo MMWP工作站,进行帧对帧图像对位融合。
1.5 图像观察及分析指标所有图像均通过融合软件进行帧对帧对比分析。阅片包括视觉分析及半定量分析,观察指标包括肠道病灶数量及部位、肠道病灶的PET与CT表现、伴随征象(病灶周围脂肪组织异常、区域淋巴结增大及腹腔积液)。
PET/CT诊断标准:(1)肠道病灶阳性标准:CT上见肠壁增厚,伴或不伴局部肠腔扩张,PET于相应部位见节段性放射性浓聚,浓聚程度应高于肝脏。延迟显像中,上述局部肠管形态异常应无明显变化,PET相应部位放射性分布、形态和位置亦均无明显改变,以排除肠道生理性摄取的干扰;(2)病灶周围脂肪组织:局部脂肪组织出现以下征象时认为异常:脂肪组织模糊、软组织结节影或条索影、脂肪组织结构僵硬;(3)区域淋巴结:肠管周围及腹膜后区淋巴结增大,短径>10 mm时诊断为淋巴结增大,伴有放射性浓聚程度高于肝脏者,考虑为阳性淋巴结。
本研究中的“回盲部”指的是以回盲瓣为中心,包括盲肠、阑尾、末端回肠及升结肠起始部各10 cm 的区域[6]。位于回盲部的病灶在分析及统计时不再看作回肠及升结肠的病灶。
所有观察指标均经两位经验丰富的PET/CT医师观察、判定,如意见不同,则讨论达成一致。
1.6 统计学处理采用SPSS 18.0软件,近似服从正态分布的计量数据以均数±标准差表示。对独立样本进行t检验,两样本率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果 2.1 一般临床资料23 例PIL 患者中,11 例为弥漫性大B细胞淋巴瘤(DLBCL),10例为肠病相关性T细胞淋巴瘤(EATL),2例为黏膜相关淋巴样组织淋巴瘤(MALToma)。本组病例男性患者15例,女性8例。23例患者的平均年龄为49.7 岁(17 岁~82 岁),其中DLBCL 组年龄明显大于EATL组(t=2.932,P=0.009)。本组所有患者病程中均有腹部疼痛不适症状(23/23),2例DLBCL患者腹部触诊可扪及包块,30.4%患者(7/23)有消化道出血症状,39.1%患者(9/23)出现明显的体质量下降,30.4%患者(7/23,均为EATL患者)出现发热症状,另有1例EATL患者出现消化道穿孔。
2.2 肠道病灶部位及数量23例患者中,单发病灶者12例(52.2%,图 1),多发病灶者11例(占47.8%,图 2)。共检出病灶42个,病灶位于回肠、回盲部及升结肠的共占57.0%(各占19.0%),其他部位占43.0%(表 1)。
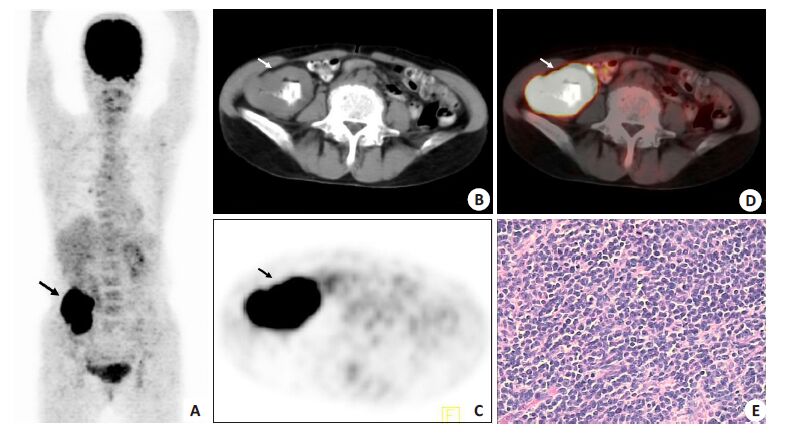
|
图 1 单发性升结肠DLBCL患者的图像 Figure 1 18F-FDG PET/CT images in a case of solitary ascending-colonic DLBCL. A: 18F-FDG PET/CT maximum intensity projection (MIP) showing a solitary FDG-avid lesion in the right lower quadrant (solid arrow); B-D: CT, PET and PET/CT images at the same level showing diffusive irregular wall thickening in the proximal ascending colon with a FDG-avid lesion (solid arrow); E: Histopathological examination of the lesion confirming the diagnosis of DLBCL (HE staining, original magnification: ×400). |
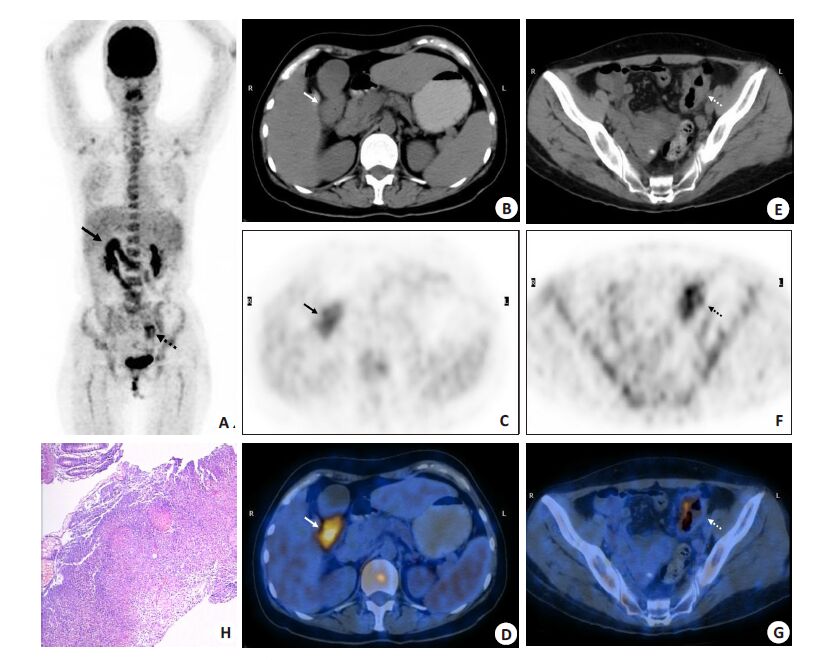
|
图 2 多发性结肠EATL患者的图像 Figure 2 18F-FDG PET/CT images in a case of multiple colonic EATL. A: 18F-FDG PET/CT MIP showing multiple FDG-avid nodular lesions in the right upper (solid arrow) and left lower quadrants (dotted arrow). CT (B, E), PET (C, F) and PET/CT (D, G) images showed intestinal wall thickening in the splenic flexure (B-D, solid arrow) and the proximal sigmoid (E-G, dotted arrow) with FDG-avid lesions; H: Histopathological examination showing neoplastic lymphocytes infiltrating the colonic submucosa with ulceration (HE staining, ×100). |
| 表 1 23例PIL患者病灶部位及数量 Table 1 Location and number of the lesions in 23 PIL patients (n) |
以病灶浓聚程度高于肝脏为PIL 阳性标准,18F-FDG PET/CT对PIL的阳性检出率为100.0%。全部患者所有肠道病灶放射性浓聚程度均较肝脏高,SUVmax为15.2±8.1(3.6~33.7)。2例MALToma患者共发现5个病灶,其放射性浓聚程度均相对较低;DLBCL 组共检出14个病灶,SUVmax为19.5±8.5(5.6~29.4);EATL组共23个病灶,SUVmax为14.8±6.8(6.3~33.7)。DLBCL和EATL两组间SUVmax无统计学差异(t=1.851,P=0.073)。
2.4 肠道病灶的同机CT表现DLBCL与EATL 两组共37个肠道病灶中,表现为病灶处肠壁弥漫性均匀增厚者为24个(占64.9%),病灶处肠壁弥漫性不均匀性增厚者为13个(占35.1%),两组在肠道病灶形态上的差异无统计学意义(χ2=0.426,P=0.514)。26.2%(11/42)存在病灶处肠腔瘤样扩张(图 3),DLBCL组其发生率高于EATL组(8/14∶3/23;χ2=8.101,P=0.004)。
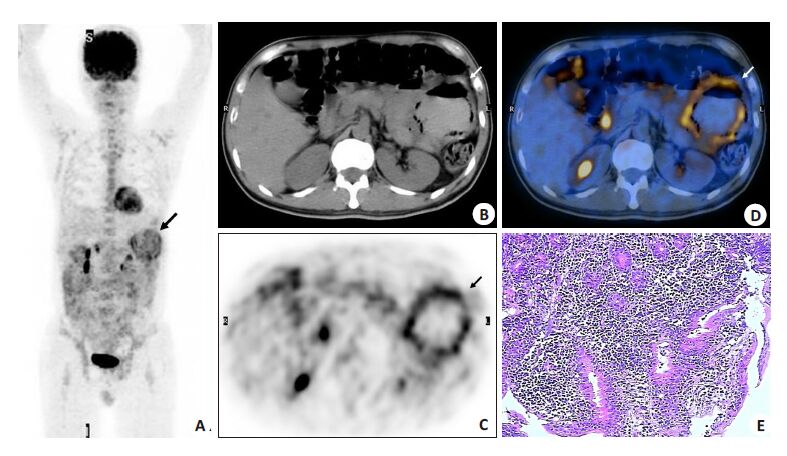
|
图 3 伴动脉瘤样扩张的空肠EATL患者的图像 Figure 3 18F-FDG PET/CT images in a case of jejunal EATL with the aneurismal sign. A: 18F-FDG PET/CT MIP showing a ring-like FDG-avid lesion in the left upper quadrant (solid arrow); B-D: CT, PET and PET/CT images at the same level showing diffusive wall thickening accompanied with the aneurismal sign in the jejunum with a FDG-avid lesion (solid arrow); E: Histopathological examination showing diffusive neoplastic lymphocytes infiltrating the jejunal crypts (HE staining, ×200). |
本研究中39.1%(9/23)患者在肠道病变的周围系膜间见异常改变,但代谢未见增高。39.1%(9/23)患者出现肠系膜内淋巴结侵犯,1例患者出现腹膜后区淋巴结侵犯,3例患者同时出现肠系膜及腹膜后区淋巴结侵犯(图 4)。共7 例(30.4%)患者(3 例为DLBCL、4 例为EATL)可见少量腹腔积液。
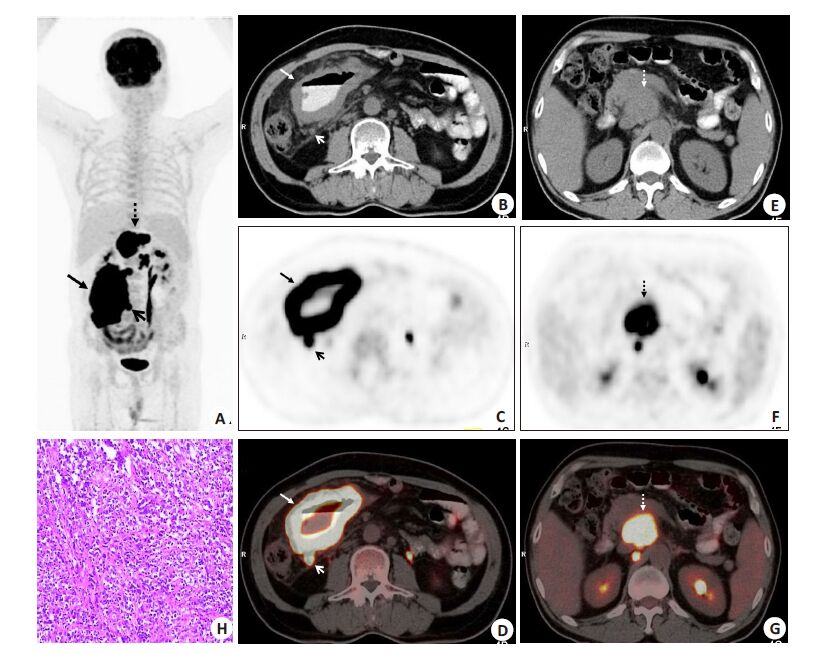
|
图 4 回肠DLBCL伴肠系膜及腹膜后区淋巴结增大的患者的图像 Figure 4 18F-FDG PET/CT images in case of ileal DLBCL with mesenteric and retroperitoneal lymph node involvement. A: 18F-FDG PET/CT MIP showing a FDG-avid mass in the right lower quadrant (solid arrow); B-D: CT, PET and PET/CT images showing the PIL lesion as diffusive ileac wall thickening with a FDG-avid mass (solid arrow); the mesenteric lymph node involvement (open arrow) also can be seen; E-G: Images of the upper abdomen displaying retroperitoneal lymph node enlargement with a FDG-avid mass (dotted arrow); H: Histopathological examination confirming the diagnosis of DLBCL (HE staining, ×200). |
PIL属于结外原发淋巴瘤的范畴,该病多见于50~70岁老年男性,30岁以下较少见。笔者统计国内文献报道[7-11]共168例,该病可在各个年龄层发病(10岁~89岁),平均发病年龄为53.9岁,本研究中患者平均年龄为49.7岁,与文献报道比较接近。PIL临床症状包括腹部症状(腹部不适、血便及腹部肿块等)及全身症状(发热、盗汗、疲乏及消瘦等)。另外,据文献报道,T细胞性PIL患者较B细胞性者更易出现消化道穿孔、腹泻及全身症状,而腹部包块则常见于B细胞性者[12]。本组所有患者病程中均有腹部疼痛不适症状,2例DLBCL患者腹部触诊可扪及包块,7例EATL患者伴有发热,均与文献报道较一致。
回盲部是PIL最常见的发病部位,可能是与该处淋巴滤泡组织比较丰富有关[1]。本组病例中,病灶数量最多的3个部位(回肠、回盲部及升结肠)中,回盲部没有显示出较另2处更易发病的特点,这与文献报道不尽相似,可能与病例数较少有关。另外,除EATL仅起源于胃肠道外,其他类型肠淋巴瘤也有可能是较早的肠外淋巴瘤其后累及肠道的表现[13],而18F-FDG PET/CT由于一站式显像的特点,故可灵敏且特异地排除肠外器官淋巴瘤病灶,使PIL与全身淋巴瘤局部累及肠道作鉴别诊断。
本组病例中,以肝脏放射性分布为参照,所有患者肠道病灶均见18F-FDG代谢增高,其中绝大部分患者肠道病灶代谢明显增高。但同时本研究亦显示,病灶的SUVmax不能作为鉴别淋巴瘤细胞类型的依据。另外,有2例MALToma 患者共5 个肠道病灶均呈轻度代谢增高,这可能与MALToma属于惰性淋巴瘤,肿瘤细胞增殖活性与葡萄糖代谢水平较低有关。病变节段肠管壁呈弥漫性增厚是肠淋巴瘤的影像学特点,其反映了淋巴瘤细胞在黏膜下浸润性生长的病理学特点(图 5)。一般认为,小肠淋巴瘤多表现为肠壁弥漫性均匀增厚,回盲部和结肠淋巴瘤则多表现为肠壁不均匀增厚[14]。在本组病例中,同机CT于上述高18F-FDG摄取的肠道病灶处均见弥漫性肠壁增厚改变,其中肠壁呈弥漫性均匀性及不均匀性增厚病灶分别为28个和14个,分析结果显示,肠道病灶的形态学改变不能作为不同细胞类型PIL的鉴别依据。
与肠道其他原发性恶性病变(如肠癌)不同,肠淋巴瘤不引起促结缔组织生长反应,故病灶局部肠腔不会产生收缩性的狭窄[15],相反,由于淋巴瘤细胞浸润性生长并破坏肠壁间神经节细胞,肠壁肌张力下降或丧失可使肠腔出现特征性的“动脉瘤样扩张”表现。一般认为,该征象对诊断肠淋巴瘤的特异性较高[16]。本组病例中共有11个肠道病变(8个为DLBCL,3个为EATL)节段肠管出现瘤样扩张表现,DLBCL组病灶局部肠腔扩张出现率明显高于EATL组。笔者认为,这种表现的差异可能与两种淋巴瘤的病理学特点有关:尽管2种淋巴瘤均沿肠壁固有层及肌层浸润,但EATL常以在肠壁局部形成“斑片状”或“结节状”溃疡性病灶为特点;DLBCL,大部分病例由MALToma转化而来,其肿瘤细胞则更倾向于对肠壁的“透壁性”浸润[13],由此而更容易侵犯肠壁间神经节细胞所致,但该征象的鉴别意义仍需进一步的研究加以阐明。
肠系膜及腹膜后区淋巴结增大是PIL肠外累及的征象,本研究中,大部分患者出现肠系膜内及/或腹膜后区淋巴结侵犯,其中又以肠系膜内淋巴结侵犯常见。PET于其中9例患者中见相应部位的淋巴结代谢异常增高,另有4例患者仅见淋巴结增大而代谢未见增高,可能为:(1)轻度增大的淋巴结仅为反应性增生而非淋巴瘤侵犯;(2)淋巴结虽有肿瘤细胞侵犯,但范围尚小或肿瘤细胞增殖程度较低,病灶FDG摄取程度不足以令其在PET显像上出现阳性表现。
肠淋巴瘤一般少有侵犯浆膜面,尤其体积较大的肠道肿瘤而肠周脂肪未见受累时,则更支持肠淋巴瘤的诊断[15]。胡中华等[17]研究认为,肠周脂肪密度消失提示肠淋巴瘤病变已侵犯浆膜层。另外欧阳林等[18]认为,肠周脂肪对肠道疾病反应敏感,多种良恶性病变均可出现类似的表现。Hadithi 等[19]在一组EATL患者的18F-FDGPET/CT 显像中发现1 例有明显肠系膜脂肪浸润性改变,但术后病理未见肿瘤浸润脂肪的证据。本组研究中有9个病灶出现肠周脂肪肿胀、模糊的表现,PET于相应部位未见明显代谢增高,这些征象可能是肿瘤累及或肠周脂肪反应性改变所致,提示该征象在PIL中并不少见,但上述9例患者经内镜取样或剖腹探查活检明确诊断后并没有进行手术治疗,故此征象未能在本研究中与病理学进行印证。
18F-FDG PET/CT在PIL诊断应用方面,PET假阳性及假阴性是应该引起相当重视的问题。前者原因包括肠道生理性摄取、炎性肉芽肿性疾病及其他代谢活跃的肿瘤等[20]。后者则可能因淋巴瘤病灶累及肠壁程度较轻或为惰性淋巴瘤本身葡萄糖代谢程度较低所致[21-22]。另外,腹泻患者肠道蠕动增加所致的肠壁代谢增高,可能掩盖PIL病灶[23]。肠道的延时显像对肠道病变与生理性摄取有鉴别诊断价值[24-25],本研究中所有患者肠道病灶均根据在延迟显像中无明显变化而诊断,并最终得到病理学印证;此外,延迟显像有助于肠道MALToma 病灶的显示[26],本研究中的2 例MALToma患者,尽管肠道病灶代谢相对较低,但在延迟显像中,病灶SUVmax仍较肝脏及肠道其他部位为高,结合CT上肠壁增厚的表现,仍可作出正确诊断,与文献报道相一致。
综上所述,原发性肠淋巴瘤病灶主要位于回肠、回盲部及升结肠,病灶18F-FDG代谢活跃,可表现为单发或多发病灶,多数沿肠管弥漫性浸润,部分伴肠腔瘤样扩张。18F-FDG PET/CT是检测原发性肠淋巴瘤的肠内外病灶并显示该病影像学征象的灵敏影像学技术,对该病的诊断有重要的价值。
| [1] |
Yaranal PJ, Harish SG, Purushotham B. Primary intestinal lymphoma: a clinicopathological study[J].
Indian J Cancer,2014, 51 (3) : 306-8.
DOI: 10.4103/0019-509X.146791. ( 0) 0)
|
| [2] |
于海生. 临床表现, 内镜及组织病理在克罗恩病, 肠结核和原发性结直肠淋巴瘤鉴别诊断中的价值[D]. 广州: 南方医科大学, 2011.
( 0) 0)
|
| [3] |
Peng JC, Zhong L, Ran ZH. Primary lymphomas in the gastrointestinal tract[J].
J Dig Dis,2015, 16 (4) : 169-76.
DOI: 10.1111/cdd.2015.16.issue-4. ( 0) 0)
|
| [4] |
Thanarajasingam G, Bennani-Baiti N, Thompson CA. PET-CT in staging, response evaluation, and surveillance of lymphoma[J].
Curr Treat Options Oncol,2016, 17 (5) : 24.
DOI: 10.1007/s11864-016-0399-z. ( 0) 0)
|
| [5] |
Dawson IM, Cornes JS, Morson BC. Primary malignant lymphoid tumours of the intestinal tract. Report of 37 cases with a study of factors influencing prognosis[J].
Br J Surg,1961, 49 : 80-9.
DOI: 10.1002/(ISSN)1365-2168. ( 0) 0)
|
| [6] |
Hoeffel C, Crema MD, Belkacem A, et al. Multi-detector row CT: spectrum of diseases involving the ileocecal area[J].
Radiographics,2006, 26 (5) : 1373-90.
DOI: 10.1148/rg.265045191. ( 0) 0)
|
| [7] |
潘阿善, 许崇永, 邱乾德. 原发性肠道非霍奇金淋巴瘤的CT诊断[J].
医学影像学杂志,2012, 22 (6) : 949-52.
( 0) 0)
|
| [8] |
张海峰. 原发性肠道淋巴瘤超声与CT的对比[J].
临床医学文献电子杂志,2016, 3 (5) : 931-2.
( 0) 0)
|
| [9] |
姚沛旭, 周实, 许建生, 等. 回盲部原发恶性非霍奇金淋巴瘤CT表现及鉴别诊断[J].
影像诊断与介入放射学,2009, 18 (2) : 77-9.
( 0) 0)
|
| [10] |
郑梅英, 王承党. 原发性肠道淋巴瘤的临床特点分析[J].
胃肠病学和肝病学杂志,2015, 24 (5) : 582-5.
( 0) 0)
|
| [11] |
张晓燕, 张波, 蔡胜, 等. 小肠淋巴瘤的超声及大体病理特征分析[J].
中国医学科学院学报,2013, 35 (3) : 318-21.
( 0) 0)
|
| [12] |
姚君良, 倪醒之. 原发性小肠淋巴瘤的临床病理特征及其诊疗进展[J].
实用医学杂志,2008, 24 (17) : 2921-3.
( 0) 0)
|
| [13] |
Foukas PG, De Leval L. Recent advances in intestinal lymphomas[J].
Histopathology,2015, 66 (1) : 112-36.
DOI: 10.1111/his.2015.66.issue-1. ( 0) 0)
|
| [14] |
管祥林, 刘林, 粱英萍, 等. 肠道恶性淋巴瘤CT和MRI诊断[J].
现代临床医学生物工程学杂志,2006, 12 (1) : 19-22.
( 0) 0)
|
| [15] |
Ghai S, Pattison J, Ghai S, et al. Primary gastrointestinal lymphoma: spectrum of imaging findings with pathologic correlation[J].
Radiographics,2007, 27 (5) : 1371-88.
DOI: 10.1148/rg.275065151. ( 0) 0)
|
| [16] |
Levine MS, Rubesin SE, Pantongrag-Brown L, et al. Non-Hodgkin's lymphoma of the gastrointestinal tract: radiographic findings[J].
AJR Am J Roentgenol,1997, 168 (1) : 165-72.
DOI: 10.2214/ajr.168.1.8976941. ( 0) 0)
|
| [17] |
胡中华, 张冰, 周科峰, 等. 小肠淋巴瘤的16排螺旋CT诊断[J].
中国临床医学影像杂志,2006, 17 (10) : 578-80.
( 0) 0)
|
| [18] |
欧阳林, 刘士远, 肖湘生. 肠周脂肪CT征象在诊断肠疾病中的临床价值[J].
中国医学影像技术,2009, 25 (3) : 462-4.
( 0) 0)
|
| [19] |
Hadithi M, Mallant M, Oudejans J, et al. 18F-FDG PET versus CT for the detection of enteropathy-associated T-cell lymphoma in refractory celiac disease[J].
J Nucl Med,2006, 47 (10) : 1622-7.
( 0) 0)
|
| [20] |
谢昌辉, 尹吉林, 李向东, 等. 小肠原发恶性肿瘤18F-FDG PET/CT显像及诊断方法[J].
核技术,2012, 35 (3) : 216-21.
( 0) 0)
|
| [21] |
D'souza MM, Jaimini A, Bansal A, et al. FDG-PET/CT in lymphoma[J].
Indian J Radiol Imaging,2013, 23 (4) : 354-65.
DOI: 10.4103/0971-3026.125626. ( 0) 0)
|
| [22] |
Sch?der H, Noy A, G?nen M, et al. Intensity of 18fluorodeoxyglucose uptake in positron emission tomography distinguishes between indolent and aggressive non-Hodgkin's lymphoma[J].
J Clin Oncol,2005, 23 (21) : 4643-51.
DOI: 10.1200/JCO.2005.12.072. ( 0) 0)
|
| [23] |
肖勇, 孟威, 孙倩. 18F-FDG PET/CT显像在空回肠淋巴瘤诊断中的价值[J].
国际医药卫生导报,2015, 21 (11) : 1567-9.
( 0) 0)
|
| [24] |
徐微娜, 于树鹏, 辛军. 18F-FDG PET-CT全身显像肠道高浓聚的临床意义分析[J].
现代肿瘤医学,2013, 21 (10) : 2337-9.
( 0) 0)
|
| [25] |
刘玉暖, 贾立镯, 韩静雅, 等. 18F-FDG PET-CT显像在肠道肿瘤诊断中的价值[J].
肿瘤影像学,2013, 22 (3) : 207-10.
( 0) 0)
|
| [26] |
Mayerhoefer ME, Giraudo C, Senn D, et al. Does Delayed-Time- Point imaging improve 18F-FDG-PET in patients with MALT lymphoma: observations in a series of 13 patients[J].
Clin Nucl Med,2016, 41 (2) : 101-5.
DOI: 10.1097/RLU.0000000000001005. ( 0) 0)
|
 2006, Vol. 36
2006, Vol. 36
