2. 兰州大学药学院,甘肃 兰州 730000
2. School of Pharmacy, Lanzhou University, Lanzhou 730000, China
低氧条件下,机体产生一系列生理、病理变化,这些变化可能会对药物转运体的合成、表达、活性及转运功能产生一定的影响,从而影响药物在体内的药代动力学、药物的治疗效果与药物副作用[1-2]。20世纪80年代以来高原低氧对药物体内代谢的影响引起广泛关注,其中很大一部分药物通过药物转运体介导的主动转运过程进入体内,药物转运体在缺氧条件下的变化将在很大程度上对药物在体内处置过程产生影响。ATP结合盒转运体是目前研究较多的一类超家族转运体,其底物非常广泛,对药物在体内的生理及药理意义十分重要[3]。其中MDR1、MRP2 作为ABC家族中最具代表性的转运体[4-5],同时也作为主要的外排型转运蛋白,在药物体内代谢过程中的作用受到广泛地认可,两者介导一些重要的内源性、外源性物质及多种治疗药物的代谢,如胆酸盐、多肽、蛋白质、抗癌药物甲氨喋呤、HIV蛋白酶抑制剂沙奎那韦、免疫抑制剂环孢素等[6]。但目前高原缺氧条件下MDR1、MRP2的如何变化以及如何影响药物代谢研究尚未有相关报道。
本实验通过模拟急进高原5000 m,旨在研究急进高原缺氧后大鼠体内生化、血气指标的变化以及大鼠小肠、肝脏、肾脏组织中MDR1、MRP2表达变化规律,期望能为今后高原低氧低压环境中药代动力学的研究提供一些参考依据,从而为高原地区临床合理用药提供一定的指导作用。
1 材料和方法 1.1 材料Wistar雄性大鼠(上海SLAC实验动物有限公司,合格证编号为2007000525382)。
主要试剂:BCA蛋白浓度测定试剂盒(北京索莱宝公司科技有限公司),Rat MDR1、MRP2 ELISA Kit(北京方程生物科技有限公司),TRIzol® Reagent(TakaRa,Japan),PrimeScriptTM RT Master Mix(TakaRa,Japan),SYBR® Premix Ex TaqTMⅡ(TakaRa,Japan),引物合成(TakaRa,Japan),其他试剂均为国产分析纯。
1.2 方法 1.2.1 动物分组与处理SPF级健康雄性Wistar大鼠18只,体质量200±20 g,随机分为正常对照组、缺氧24 h、缺氧72 h,每组6只。缺氧组置于DYC-3070型低压低氧动物实验舱模拟海拔5000 m(压力:397.5 mm Hg,氧分压:42 mm Hg),在完成预定缺氧时间后,每组大鼠按照“1.2.2”处理。
1.2.2 大鼠生化、血气指标检测及组织收集以腹腔注射10%水合氯醛溶液0.8 mL麻醉大鼠,解剖后取腹腔主静脉血2 mL置于肝素钠湿润过的离心管中,3000 r/min离心10 min后取上清液,采用全自动生化检测仪进行生化指标检测。使用含少量肝素钠湿润管壁的一次性1 mL注射器采集腹主动脉血1 mL,立即用全自动血气分析仪进行血气分析。同时快速摘取3组大鼠的小肠、肝脏、肾脏组织,用预冷的生理盐水冲洗组织后,于液氮罐中速冻,置于-80 ℃冻存备用。
1.2.3 Real-Time PCR 法测定MDR1、MRP2 mRNA 水平采用Trizol等试剂提取组织总RNA后,按逆转录试剂盒(PrimeScriptTM RT Master Mix)操作步骤在ABI9700型PCR仪进行RT 反应:37 ℃ 15 min,85 ℃ 15 s,℃。根据MDR1、MRP2及内参β-actin的基因全长序列分别设计引物(TakaRa,Japan)。MDR1引物:上游引物5'-CTGAAATCCAGCGGCAGA-3',下游引物5'-TGTATCGGAGTCGCTTGGTGAG-3',长度140 bp;MRP2 引物:上游引物5'-GAGCACCAGCAGCGATTTC-3',下游引物5'-AAGACGACCAAGTTTCCAACCA-3',长度133 bp;β-actin引物:上游引物5'-GAGATTACTGCCCTGGCTCCTA-3',下游引物5'-ACTCATCGTACTCCTGCTTGCTG-3',长度150 bp。按照说明,使用SYBR Premix Ex TaqTM Ⅱ试剂盒,以2 μL 的cDNA 为模板,在ViiATM 7 DX实时定量荧光PCR仪(Applied Biosystems)上进行PCR 扩增反应。反应条件为:95 ℃预变性30 s;95 ℃反应5 s,60 ℃退火31 s,运行40个循环,溶解曲线生成的反应程序为:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。采用2-△△CT法比较各样本中MDR1、MRP2转运体mRNA表达的差异。
1.2.4 酶联免疫分析(ELISA)检测MDR1、MRP2 的表达MDR1 和MRP2 的蛋白定量测定均采用ELISA方法 。小肠、肝脏、肾脏组织加入一定量PBS 缓冲溶液(含NaCl2 137 mmol/L,KCl2 2.7 mmol/L,Na2HPO410 mmol/L,KH2PO4 2 mmol/L,pH=7.4),用匀浆器将组织匀浆充分。匀浆液在3000×g 离心20 min,上清液即为蛋白样品,分装并贮藏于−80 ℃冰箱中备用。在酶标包被板上的标准孔中加入标准品稀释液50μL,待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL,混匀,37℃温育30 min。弃去液体,甩干,每孔加满稀释后的洗涤液,振荡30 s后弃去,重复5次,拍干。除空白孔外每孔加入酶标试剂50 μL,混匀,37 ℃温育30 min后弃去液体,加洗涤液洗涤5次,拍干。每孔先后加入显色剂A 和B 各50 μL,混匀,37 ℃避光显色10 min后加终止液50 μL,15 min内于450 nm 波长下测量各孔的A值。将样品的A值代入标准品绘制的“浓度−吸收度”标准曲线(MDR1:C=−1289.4×A2+956.07×A+3.1924,r=0.9993;MRP2:C=−148.81×A2+316.53×A+17.257,r=0.9953)计算出对应的样品浓度。
1.3 统计学处理采用SPSS 16.0统计软件进行统计学分析。结果以平均值±标准偏差的形式表示。组间比较采用单因素方差分析(One-Way ANOVA),两组之间比较采用t 检验,P<0.05为有显著性差异。
2 结果 2.1 生化指标分析正常对照组、模拟缺氧24 h 组大鼠生化指标测定结果见表 1。从表中结果比较可以看出,与正常对照组相比,急进高海拔缺氧24 h 组的碱性磷酸酶(ALP)、总蛋白(TP)、尿酸(UA)、白蛋白(ALB)、肌酐(CRE)均显著上升(*P<0.05,**P<0.01),而谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)相比于对照组,显著性下降(**P<0.01)。
| 表 1 生化指标分析 Table 1 Analysis of biochemical parameters of the rats in hypoxic exposure and control groups (n=6, Mean±SD) |
正常对照组、急进高海拔缺氧24 h组血气指标测定结果见表 2。由结果对比可知,血液酸碱度(pH)、动脉二氧化碳分压(pCO2)、血浆实际碳酸氢根浓度(HCO3-)、标准碳酸氢盐含量(SBC)、全血剩余碱(BEecf)、组织间液剩余碱(BEb)、动脉血样分压(pO2)、动脉血氧饱和度(SO2%)、血清钙离子浓度(cCa2+)明显降低(**P<0.01),而血清钾离子浓度(cK+)却显著性升高(**P<0.01)。
| 表 2 血气指标分析 Table 2 Blood gas analysis of the rats in hypoxic exposure and control groups (n=6, Mean±SD) |
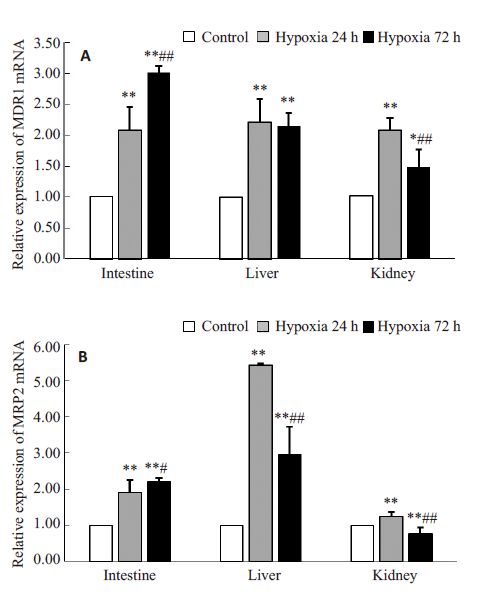
正常对照组、急进高海拔缺氧24 h组、急进高海拔缺氧72 h 大鼠MDR1、MRP2 mRNA表达水平测定结果见图 1。从结果可以看到,与正常对照组相比,急进高海拔缺氧组中两个外排型药物转运体MDR1、MRP2mRNA表达升高,随着缺氧时间的延长,不同转运体在不同器官组织中变化趋势不一样。在小肠组织,缺氧24 h组中MDR1表达是正常对照组的(2.08±0.38)倍,MRP2是正常对照组的(1.90±0.35)倍。同样的MDR1、MRP2 缺氧72 h 组表达水平与对照组相比,显著性上升,其中MDR1上升(3.01±0.10)倍,MRP2上升(2.20±0.11)倍。且随着缺氧时间的增加,MDR1、MRP2基因表达水平逐渐升高;在肝脏组织,急进高海拔缺氧的两个组与正常对照组比较,MDR1、MRP2的表达都升高。其中缺氧24 h组MDR1、MRP2表达水平相对于正常对照组分别升高了(2.23±0.36)、(5.44±0.03)倍,而缺氧时间到达72 h时后,MDR1的表达与缺氧24 h比无差异,MRP2 的表达却下降了一半;在肾脏组织,MDR1、MRP2的表达在缺氧24 h时达到最高:MDR1增加到了(2.04±0.20)倍,MRP2增加到了(1.24±0.11)倍,MDR1在缺氧72 h后相对于缺氧24 h组,下降了30%左右,但与正常对照组比还是增加了(1.46±0.28)倍,MRP2缺氧72 h后表达水平低于正常对照组。
|
图 1 缺氧后MDR1、MRP2在大鼠小肠、肝脏、肾脏的基因表达 Figure 1 Expressions of MDR1 (A) and MRP2 (B) mRNA in rat small intestine, liver and kidney in rats with hypoxia (n=6, Mean±SD). *P<0.05, **P<0.01 hypoxia vs control group; #P<0.05, ##P<0.01 hypoxia 72 h vs hypoxia 24 h group. |
正常对照组、急进高海拔缺氧24 h 组、急进高海拔缺氧72 h 大鼠MDR1、MRP2 蛋白表达水平测定结果见表 3。从结果可以看出,在小肠组织,MDR1、MRP2 的蛋白表达量随着缺氧时间的延长而呈现上升的趋势;在肝脏组织,与正常对照相比,缺氧24 h、缺氧72 h 组中MDR1、MRP2 都有所升高,不同的一点,MDR1 缺氧24 h 与缺氧72 h 的表达却无变化,而MRP2 却有所降低;在肾脏组织,缺氧24 h 后,MDR1、MRP2 的表达增加,但缺氧72 h 后,MDR1、MRP2蛋白水平下降。
| 表 3 小肠、肝脏和肾脏组织中MDR1、MRP2蛋白表达 Table 3 Protein expressions of MDR1 and MRP2 in the small intestine, liver and kidney in different groups (n=6, Mean±SD) |
急性和慢性暴露高原后,由于环境中氧含量的减少,动脉氧分压和血氧饱和度降低,造成组织氧供应减少,代谢和功能紊乱:(1)机体血液中的各种糖类、蛋白质及酶等多种代谢产物含量变化与机体酸碱失衡[1, 7]、药物与血浆蛋白结合率的变化[8]、肠道蠕动减慢、肠道血流改变等;(2)肝及肾的损伤、肺水肿、脑水肿[1, 7]、小肠黏膜破坏[9]等;(3)药物代谢酶CYP家族活性及表达的变化[10]。最新研究发现药物转运体是缺氧时药物代谢的另一个重要影响因素[11],药物转运体MDR1、MRP2 在多个正常组织和器官都有表达,尤其是影响药物体内动态的重要处置器官:肠道、肝、肾脏。机体急进高原缺氧后产生的一系列生理和病理的变化,可能会对相应组织器官上的药物转运体MDR1、MRP2的合成、表达及活性产生一定的影响,最终引起药物的药代动力学相关参数的变化[8, 12]。
本实验对大鼠在模拟急进高原后生理指标及药物转运体的变化情况进行了研究。生化结果分析可知,急进高海拔缺氧组相比于正常对照组,ALP、TP、ALB、CRE、LDH浓度升高,说明急性缺氧能使肝肾发生损伤、病变、细胞坏死或通透性增加。血气结果分析可知,与正常对照组相比,急进高海拔缺氧组pCO2、pO2、HCO3-、SBC降低,剩余碱为负值,表明在缺氧条件下,环境中氧分压降低,机体组织氧气供应失衡,大鼠出现代偿性呼吸性碱中毒并代谢性酸中毒的代谢障碍。由于药物经MDR1、MRP2转运属于原发性主动转运,转运过程中需要能量,而机体酸碱失衡与代谢障碍会影响体内ATP水解产能,进而影响药物转运体的转运活性。同时,cK+升高,cCa2+降低,其结果与Gao等[13]报道的结果相似,K+外流增加,Ca2+内流减少,将导致肝肾组织细胞障碍,细胞内酶活性改变,线粒体的呼吸功能受到抑制,同时K+、Ca2+又为蛋白质合成代谢所必需,因此这些变化会影响药物转运体MDR1、MRP2的生成、转运功能以及表达、活性,最终可能影响药物在体内的动态过程。高原缺氧环境中生理指标的的改变与MDR1、MRP2的表达变化之间的直接关系尚未见报道,还需要进一步深入探索。
目前关于高原缺氧对MDR1、MRP2的表达调节,无论是基因的转录水平还是翻译水平都鲜有报道。本实验通过模拟急进高原缺氧环境,观察大鼠小肠、肝脏、肾脏三个组织中药物转运体MDR1、MRP2 的表达变化,结果发现,缺氧不同时间,不同器官中MDR1、MRP2的表达具有一定的差异。MDR1主要分布在肠黏膜上皮细胞,肾近曲小管,肝细胞毛细胆管侧膜,胎盘及血脑屏障;MRP2主要在肝细胞顶膜域表达,其次是肠上皮细胞和肾近端小管上皮细胞。MDR1、MRP2的组织分布决定了其表达对缺氧的反应存在组织异质性。本研究也发现高原缺氧对小肠、肾脏中MDR1表达的影响幅度明显大于MRP2,而在肝脏中则相反。小肠黏膜具有绒毛微血管结构,±赖较高的血液供应,因此对缺氧比较敏感。研究发现高原环境下,无氧代谢增强,局部代谢产物堆积,肠黏膜通透性增加,肠黏膜毛细血管损伤,从而导致肠黏膜屏障功能破坏[9]。紧接着促使细菌内毒素移位,并引起全身炎症反应,导致体内炎症因子大量释放,从而影响药物转运体的表达。本实验发现高海拔缺氧后MDR1、MRP2的基因、蛋白水平都增加,随着缺氧时间的延长而升高,这与Katrina等、Min等研究一致[14-15]。两者的异常高表达提示机体可能产生了一定的保护性反应,通过增加有毒物质的转运与外排,促进小肠对缺氧耐受,以降低小肠的损伤程度。但小肠中的MDR1、MRP2 主要负责将药物运输至肠管腔,限制药物经肠道吸收进入机体,其表达的升高会影响高原人群药物的吸收与口服利用度。肝脏作为机体物质代谢中心,同时也是缺氧最敏感的器官。高海拔环境使肝脏处于相对缺氧状态,产生大量的活性氧类物质及氧自由基,导致肝细胞损伤,肝脏充血、肿胀,出现微循环障碍[16-17]。在肝损伤情况下,肝脏外排型转运体的表达和功能显著改变,主要表现在MDR1、MRP2 表达的升高[18-19],使得进入肝脏的胆汁酸及其他毒物减少,并且促进谷胱甘肽结合物、胆汁酸、结合型胆红素等毒物从肝脏排出从而缓解肝损伤,有利于肝细胞功能的恢复。本研究也显示,急进高原缺氧后,肝脏中MDR1、MRP2mRNA及蛋白水平随着缺氧时间均有升高的趋势,缺氧24 h后表达水平达到高峰,推测可能是急性缺氧条件下肝细胞在代偿范围内产生的适应性变化。但随着缺氧时间的延长,MDR1、MRP2的表达相对降低,可能是由于肝脏损伤加重,这种缺氧损伤主要表现在细胞膜高通透性,线粒体和内质网肿胀和扩张,进而导致MDR1、MRP2合成障碍。在肝脏,MDR1、MRP2可以将许多代谢产物及药物经肝细胞胆管侧膜转运至胆汁,与肝脏的摄取、代谢、解毒及排泄等功能密切相关,两者的表达变化可能是高原缺氧环境中机体生理疾病及底物药物体内过程改变的重要因素。肾脏是维持机体内环境稳定的重要器官之一,高原缺氧状态可导致氧化应激增加和机体的抗氧化功能下降,是引发肾损伤、急性肾衰竭等多种疾病的重要原因[20]。有研究表明,肾衰竭状态下,MDR1、MRP2的表达会发生改变[21-22]。本实验发现,急进高原缺氧后,肾脏中MDR1、MRP2 mRNA及蛋白水平出现升高的趋势,可能因为缺氧刺激下Nrf2活化上调抗氧化反应元件,从而激活下游靶基因MDR1、MRP2[23],促进体内蓄积的药物、氧化应激的产物和毒素的消除,以缓解这些物质对肾脏的毒性损伤作用,也就是说MDR1、MRP2在肾脏的过表达可能是肾脏对抗氧化应激产生的损伤保护机制。但缺氧72 h相比于缺氧24 h,MDR1、MRP2的表达减少,这与在肝脏中的变化相似,因此我们推测可能也是是因为肾小管上皮细胞线粒体变性,肾小球毛细血管通透性增加,肾脏损伤加重,影响MDR1、MRP2合成及功能障碍。在肾脏,MDR1、MRP2介导药物膜转运并完成肾小管分泌及重吸收的过程,两者的表达升高,表明急进高原后,MDR1、MRP2介导的药物排泄增强,肾小管重吸收减弱但肾小球滤过和分泌增加,从而加快药物的代谢与排泄。这暗示着急进高原缺氧后MDR1、MRP2的表达变化可能会影响在药物体内处置过程及效应,临床用药需要谨慎。
缺氧如何引起MDR1、MRP2的表达变化,目前尚未完全阐明,许多复杂的信号转导途径尚不清楚,目前主要从细胞因子与核受体方面开展研究[24-25]。处于缺氧状态的组织或细胞上的氧感受器感受环境低氧信号,引起氧自由基生成过多,应激可释放炎症介质及相关核转录因子、核受体等被激活[26-27],刺激受调控的MDR1、MRP2的转录,致使表达方式的重新调整,从而对缺氧作出复杂的应激反应,最终影响机体各系统功能及药代动力学的改变。
综上所述,本研究通过模拟急进高原缺氧环境,观察大鼠生理变化和小肠、肝脏、肾脏两个外排型转运体MDR1、MRP2的mRNA及蛋白表达规律。急进高原缺氧环境,大鼠生化指标、血气指标以及大鼠小肠、肝脏、肾脏中药物转运体MDR1、MRP2基因及蛋白表达水平会发生改变,这些变化在高原药代动力学方面起着重要的作用,课题组相关高原实地实验正在进行。本研究将为药物在高原的合理应用,提高高原药物使用时的安全性和有效性,减少药物不良反应奠定理论基础。
| [1] |
Li W, Wang R, Xie H, et al. Changes of pathological and physiological indicators affecting drug metabolism in rats after acute exposure to high altitude[J].
Exp Ther Med,2015, 9 (1) : 98-104.
( 0) 0)
|
| [2] |
Li XY, Liu YN, Li YP, et al. Pharmacokinetics of sulfamethoxazole in healthy Han volunteers living at plain and in native Han and Tibetan healthy volunteers living at high altitude[J].
Yao Xue Xue Bao,2011, 46 (9) : 1117-22.
( 0) 0)
|
| [3] |
Xiong J, Feng J, Yuan D, et al. Tracing the structural evolution of eukaryotic ATP binding cassette transporter superfamily[J].
Sci Rep,2015 : 16724.
( 0) 0)
|
| [4] |
Sharom FJ. The P-glycoprotein multidrug transporter[J].
Essays Biochem,2011, 50 (1) : 161-78.
( 0) 0)
|
| [5] |
Jedlitschky G, Hoffmann U, Kroemer HK. Structure and function of the MRP2 (ABCC2) protein and its role in drug disposition[J].
Expert Opin Drug Metab Toxicol,2006, 2 (3) : 351-66.
DOI: 10.1517/17425255.2.3.351. ( 0) 0)
|
| [6] |
王丹, 饶志, 武新安. 药物转运体所介导的药物相互作用[J].
中国医 院药学杂志,2013, 33 (5) : 397-9.
( 0) 0)
|
| [7] |
Wenbin L, Rong W, Hua X, et al. Effects on pharmacokinetics of propranolol and other factors in rats after acute exposure to high altitude at 4,010 m[J].
Cell Biochem Biophys,2015, 72 (1) : 27-36.
DOI: 10.1007/s12013-014-0397-3. ( 0) 0)
|
| [8] |
Arancibia A, Gai MN, Chávez J, et al. Pharmacokinetics of prednisolone in man during acute and chronic exposure to high altitude[J].
Int J Clin Pharmacol Ther,2005, 43 (2) : 85-91.
DOI: 10.5414/CPP43085. ( 0) 0)
|
| [9] |
Adak A, Ghosh, Mondal KC. Modulation of small intestinal homeostasis along with its microflora during acclimatization at simulated hypobaric hypoxia[J].
Indian J Exp Biol,2014, 52 (11) : 1098-105.
( 0) 0)
|
| [10] |
Zhang JL, Li XY. A review of drug metabolism under hypoxia environment at high altitude[J].
Yao Xue Xue Bao,2015, 50 (9) : 1073-9.
( 0) 0)
|
| [11] |
Ribeiro AL, Ribeiro V. Drug metabolism and transport under hypoxia[J].
Curr Drug Metab,2013, 14 (9) : 969-75.
DOI: 10.2174/1389200211314090003. ( 0) 0)
|
| [12] |
Gola S, Keshri GK, Gupta A. Hepatic metabolism of ibuprofen in rats under acute hypobaric hypoxia[J].
Exp Toxicol Pathol,2013, 65 (6) : 751-8.
DOI: 10.1016/j.etp.2012.11.001. ( 0) 0)
|
| [13] |
Gao F, Feng X, Du F. Effects of blood glucose,lipid and dielectric on SMZCo pharmacokinetics after short-and longtime exposure to high-altitude[J].
Chin J Modern Appl Pharm,2010, 27 (3) : 239-42.
( 0) 0)
|
| [14] |
Comerford KM, Timothy JW, Karhausen J. Hypoxia-inducible Factor-1-dependent Regulation of the Multidrug Resistance(MDR1) Gene 1[J].
Cancer Res,2002, 62 : 3387-94.
( 0) 0)
|
| [15] |
Min L, Chen Q, He S, et al. Hypoxia-induced increases in A549/ CDDP cell drug resistance are reversed by RNA interference of HIF-1α expression[J].
Mol Med Rep,2012, 5 (1) : 228-32.
( 0) 0)
|
| [16] |
Wang C, Wang R, Xie H, et al. Effect of aminophylline on physiological and pathological changes in acute exposure to high altitude in rats[J].
Zhong Nan Da Xue Xue Bao Yi Xue Ban,2015, 40 (1) : 39-45.
( 0) 0)
|
| [17] |
荣黎, 曾维政, 吴晓玲. 高原缺氧与肝脏损伤[J].
世界华人消化杂志,2009, 17 (21) : 2171-8.
( 0) 0)
|
| [18] |
Fradette C, Batonga J, Teng S, et al. Animal models of acute moderate hypoxia are associated with a down-regulation of CYP1A1, 1A2, 2B4, 2C5, and 2C16 and up-regulation of CYP3A6 and P-glycoprotein in liver[J].
Drug Metab Dispos,2007, 35 (5) : 765-71.
DOI: 10.1124/dmd.106.013508. ( 0) 0)
|
| [19] |
Xie J, Li DW, Chen XW, et al. Expression and significance of hypoxia-inducible factor-1α and MDR1/P-glycoprotein in laryngeal carcinoma tissue and hypoxic Hep-2 cells[J].
Oncol Lett,2013, 6 (1) : 232-8.
( 0) 0)
|
| [20] |
Arestegui AH, Fuquay R, Sirota J, et al. High altitude renal syndrome(HARS)[J].
J Am Soc Nephrol,2011, 22 (11) : 1963-8.
DOI: 10.1681/ASN.2010121316. ( 0) 0)
|
| [21] |
Naud J, Michaud J, Beauchemin S, et al. Effects of chronic renal failure on kidney drug transporters and cytochrome P450 in rats[J].
Drug Metab Dispos,2011, 39 (8) : 1363-9.
DOI: 10.1124/dmd.111.039115. ( 0) 0)
|
| [22] |
Liu T, Meng Q, Wang C, et al. Changes in expression of renal Oat1, Oat3 and Mrp2 in cisplatin-induced acute renal failure after treatment of JBP485 in rats[J].
Toxicol Appl Pharmacol,2012, 264 (3) : 423-30.
DOI: 10.1016/j.taap.2012.08.019. ( 0) 0)
|
| [23] |
Jeong HS, Ryoo IG, Kwak MK. Regulation of the expression of renal drug transporters in KEAP1-knockdown human tubular cells[J].
Toxicol In Vitro,2015, 29 (5) : 884-92.
DOI: 10.1016/j.tiv.2015.03.013. ( 0) 0)
|
| [24] |
Beigneux AP, Moser AH, Shigenaga JK, et al. Reduction in cytochrome P-450 enzyme expression is associated with repression of CAR(constitutive androstane receptor) and PXR (pregnane X receptor) in mouse liver during the acute phase response[J].
Biochem Biophys Res Commun,2002, 293 (1) : 145-9.
DOI: 10.1016/S0006-291X(02)00196-1. ( 0) 0)
|
| [25] |
Stienstra R, Lichtenauer-Kaligis E, Müller M. Stress- (and diet-) related regulation of hepatic nuclear receptors and its relevance for ABC-transporter functions[J].
Drug Metab Rev,2004, 36 (2) : 391-406.
DOI: 10.1081/DMR-120037573. ( 0) 0)
|
| [26] |
Urquhart BL, Tirona RG, Kim RB. Nuclear receptors and the regulation of drug-metabolizing enzymes and drug transporters: implications for interindividual variability in response to drugs[J].
J Clin Pharmacol,2007, 47 (5) : 566-78.
DOI: 10.1177/0091270007299930. ( 0) 0)
|
| [27] |
高利臣, 张伟, 范岚, 等. 炎症影响药物转运体表达及活性研究进展[J].
中国药理学通报,2011, 27 (1) : 7-10.
( 0) 0)
|
 2006, Vol. 36
2006, Vol. 36
