2. 广东省医学科学院 广东省人民医院 胸外科,广东 广州 510080 ;
3. 广东省肺癌研究所//广东省医学科学院//广东省人民医院,广东 广州 510080
2. Department of Thoracic Surgery, Guangdong General Hospital/Guangdong Academy of Medical Sciences, Guangzhou 510080, China ;
3. Key Laboratory of Lung Cancer Translational Medicine, Guangdong Lung Cancer Institute/ Guangdong General Hospital/Guangdong Academy of Medical Science, Guangzhou 510080, China
在我国,食管癌是最常见的恶性肿瘤之一,发病率16.7/10万,其发病率位于第4位[1-2]。虽然近些年在食管癌的治疗方面取得了很大进展,手术切除率较前有所提高,并发症也有所下降,但是食管癌总体治疗效果仍不尽人意,术后5年生存率仅为20%~25% [3-5],因此寻找与之相关的生物标记物具有重要的意义。c-met原癌基因最早被确定为肿瘤转化基因,位于染色体7q31,多项研究表明[6-7],c-met基因在胃癌、喉癌、肺癌等许多肿瘤组织中高表达,从而使肿瘤细胞获得比正常细胞优先生长的能力。同时,由原癌基因c-met编码的c-met蛋白也与肿瘤的发生、发展及浸润性有关[8-9],但关于c-met蛋白与食管鳞癌病人临床分期及肿瘤细胞分化程度之间的关系尚未见相关报道。
本研究采用免疫组织化学法检测食管鳞癌组织中c-met蛋白的表达情况,探讨c-met蛋白与食管鳞状细胞癌病人临床病理特征之间的关系,为食管癌病人预后提供参考。
1 资料和方法 1.1 患者资料选取我院收治的原发性食管鳞状细胞癌患者100例,男67例,女33例。入选标准:符合《中国常见恶性肿瘤诊治规范》原发性食管癌诊断标准,术前未接受任何放、化疗。排除标准:复发性食管癌。所有病例中高分化鳞癌27例,中分化鳞癌55例,低分化鳞癌18例;临床Ⅰ/Ⅱ期患者45例,临床Ⅲ/Ⅳ期患者55例。采集相关信息,包括一般情况:性别、年龄;病史、入院时指标等。
1.2 标本采集及处理手术切除后立即取食管癌组织装入2 mL冻存管随即置于液氮中,而后转入-80℃冰箱保存。
1.3 免疫组织化学法将冰冻组织取出,用冷冻组织包埋剂(OCT)固定后切片5μm,于冷丙酮中固定15 min,流水洗去OCT,用3%过氧化氢液浸泡10 min消除内源性过氧化物酶,PBS洗涤3次,每次5 min,pH9.0 Tris-EDTA修复液高压法抗原修复,10%山羊血清进行封闭10 min。一抗孵育置于4℃冰箱过夜。PBS洗涤3次,每次5 min,二抗室温孵育30 min,后洗片并DAB显色。苏木素衬染后返蓝,梯度酒精脱水,二甲苯透明后封片。
1.4 主要试剂及仪器c-met兔抗人单克隆抗体(D1C2 #8198, CST)二抗试剂盒(K5007,DAKO)苏木素染色液。
1.5 免疫组化结果判断每例均随机观察5个视野(×200),采用按照蛋白表达的强弱程度和所占范围进行评价,即肿瘤组织薄膜出现棕褐色沉淀的深浅程度和这种阳性细胞在整个肿瘤细胞区域所占面积。
1.6 统计学分析采用SPSS 16.0软件进行统计学处理,计量资料使用t检验、方差分析及秩和检验,等级资料比较采用χ2检验,使用sPearman秩相关检验进行相关性分析,检验标准取双侧0.05。应用COX回归分析各组危险因素与死亡率的关系,采用Kaplan-Meier法对各组患者进行生存分析,绘制生存函数曲线,P < 0.05为差异有统计学意义。采用Kaplan-Meier法对癌组织中met低表达性和高表达性的患者作生存分析,获得两组生存曲线。统计学检验采用Log Rank法,比较各组生存曲线分布是否相同。
2 结果 2.1 食管癌患者临床基本资料比较入选的100名患者中,平均年龄59.32岁,男67例,女33例。根据食管癌患者c-met蛋白的平均表达水平及临床基本资料比较结果显示,和c-met蛋白表达阴性组相比,c-met蛋白表达阳性组的临床分期更高,分化程度更低(P < 0.05,表 1)。
| 表 1 c-met蛋白表达与临床参数的关系 Table 1 c-met expression in relation to clinicopathologic features of the patients |
在病理分级为高分化食管鳞癌组织中,总阳性率为28.6%(10/35),其中弱阳性占17.1%(6/35),中度或以上阳性占11.5%(4/35)。中分化食管鳞癌组织中,总阳性率为55.0%(22/40),其中弱阳性占35.0%(14/40),中度或以上阳性占20.0%(8/40)。低分化食管鳞癌组织中,总阳性率为68.0%(17/25),其中弱阳性占28.0%(7/ 25),中度或以上阳性占40, 0%(10/25)。高分化的食管鳞癌组织中的c-Met表达均明显低于中分化和低分化的食管鳞癌组织(P < 0.05,表 2)。恶性程度越高的肿瘤,c-Met的表达也越强。
| 表 2 Met在不同分化水平的食管癌组织中的表达情况 Table 2 Level of Met expression in ESCC patients with different levels of tumor differentiation |
在不同分期的食管鳞癌组织中,Ⅱ期病人的总阳性率为31.6%(12/38),其中弱阳性占18.4%(7/38),中度或以上阳性占13.2%(5/38)。Ⅲ期病人的总阳性率为45.5%(15/33),其中弱阳性占30.3%(10/33),中度或以上阳性占15.2%(5/33)。Ⅳ期病人的食管鳞癌组织中的总阳性率为75.9%(22/29),其中弱阳性占31.1%(9/ 29),中度或以上阳性占44.8%(13/29)。c-Met蛋白的表达与食管癌分期有关(P < 0.05,表 3)。
| 表 3 Met在不同分期食管癌组织中的表达情况 Table 3 Met expression in patients in different stages of ESCC |
分别对100名食管癌患者进行随访,结果显示,Met阴性的病人的中位生存期是48.2月,Met阳性的病人的中位生存期是30.9月,差异具有统计学意义(P < 0.05)。Kaplan-Meier生存函数曲线表明,与低值组比较,高值组患者生存率显著降低,秩和卡方值为17.685,P < 0.05(图 1)。
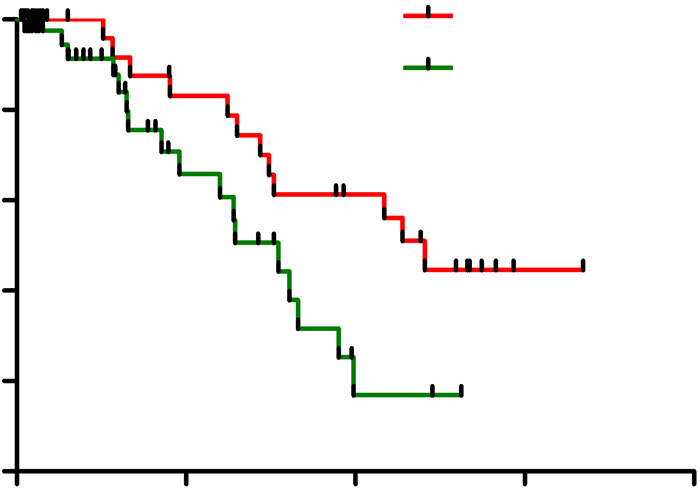
|
图 1 食管癌患者Kaplan-Meier生存函数曲线分析 Figure 1 Kaplan-Meier survival curves of ESCC patients. |
COX回归分析表明,在校正了可能与死亡率相关的危险因素后,c-met仍是随访期间的死亡独立预测因子(图 1)。与c-met蛋白表达阴性组组比较,c-met蛋白表达阳性患者随访期间死亡危险比为2.34(95% CI: 1.63~4.54,P < 0.05)。
3 讨论在本研究中,我们观察到c-met蛋白在食管鳞状细胞癌组织中明显上调,与食管癌的分期和分化密切相关,是患者随访期间生存时间的独立预测因子。因此,本研究进一步证实了c-met蛋白在食管鳞癌发生和发展过程的重要性。
一般研究表明,c-met基因的表达与基因扩增有关[10-11]。应用实时荧光定量RT-PCR对食管鳞癌组织和相应正常食管黏膜组织进行MET mRNA检测,有研究表明[12],15例食管鳞癌组织中有12例met mRNA为上调表达。采用免疫组织化学EnVinsion法检测88例食管癌组织中c-met蛋白的表达情况,结果显示c-met在食管癌组织中的阳性率分别为88.64%[13]。但对于c-met蛋白与食管癌病人临床病理特征之间的关系及其对食管癌病人预后的价值,目前还存在争议[14-15]。
本研究分别检测食管癌组织中c-met蛋白的表达情况,差异具有统计学意义,这和以前的相关报道是一致的[16-18]。同时很多研究表明c-met蛋白也与肿瘤的发生、发展及浸润性有关。于是我们进一步根据c-met蛋白的平均表达水平将食管癌患者分为c-met蛋白表达阳性及阴性两组,并进一步比较他们临床病理特征。结果显示,和c-met蛋白表达阴性组相比,c-met蛋白表达阳性组的临床分期更高,分化程度更低[19-21]。我们还对入选的100名患者进行了长期的随访,结果显示,阴性组生存时间为21.78±13.35月,阳性组为13.75±15.56月,差异具有统计学意义。另外,Kaplan-Meier生存函数曲线表明,与低值组比较,高值组患者生存率显著降低。COX回归分析表明,在校正了可能与死亡率相关的危险因素后,c-met仍是随访期间的死亡独立预测因子,与c-met低值组比较,c-met高值组患者随访期间死亡危险比为2.34。总的来说,我们发现c-met蛋白与食管癌患者的临床分期及肿瘤细胞分化程度密切相关,这进一步证实了c-met蛋白在食管癌发生和发展过程的重要性。
另外,本研究也还有很多不足之处:(1)本研究为回顾性、单中心观察性研究,且样本相对较小,因而分析受到各种固有的不可预知的混淆因素干扰;(2)没有在RNA水平和血清中进一步验证c-met的表达水平;(3)我们没有全面评估相关癌症标记物与c-met蛋白的关系。因此,下一步我们要进一步扩大样本量,全面分析c-met的生物学意义。
因此,我们的研究证实了c-met蛋白在食管鳞状细胞癌组织中明显上调,与食管癌的分期和分化密切相关,是患者随访期间生存时间的独立预测因子。
| [1] |
Hao J, Shao K. The epidemiology status and the treatment of esophageal cancer in China[J].
J Cancer China,2011, 21 (7) : 501-4.
( 0) 0)
|
| [2] |
Xu Y, Peng Z, Li Z, et al. Expression and clinical significance of c-Met in advanced esophageal squamous cell carcinoma[J].
BMC Cancer,2015, 15 (5) : 6.
( 0) 0)
|
| [3] |
Saito S, Morishima K, Ui T, et al. The role of HGF/Met and FGF/ FGFR in fibroblast-derived growth stimulation and lapatinibresistance of esophageal squamous cell carcinoma[J].
BMC Cancer,2015, 15 (6) : 82.
( 0) 0)
|
| [4] |
Ozawa Y, Nakamura Y, Fujishima F, et al. c-Met in esophageal squamous cell carcinoma: an Independent prognostic factor and potential therapeutic target[J].
BMC Cancer,2015, 15 (4) : 451.
( 0) 0)
|
| [5] |
Stein U, Walther W, Arlt F, et al. MACC1, a newly identified key regulator of HGF-MET signaling, predicts colon cancer metastasis[J].
Nat Med,2009, 15 (1) : 59-67.
DOI: 10.1038/nm.1889. ( 0) 0)
|
| [6] |
Peng Z, Zhu Y, Wang Q, et al. Prognostic significance of Met amplification and expression in gastric cancer: a systematic review with meta-analysis[J].
PLoS One,2014, 9 (1) : e84502.
DOI: 10.1371/journal.pone.0084502. ( 0) 0)
|
| [7] |
Shirahata A, Fan W, Sakuraba K, et al. MACC 1 as a marker for vascular invasive hepatocellular carcinoma[J].
Anticancer Res,2011, 31 (3) : 777-80.
( 0) 0)
|
| [8] |
Camp ER, Yang A, Gray MJ, et al. Tyrosine kinase receptor RON in human pancreatic cancer: expression, function, and validation as a target[J].
Cancer,2007, 109 (6) : 1030-9.
DOI: 10.1002/(ISSN)1097-0142. ( 0) 0)
|
| [9] |
Shirahata A, Sakata M, Kitamura Y, et al. MACC 1 as a marker for peritoneal-disseminated gastric carcinoma[J].
Anticancer Res,2010, 30 (9) : 3441-4.
( 0) 0)
|
| [10] |
Han CB, Ma JT, Li F, et al. EGFR and KRAS mutations and altered c-Met gene copy numbers in primary non-small cell lung cancer and associated stage N2 lymph node-metastasis[J].
Cancer Lett,2012, 314 (1) : 63-72.
DOI: 10.1016/j.canlet.2011.09.012. ( 0) 0)
|
| [11] |
Xu YP, Lin G, Sun XJ, et al. C-Met as a molecular marker for esophageal squamous cell carcinoma and its association with clinical outcome[J].
J Cancer,2016, 7 (5) : 587-94.
DOI: 10.7150/jca.13687. ( 0) 0)
|
| [12] |
Qiu J, Huang P, Liu Q, et al. Identification of MACC1 as a novel prognostic marker in hepatocellular carcinoma[J].
J Transl Med,2011, 9 (5) : 166.
( 0) 0)
|
| [13] |
李沛, 凌志强, 金戈, 等. 食管鳞癌组织中MET原癌基因mRNA的表达[J].
郑州大学学报:医学版,2006, 41 (5) : 848-9.
( 0) 0)
|
| [14] |
Mesteri I, Schoppmann SF, Preusser M, et al. Overexpression of CMET is associated with signal transducer and activator of transcription 3 activation and diminished prognosis in oesophageal adenocarcinoma but not in squamous cell carcinoma[J].
Eur J Cancer,2014, 50 (7) : 1354-60.
DOI: 10.1016/j.ejca.2014.01.022. ( 0) 0)
|
| [15] |
Jardim DL, De Melo Gagliato D, Falchook GS, et al. Met aberrations and c-MET inhibitors in patients with gastric and esophageal cancers in a phase I unit[J].
Oncotarget,2014, 5 (7) : 1837-45.
DOI: 10.18632/oncotarget. ( 0) 0)
|
| [16] |
姜永全, 白晓鸣, 柴立勋, 等. Ezrin蛋白和cmet在食管鳞癌中的表达及其临床意义[J].
肿瘤研究与临床,2009, 21 (5) : 24-8.
( 0) 0)
|
| [17] |
李沛, 凌志强, 赵继敏, 等. ECl09细胞eDNA微矩阵基因芯片的建立及其方法学分析[J].
郑州大学学报,2006, 41 (2) : 272.
( 0) 0)
|
| [18] |
Eder JP, Vande Woude GF, Boerner SA, et al. Novel therapeutic inhibitors of the c-Met signaling pathway in cancer[J].
Clin Cancer Res,2009, 15 (7) : 2207-14.
DOI: 10.1158/1078-0432.CCR-08-1306. ( 0) 0)
|
| [19] |
Kato H, Arao T, Matsumoto K, et al. Gene amplification of EGFR, HER2, FGFR2 and Met in esophageal squamous cell carcinoma[J].
Int J Oncol,2013, 42 (4) : 1151-8.
( 0) 0)
|
| [20] |
Jiang S, Zhao C, Yang X, et al. miR-1 suppresses the growth of esophageal squamous cell carcinoma in vivo and in vitro through the downregulation of Met, cyclin D1 and CDK4 expression[J].
Int J Mol Med,2016, 38 (1) : 113-22.
( 0) 0)
|
| [21] |
Wang H, Jiang D, Song Q, et al. Prognostic impact and potential interaction of EGFR and c-Met in the progression of esophageal squamous cell carcinoma[J].
Tumour Biol,2016 (10) : 4692-4.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
