2. 广东药学院生命科学与生物制药学院,广东 广州 510006 ;
3. 广东药学院附属第一医院,广东 广州 510080
2. School of Life Science and Biopharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China ;
3. First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China
人的骨骼在一生中不断进行着新陈代谢-即吸收旧骨,形成新骨的骨骼重建[1],它涉及成骨细胞和破骨细胞间数量和功能的动态平衡,骨代谢的异常是导致代谢性骨病的主要原因。大多数代谢性骨病如骨质疏松症就是由于骨代谢的失衡,破骨量大于成骨量所致,破骨细胞的分化或其功能的改变所导致的骨改建失衡是代谢性骨病的重要病理基础[2]。许多细胞因子在破骨细胞生成和骨吸收中起作用,破骨细胞骨吸收功能活跃是其发生的病理生理之一,对破骨细胞骨吸收功能的调节是防治骨质疏松症的主要药理基础之一。
上世纪90年代末发现,ENaC不仅存在于上皮细胞,在软骨和成骨细胞(Ob)上也有ENaC的表达和活性[3-7]。它是一种新型的非电压依赖性钠离子通道蛋白, 负责调控细胞的钠离子转运, 维持体内钠离子的平衡, 主要受荷尔蒙、细胞内的Ca+、Na+、pH值和G蛋白调节。ENaC是细胞间相互通讯和传送电信号的基本途径之一,也是许多药物作用的靶点,研究表明[8-11],Na+和ENaC与骨质疏松等骨代谢疾病及成骨细胞功能存在相关性,由于成骨细胞具有调节破骨细胞的功能[12-13],那么ENaC是否影响破骨细胞的功能,国内外在这方面的研究尚未见文献报道,因此,本实验拟通过研究Ami对破骨细胞功能的影响,探讨ENaC与破骨细胞功能及骨质疏松的关系,为治疗骨代谢疾病的作用机制研究提供新思路。
1 材料和方法 1.1 材料和仪器 1.1.1 实验动物2只4周龄SD雄性大鼠,体质量108±8 g;20只10周龄雌性SD大鼠,体质量160~180 g(广州中医药大学实验动物中心提供许可证号:SCXK(粤)2008-0020)。
1.1.2 主要试剂α-MEM培养基、胎牛血清FBS(Hyclone),细胞分离液Histopaque-1083(Sigma),巨噬细胞集落刺激因子(M-CSF)、核因子κB受体活化因子配基(RANKL)(Peprotech公司),一抗α-ENaC(H-95)(Santa),二抗FITC Goat-Rabbit LgG(H+L)(EarthOx),盐酸阿米洛利(Sigma),CCK-8检测试剂盒(贝博生物),抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(Sigma)。
1.1.3 仪器Micro-CT(美国GE),BT 25 S电子天平(德国SARTORIUS),Galaxy二氧化碳培养箱(英国RSBiotech),J-D200倒置生物显微镜(深圳拓天仪器设备有限公司),BX51T-PHD-J11显微镜(日本Olympus),SW-CJ-1CU型无菌超净台(苏州空气技术有限公司),SP1600型锯片机(德国Leica),BioquantOsteo骨形态学图像分析系统(美国BIOQUANT)。
1.2 方法 1.2.1 牛皮质骨片的制备及处理取新鲜牛股骨切成100μm厚,4 mm×4 mm,70%乙醇浸泡过夜。双蒸水中超声清洗5 min×3次。紫外照射2 h并在层流净化装置中干燥。α-MEM培养基培养备用。
1.2.2 破骨细胞的诱导及实验分组按照常规方法[14]分离出4周龄SD雄性大鼠骨髓基质细胞,用α-MEM全培养液(含体积分数为15%胎牛血清、青霉素100 U/mL、链霉素100μg/mL)重悬,然后Histopaque分离液分离单个核细胞,再用α-MEM全培养液制备细胞悬液,加入M-CSF(10 ng/mL),置于100 mm培养皿中(2×107),37℃、5% CO2培养箱内培养24 h。24 h后,收集非贴壁细胞,离心,PBS清洗再用α-MEM全培养液制备细胞悬液(1×106/mL),按1×105/孔的细胞密度种入预先放置细胞爬片和骨片的96孔培养板中,30 ng/mL M-CSF预诱导3 d,此时贴壁的细胞为破骨前体细胞(BMMs)。3 d后,加入50 ng/mL M-CSF和100 ng/mL RANKL共同诱导同时加入不同浓度的盐酸阿米洛利溶液进行干预(Ami终浓度分别为:1×10-8、1×10-6、1×10-4 mol/L),设空白对照组(Control,未给予盐酸阿米洛利);另外按3×106/孔的细胞密度种入6孔培养板中(用于RT-PCR实验),盐酸阿米洛利溶液进行干预(Ami终浓度分别为:1×10-6、1×10-4 mol/L),设空白对照组(Control,未给予盐酸阿米洛利)。每2 d换液1次并在倒置相差显微镜下观察。
1.2.3 破骨细胞TRAP染色鉴定取诱导6 d的细胞爬片,按TRAP染色试剂盒(Sigma公司)操作步骤进行染色,显微镜下观察,计算破骨细胞数目。方法为显微镜100倍下随机选取5个视野计数每孔中TRAP染色阳性细胞(细胞核≥3个,细胞质内出现棕褐色颗粒)数目,5个视野的平均数代表该细胞爬片的破骨细胞数目。
1.2.4 破骨细胞骨吸收功能检测取与破骨细胞共同培养9 d的骨片,2.5%戊二醛国定7 min,于0.25%氢氧化铵中超声清洗5 min×3次,系列乙醇脱水,自然晾干。1%甲苯胺蓝染液室温染色3~4 min,蒸馏水清洗后光镜下观察。100倍光镜下观察和拍摄整张骨片(4视野/片),计算机辅助计量骨吸收陷窝数每时相点计量不少于5张骨片,以平均陷窝数(n)表示。
1.2.5 破骨细胞标志酶基因表达的检测取诱导6 d的6孔培养板,Trizol提取总RNA,按PrimeScript(One StepRT-PCR KitVer.2试剂盒说明进行逆转录直接合成DNA。根据文献[15]设计引物,由Invitrogen公司合成,序列见表 1。扩增条件:50℃30 min;94℃2 min;94℃变性30 s;60℃退火30 s,72℃延伸1 min,共进行30个循环,最后72℃7 min结束循环。RT-PCR产物在1.5%琼脂糖凝胶电泳检测。
| 表 1 引物序列列表 Table 1 Tab.1 Primer sequences used for RT-PCR |
诱导培养结果显示,接种12 h后细胞开始贴壁,为体积较小的圆形细胞,大小一致,分布均匀;培养第2天时,部分细胞伸出伪足;培养第3天时,悬浮于培养液中的未贴壁细胞随换液被除去,剩余的贴壁细胞胞体逐渐变大;培养第4天时,可观察到单个核细胞开始融合,出现多核细胞(圆形、椭圆形或腊肠型等), 细胞边缘不规则,有突起和伪足,细胞内有数个或数十个细胞核,细胞质内可见大小不等的空泡;随着诱导时间的延长,破骨细胞数量逐渐增多,体积不断增大。破骨细胞TRAP染色(图 1)。
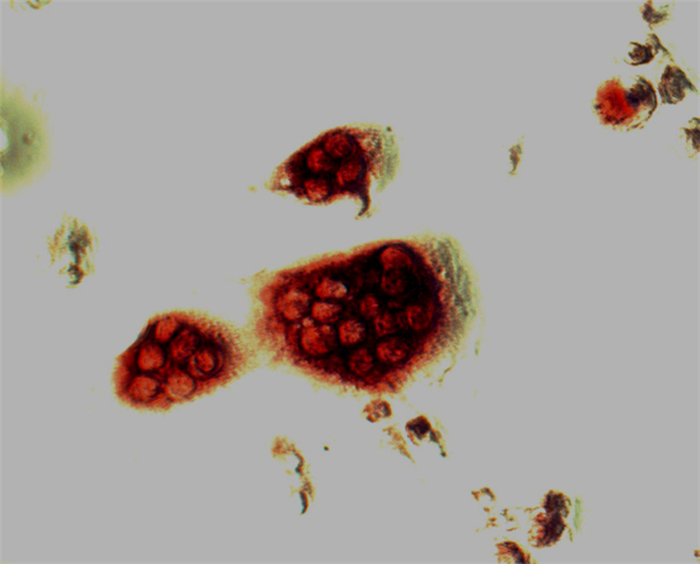
|
图 1 破骨细胞TRAP染色鉴定 Figure 1 Osteoclasts stained with TRAP (Inverted phasecontrast microscopy, original magnification:×200). |
正常破骨细胞形态均一,为大而圆的多核细胞,胞浆中有大小不等的空泡,细胞分布均匀、致密,轮廓清晰。实验结果发现Ami处理后,破骨细胞形成的数目减少,细胞液泡、核结构模糊。不同浓度的Ami处理后,随着Ami剂量增大,对破骨细胞形成的抑制作用增强,呈剂量依赖性。不同浓度Ami对破骨细胞的抑制率具有统计学差异(P < 0.05,图 2)。
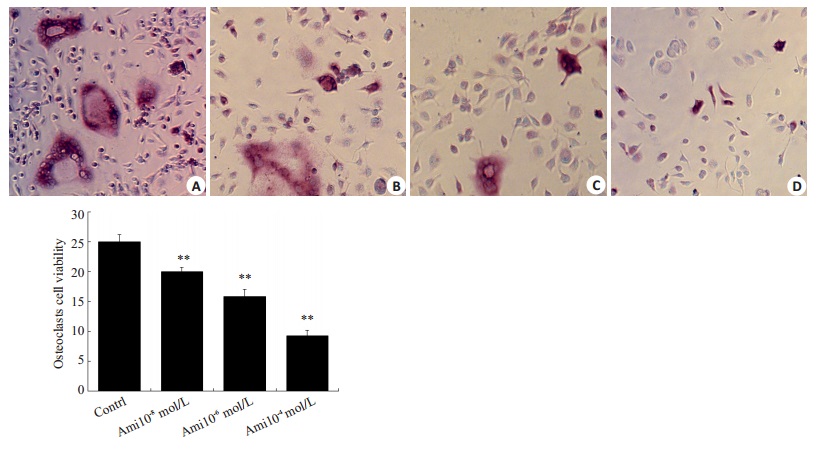
|
图 2 不同浓度Ami对破骨细胞的抑制作用 Figure 2 Changes in viability of osteoclasts after treatment with different concentrations of Ami (Original magnification:×100). The osteoclasts were stained with TRAP. *P < 0.05, **P < 0.01 vs control. A: Contrl; B: Ami10-8 mol/L; C: Ami10-6 mol/L; D: Ami10-4 mol/L. |
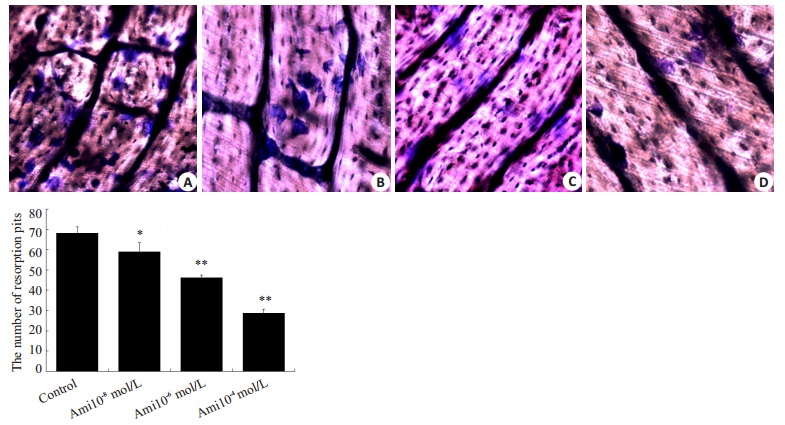
|
图 3 Ami抑制破骨细胞的骨吸收 Figure 3 Ami inhibits bone resorption by osteoclast cells (Toluidine blue staining, original magnification:×200). *P < 0.05, **P < 0.01 vs control. A: Control; B: Ami (10-8 mol/L); C: Ami (10-6 mol/L); D: Ami (10-4 mol/L). |
骨片上形成吸收陷窝是破骨细胞骨吸收的直接结果,其陷窝数量、大小和深度直接反应破骨细胞骨吸收的能力。不同浓度的Ami处理Oc后,骨片上形成吸收陷窝数目明显减少,图片及统计结果如下。
2.4 阿米洛利降低破骨细胞标志酶基因的表达组织蛋白酶是一大类主要存在于溶酶体的胞内蛋白酶,OC中组织蛋白酶K(溶酶体含有的半胱氨酸蛋白酶)选择性高表达,是OC作用中最主要的胞内蛋白酶,它选择性的在OC介导的骨吸收中起特殊的作用[16],是介导OC引起骨吸收的重要因素。不同浓度的Ami处理Oc后,与Ctrl组比较,Oc标志酶基因CK的表达明显降低。结果见图 4。

|
图 4 Ami抑制破骨细胞标志酶基因CK的表达 Figure 4 Ami inhibits the expression of osteoclastspecific gene cathepsin K. |
近年来,我国在原发性骨质疏松症发生率大幅度上升的同时,由糖尿病、甲状腺疾病、高血压和长期应用糖皮质激素所致的继发性骨质疏松症患者也明显增多。骨质疏松的发生不仅增加原发病的治疗难度,而且它引起的“骨折”给骨科的临床治疗带来了很大的难度。因此,寻找防治骨质疏松发生的新思路、新药物一直是当今医学研究的热点和急需解决的临床问题。
破骨细胞是骨组织吸收的主要功能细胞,直接参与骨吸收,在维持骨代谢平衡中发挥重要的作用,它有助于维持骨骼系统的完整性和矿物质的稳态,与骨质疏松密切相关。本研究主要讨论ENaC是否与破骨细胞的功能活性相关及其如何影响破骨细胞的功能。ENaC蛋白属于ENaC/DEG超基因家族,主要调控跨上皮细胞钠离子的转运,维持体内钠离子的平衡,ENaC在破骨细胞和软骨细胞上都有分布[17-18]。ENaC不仅能够调节上皮通道Na+的转运,而且参与了成骨细胞在压力的刺激作用下的信号转导,从而发挥其调节骨形成的功能[19]。也有研究[20]从结构基础与功能特点方面发现ENaC在骨组织代谢中发挥作用。卢丽等[21]研究发现,低浓度Na+明显促进Ob的分化,高浓度Na+则抑制Ob的分化,ENaC通过调节成骨细胞内、外平衡,从而对成骨细胞的分化以及矿化功能产生影响。另外,研究表明,阿米洛利可特异性阻断ENaC其功能活性[22]。本实验使用不同浓度的阿米洛利处理破骨细胞后,破骨细胞的分化和骨吸收都受到明显抑制。本实验首次发现体外培养破骨细胞,抑制破骨细胞上的ENaC会降低Oc的功能活性,它提示ENaC可能是骨代谢调节的新机制。
破骨细胞主要由RANKL和M-CSF共同刺激后融合形成,其形成和活化过程中受到转录因子、细胞因子、整合素、溶酶体、Src蛋白、骨保护素等的影响[23]。相关研究表明[24-25]T细胞免疫调节子1通过影响组织蛋白酶K影响破骨细胞的活性,最后导致骨基质去矿化和溶解。组织蛋白酶K是破骨细胞作用中最主要的胞内蛋白酶,在破骨细胞中选择性高表达,是介导破骨细胞引起骨吸收的重要因素。值得注意的是蛋白酶K抑制剂(奥达卡替)进入治疗绝经后骨质疏松症的二期临床,奥达卡替虽能抑制骨吸收,但是不能抑制骨形成,其机制与破骨细胞刺激骨形成有关[26-27]。本实验RT-PCR检测发现,低浓度阿米洛利可以显著下调破骨细胞中ENa的表达,同时下调组织蛋白酶K的表达。这提示组织蛋白酶K的表达下调可能是由于破骨细胞中ENaC的表达下降导致。但是ENaC具体通过何种途径来调节组织蛋白酶K的表达有待进一步研究。
本研究结果提示:ENaC直接影响破骨细胞的功能活性,影响作用与浓度相关。主要表现在影响破骨细胞分化和骨吸收,以及破骨功能相关基因的调节。说明ENaC可能是调控破骨细胞功能的重要内源性调节因子。因此,ENaC对骨代谢的调节作用具有较高的研究价值,它可能提示骨代谢调节的新机制,为代谢性骨病的发生、发展机制提供新的理论依据,扩展新的思路。
| [1] |
Törring. Effects of denosumab on bone density, mass and strength in women with postmenopausal osteoporosis[J].
Ther Adv Musculoskelet Dis,2015, 7 (3) : 88-102.
DOI: 10.1177/1759720X15579189. ( 0) 0)
|
| [2] |
Bonucci E, Ballanti P. Osteoporosis-bone remodeling and animal models[J].
Toxicol Pathol,2014, 42 (6) : 957-69.
DOI: 10.1177/0192623313512428. ( 0) 0)
|
| [3] |
Shehata MF. Regulation of the epithelial sodium channel in kidneys of salt-sensitive dahl rats: insights on alternative splicing[J].
Int Arch Med,2009, 2 (1) : 28.
DOI: 10.1186/1755-7682-2-28. ( 0) 0)
|
| [4] |
Lewis R, May H, Mobasheri A, et al. Chondrocyte channel transcriptomics do microarray data fit with expression and functional data[J].
Channels,2013, 7 (6) : 459-67.
DOI: 10.4161/chan.26071. ( 0) 0)
|
| [5] |
Ge Y, Gannon K, Gousset M, et al. Impaired myogenic constriction of the renal afferent arteriole in a mouse model of reduced beta ENaC expression[J].
Am J Physiol Renal Physiol,2012, 302 (11) : F1486-93.
DOI: 10.1152/ajprenal.00638.2011. ( 0) 0)
|
| [6] |
Mobasheri A, Trujillo E, Arteaga MF, et al. Na(+), K(+)-ATPase subunit composition in a human chondrocyte cell line; evidence for the presence ofα1, α3, β1, β2 andβ3 isoforms[J].
Int J Mol Sci,2012, 13 (4) : 5019-34.
( 0) 0)
|
| [7] |
Pocock AE, Trujillo E. Detection of mRNA and protein of theαsubunit of the epithelial sodium channel (ENaC) in human osteoblasts and human ACL cells[J].
J Physiol,2001, 535 (3) : S046.
( 0) 0)
|
| [8] |
Caudarella R, Vescini F, Rizzoli E, et al. Salt intake, hypertension, and osteoporosis[J].
J Endocrinol Invest,2009, 32 (4) : 15-20.
( 0) 0)
|
| [9] |
Kuwabara A. Nutrition and bone health, dietary sodium intake and bone health[J].
Clin Calcium,2010, 20 (4) : 590-5.
( 0) 0)
|
| [10] |
Pask GM, Bobkov YV, Corey EA, et al. Blockade of insect odorant receptor currents by amiloride derivatives[J].
Chem Senses,2013, 38 (3) : 221-9.
DOI: 10.1093/chemse/bjs100. ( 0) 0)
|
| [11] |
Shi S, Kleyman TR. Gamma subunit second transmembrane domain contributes to epithelial sodium channel gating and amilorideblock[J].
Am J Physiol Renal Physiol,2013, 305 (11) : F1585-92.
DOI: 10.1152/ajprenal.00337.2013. ( 0) 0)
|
| [12] |
Charles JF, Aliprantis AO. Osteoclasts: more than 'bone eaters'[J].
Trends Mol Med,2014, 20 (8) : 449-59.
DOI: 10.1016/j.molmed.2014.06.001. ( 0) 0)
|
| [13] |
林文彬. 成骨细胞与破骨细胞的研究探讨[J].
中医骨伤科医学杂志,2007, 24 (6) : 39-47.
( 0) 0)
|
| [14] |
刘文, 王晓庚, 周洪, 等. 高纯度破骨样细胞体外培养及功能表达的研究[J].
华西口腔医学杂志,2008, 6 (26) : 599-603.
( 0) 0)
|
| [15] |
Tanida A, Kishimoto Y, Okano T, et al. Etanercept Promotes Bone Formation via Suppression of Dickkopf-1 Expression in Rats with Collagen-InducedArthritis[J].
Yonago Acta Med,2013, 56 (1) : 13-9.
( 0) 0)
|
| [16] |
Schmit JM, Pondenis HC, Barger AM, et al. Cathepsin K expression and activity in canine osteosarcoma[J].
J Vet Intern Med,2012, 26 (1) : 126-34.
DOI: 10.1111/jvim.2012.26.issue-1. ( 0) 0)
|
| [17] |
Orriss IR. The role of purinergic signalling in the musculoskeletal system[J].
Auton Neurosci,2015, 191 (7) : 124-34.
( 0) 0)
|
| [18] |
Oeckel E, Haber T, Prawitt D, et al. High calcium concentration in bones promotes bone metastasis in renal cell carcinomas expressing calcium-sensing receptor[J].
Mol Cancer,2014, 13 (6) : 42.
( 0) 0)
|
| [19] |
Guo D, Liang S, Wang S, et al. Role of epithelial sodium channels (ENaCs) in endothelial function[J].
J Cell Sci,2015, 30 (4) : 168831.
( 0) 0)
|
| [20] |
Korte S, Sträter A, Drüppel V, et al. Feedforward activation of endothelial ENaC byhigh sodium[J].
FASEB J,2014, 28 (9) : 4015-25.
DOI: 10.1096/fj.14-250282. ( 0) 0)
|
| [21] |
卢丽, 吴亮, 陈珺, 等. 钠离子对成骨细胞的影响及其与上皮钠通道的关系[J].
南方医科大学学报,2011, 31 (11) : 1871-4.
( 0) 0)
|
| [22] |
Shimko MJ, Zaccone EJ, Thompson JA, et al. Nerve growth factor reduces amiloride-sensitive Na + transport in human airway epithelial cells[J].
Physiol Rep,2014, 2 (7) : e12073.
DOI: 10.14814/phy2.12073. ( 0) 0)
|
| [23] |
孙晓虎, 吴瑜隆, 骞爱荣, 等. 破骨细胞的形成和活化研究进展[J].
中国细胞生物学学报,2014, 36 (2) : 258-66.
( 0) 0)
|
| [24] |
Tolar J, Teitelbaum SL, Orchard PJ. Osteopetrosis[J].
N Engl J Med,2004, 351 (27) : 2839-49.
DOI: 10.1056/NEJMra040952. ( 0) 0)
|
| [25] |
Van WL, Odgren PR, Coxon FP, et al. Involvement of PLEKHMI in osteoclastic vesicular transport and osteopetrosis in incisors absent rats and humans[J].
J Cloin Invest,2007, 117 (4) : 919-30.
DOI: 10.1172/JCI30328. ( 0) 0)
|
| [26] |
Wiliams SC. Potential fist-in-class osteopetrosis drug speeds through trials[J].
Nat Med,2012, 18 (8) : 1158.
DOI: 10.1038/nm0812-1158. ( 0) 0)
|
| [27] |
Stoch S, Zajic S, Stone JA, et al. Odanacatib a selective cathepsin K inhibitor to treat osteopetrosis: Safety, tolerability, pharmacokinetic and pharmacodynamics-results from single oral dose studies in healthy volunteers[J].
Br J Clin Pharmacol,2013, 75 (5) : 1240-54.
DOI: 10.1111/bcp.2013.75.issue-5. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
