人脐静脉内皮细胞(HUVECs)是血管形成实验的经典模型细胞。血管形成不仅在正常生理条件下发生,同时也会在肿瘤及其他许多非肿瘤疾病出现[1-2]。因此,HUVECs作为工具细胞被广泛用于候选药物筛选[3-5]、血管构建等[6-7]实验研究。人脐静脉作为内皮细胞的主要来源具有取材容易、来源充足及操作简单等优点,而且从足月妊娠分娩的新生儿脐静脉收获的HUVECs活力强、纯度高,被广泛用于临床前基础研究。
细胞饥饿培养,即血清饥饿,通过降低培养液中的血清浓度或完全无血清培养,使细胞因缺乏血清中的生长因子而不能分裂,将细胞周期阻滞在G0/G1期。在此基础上进行的后续处理,如给予刺激因素或者药物时,可以避免细胞所处的状态不同或血清中因子的干扰造成的实验误差,增加实验结果的稳定性。但不同细胞用不同血清浓度处理不同时间的饥饿效果各不相同[8]。
本实验采用酶灌注消化法成功分离了高纯度的HUVECs,并探讨不同血清浓度处理不同时间对HUVECs周期的影响,找到了HUVECs的最佳饥饿条件,为进一步的HUVECs实验提供实验基础。
1 材料和方法 1.1 材料 1.1.1 标本足月妊娠分娩的新生儿脐带均由南方医科大学珠江医院妇产科提供。
1.1.2 试剂Ⅱ型胶原酶(Sigma公司,美国);内皮细胞专用培养基(Sciencell公司,美国);兔抗人Ⅷ因子多克隆抗体(Novus公司,美国);山羊抗兔IgG Fc(Alexa Fluor488)(abcam公司,美国);FITC标记鼠抗人CD31多克隆抗体(BD公司,美国);FITC标记鼠IgG 1k抗体(BD公司,美国)。
1.1.3 仪器细胞培养箱(Hera cell 150, Heraeus);超净工作台(JW-CJ-1F,苏州净化设备厂);共聚焦显微镜(OLYMPUS公司,日本);FACSVantageSE流式细胞仪(BD公司,美国)。
1.2 方法 1.2.1 人脐静脉内皮细胞的原代分离及培养将脐带(15~20 cm)放入无菌生理盐水中,置4℃冰箱保存,3 h内进行分离。用含1%双抗的无菌生理盐水洗净脐带表面残血,剪去有血肿部分,两端修齐备用。找到脐静脉(壁薄、管腔大),插入5 mL注射器针头(针减半修钝),用止血钳固定。用含1%双抗的无菌生理盐水反复冲洗脐静脉至流出液清亮。将预热的0.1%Ⅱ型胶原酶注入脐静脉,待下端有胶原酶液流出后用止血钳夹住。继续注入适量胶原酶液使管腔充盈,保持注射器竖直固定(此时注射器内应有胶原酶以维持压力),将脐带置于含少量预热生理盐水玻璃皿中,两端微抬成U型,放入37℃恒温箱消化15 min。消化结束后打开下端止血钳,使消化液流入预先装有预热内皮细胞专用培养基(含5% FBS、1% ECGS、1%双抗)的15 mL离心管中,再用培养基冲洗静脉管两次,收集冲洗液,1200 r/min离心5 min,弃上清,用内皮细胞专用培养基重悬细胞,移入培养瓶中,置于细胞培养箱中培养。24 h后换液,之后每隔24 h半量换液1次。待细胞生长的融合度达到80%~90%时,用0.25%胰酶消化传代。
1.2.2 人脐静脉内皮细胞的形态学观察及鉴定换液后在显微镜下观察细胞形态及生长特征,采用细胞免疫荧光方法染色鉴定。胰酶消化细胞后,接种于35 mm培养皿内,待细胞密度达到约80%后用于鉴定;细胞用PBS漂洗1次;加入4%多聚甲醛500μL,37℃固定15 min,PBS漂洗5 min×3次;加入500μL的0.5% Triton X-100室温破膜10 min,PBS漂洗5 min×3次;加入500μL的10%山羊血清(1% BSA/PBS配制)37℃封闭30 min;倾去封闭液。按1:80稀释比例加入特异性兔抗人anti-VⅢ抗体500μL,37℃孵育3 h,PBS漂洗5 min×3次;阴性对照组用PBS代替一抗;按1:200稀释比例加入Alexa Fluor 488标记山羊抗兔二抗500μL,37℃避光孵育1 h,PBS漂洗5 min×3次;加入DAPI染核液,室温孵育15 min,弃去染色液,甲醇漂洗1次;加入适量体积封片剂(甘油:PBS=6:4)封片;共聚焦显微镜观察、拍照。
1.2.3 流式细胞术检测人脐静脉内皮细胞的纯度采用流式细胞术检测细胞纯度。取原代HUVECs置于两个流式管中,每管2×106个细胞,分别加入FITC标记鼠抗人CD31多克隆抗体及同型对照IgG,室温避光30 min孵育。PBS洗涤细胞,离心5 min,重复2次,200μL PBS重悬,上机检测。
1.2.4 流式细胞术检测细胞周期取8代内对数生长期HUVECs接种于六孔板,待细胞融合度为60%~80%时,用PBS洗涤细胞3次,分别用0%、0.1%、0.5%、1%血清浓度的内皮细胞专用培养基培养0、6、12、18和24 h。处理结束,消化细胞,洗涤收集,并固定于75%预冷乙醇中。将固定过夜的细胞洗涤离心后加RNA酶37℃30 min,加PI染料避光染色30 min,上机检测。每个处理独立重复实验3次。
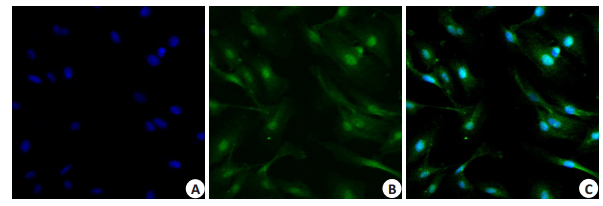
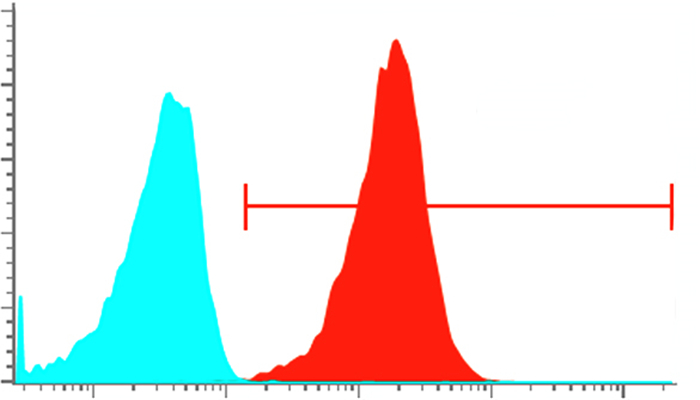
2 结果 2.1 细胞形态、免疫荧光观察及纯度检测倒置显微镜下,细胞呈扁平不规则多边形,边缘清楚,培养瓶周边细胞多为长梭形生长。细胞生长时彼此紧密相连,呈典型的铺卵石状排列,细胞较密处呈涡旋状排列。Ⅷ因子相关抗原细胞免疫荧光观察,可见细胞呈圆形、梭形、多边形,细胞核被DAPI染为蓝色(图 1A),目的蛋白Ⅷ因子可见于质核内呈绿色(图 1B、C),证实培养的细胞为人脐静脉内皮细胞。流式结果显示,99.67%的原代细胞CD31表面抗原呈阳性表达(图 2)。
|
图 1 HUVECs免疫细胞化学染色观察 Figure 1 Immunocytochemical staining of HUVECs (Original magnification:×400). A: Cell nuclei are counterstained with DAPI (blue); B: Positive staining for factorⅧ(green); C: FactorⅧseen in the cytoplasm and cell nuclei. |
|
图 2 流式细胞术检测HUVECs CD31表面抗原表达 Figure 2 Expression of CD31 in HUVECs analyzed by flow cytometry. |
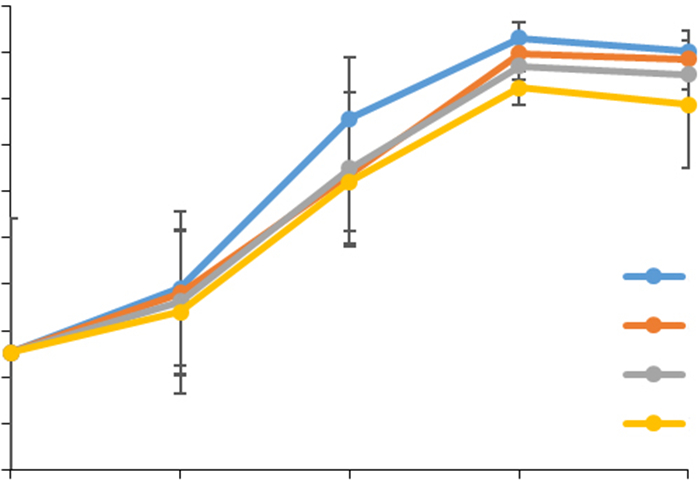
流式细胞术结果显示,血清浓度为0%、0.1%、0.5%、1%时,处理相同的时间,G0/G1期细胞含量无明显差别(图 3)。饥饿0 h,即正常血清浓度(5%)培养的细胞,G0/G1期细胞含量约在60%以下;饥饿6 h,可以获得70%左右的G0/G1期细胞;饥饿时间为12 h,可获得80%~90%的G0/G1期细胞;饥饿时间为18、24 h,可获得95%左右的G0/G1期细胞。统计分析结果显示,饥饿时间相同时,不同血清浓度(0%、0.1%、0.5%、1%)处理间无统计差异(P=0.220)。
|
图 3 不同的血清浓度和饥饿时间对HUVECs G0/G1期的影响 Figure 3 Effects of different serum concentrations and durations of serum starvation on G0/G1 cell percentages in HUVECs. |
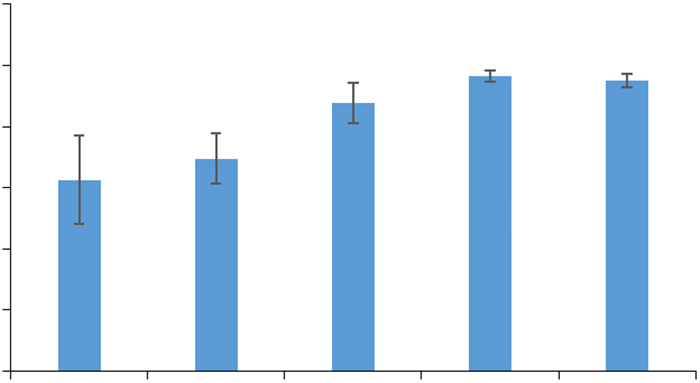
流式细胞术结果显示,血清浓度相同时,饥饿不同的时间,G0/G1期细胞含量不同(图 3)。用完全无血清培养基培养不同时间的G0/G1期细胞含量进行两两比较,结果见图 4。培养0 h与6 h的G0/G1期细胞含量明显差别;培养12、18与24 h的G0/G1期细胞含量无明显差别;而培养12 h(或18 h或24 h)的G0/G1期细胞含量明显高于培养0 h(或6 h)的G0/G1期细胞含量。
|
图 4 无血清培养不同时间对HUVECs G0/G1期的影响 Figure 4 Effects of different durations of serum-free cultivation on G0/G1 phase cells in HUVECs. *P < 0.05, #P < 0.01 vs 0 h group. |
近年来,原代人脐静脉内皮细胞分离培养多采用胰酶消化法。学者们发现,相比于机械刮取法和组织块移植法,采用胰酶灌注消化从新生儿脐静脉获得的内皮细胞纯度高、增殖能力强。而且胰酶灌注消化步骤简单,可总结为“插管固定,洗外洗内,胰酶消化,收集培养”。在操作过程中,稍有困难的地方在于插管的选择。有学者自制空针软管成功收获了纯度极高的HUVECs [9],但我们发现由于软管较粗,插入比较困难,容易滑出,用止血钳固定过紧会造成夹闭。而且采用软管灌注,胶原酶容易从插口溢出,达不到管腔充盈的效果。文献报道也有用针头插入,但针头极易划破静脉内壁,导致细胞不纯。因此本实验将针头剪半、磨钝,再用止血钳固定,可以轻松顺利的灌注胶原酶充盈脐静脉。
文献报道,诸如考察外因对细胞运动、基因或蛋白影响的实验[10-11]要求获得同步生长的细胞群。而目前已有多种方法可以实现[12-14],血清饥饿法是其中最简单有效的方式。血清饥饿对细胞本身的干扰极小,并可在短时间内收获大量的G0/G1期的细胞,而且对细胞进行饥饿处理可以清除血清中可能存在的影响因子,保证了外因的作用效果。由于不同细胞的血清饥饿条件不同,在摸索细胞饥饿条件时,需要综合考虑血清浓度和饥饿时间对细胞的影响。在筛选到合适的血清浓度后,饥饿时间过短,会有一定量的细胞未处于G0/G1期,而发生漏渗,漏出的细胞会进入S期甚至G2-M期[15];而饥饿时间过长又会使细胞因其DNA大量降解而死亡[16]。本实验用内皮细胞专用培养基培养原代HUVECs时,正常条件的血清浓度为5%。血清饥饿时,可以考虑0%~1%的血清浓度,实验分别用0%、0.1%、0.5%、1%血清浓度培养HUVECs相同的时间,发现这4种血清浓度对细胞周期的影响并无统计学差异。因此无血清条件可当作HUVECs的最佳血清饥饿浓度。在考察血清饥饿时间时,发现0%、0.1%、0.5%和1%浓度的血清饥饿HUVECs 18 h以上会出现大量细胞死亡,综合流式细胞术检测细胞周期结果的统计分析考虑,认为完全无血清培养原代HUVECs 12 h即可获得高纯度的G0/G1期细胞,为后续实验研究提供了可靠的实验基础。
| [1] |
Carmeliet P. Angiogenesis in health and disease[J].
Nat Med,2003, 9 (6) : 653-60.
DOI: 10.1038/nm0603-653. ( 0) 0)
|
| [2] |
Shibuya M. VEGF-VEGFR signals in health and disease[J].
Biomol Ther (Seoul),2014, 22 (1) : 1-9.
DOI: 10.4062/biomolther.2013.113. ( 0) 0)
|
| [3] |
Liu X, Wang W, Samarsky D, et al. Tumor-targeted in vivo gene silencing via systemic delivery of cRGD-conjugated siRNA[J].
Nucleic Acids Res,2014, 42 (18) : 11805-17.
DOI: 10.1093/nar/gku831. ( 0) 0)
|
| [4] |
Kendrew J, Eberlein C, Hedberg B, et al. An antibody targeted to VEGFR-2 Ig domains 4-7 inhibits VEGFR-2 activation and VEGFR-2-dependent angiogenesis without affecting ligand binding[J].
Mol Cancer Ther,2011, 10 (5) : 770-83.
DOI: 10.1158/1535-7163.MCT-10-0876. ( 0) 0)
|
| [5] |
Zhao JY, Lin W, Zhuang QC, et al. Bear bile powder inhibits angiogenesis in vivo and in vitro[J].
Chin J Integr Med,2015, 21 (5) : 369-75.
DOI: 10.1007/s11655-015-2062-0. ( 0) 0)
|
| [6] |
Stratman AN, Malotte KM, Mahan RD, et al. Pericyte recruitment during vasculogenic tube assembly stimulates endothelial basement membrane matrix formation[J].
Blood,2009, 114 (24) : 5091-101.
DOI: 10.1182/blood-2009-05-222364. ( 0) 0)
|
| [7] |
Paul JD, Coulombe KL, Toth PT, et al. SLIT3-ROBO4 activation promotes vascular network formation in human engineered tissue and angiogenesis in vivo[J].
J Mol Cell Cardiol,2013, 64 (2) : 124-31.
( 0) 0)
|
| [8] |
宋春娇, 吕冰洁, 张小玲, 等. 血清饥饿法用于细胞周期同步化的方法学研究[J].
中国地方病学杂志,2003, 22 (4) : 362-4.
( 0) 0)
|
| [9] |
蔡维霞, 梁亮, 计鹏, 等. 人脐静脉血管内皮细胞体外培养的方法研究[J].
中国修复重建外科杂志,2011, 25 (2) : 139-43.
( 0) 0)
|
| [10] |
庞宁波, 王立群, 吴剑波. 丙酮醛通过降低整合素β3的表达抑制内皮细胞的迁移[J].
南方医科大学学报,2015, 35 (10) : 1395-9.
( 0) 0)
|
| [11] |
Wang Q, Fan A, Yuan Y, et al. Role of moesin in advanced glycation end Products-Induced angiogenesis of human umbilical vein endothelial cells[J].
Sci Rep,2016, 6 : 22749.
DOI: 10.1038/srep22749. ( 0) 0)
|
| [12] |
Zou X, Wang Y, Cheng Y, et al. Generation of cloned goats (Capra hircus) from transfected foetal fibroblast cells, the effect of donor cell cycle[J].
Mol Reprod Dev,2002, 61 (2) : 164-72.
DOI: 10.1002/(ISSN)1098-2795. ( 0) 0)
|
| [13] |
Hayes O, Ramos B, Rodríguez LL, et al. Cell confluency is as efficient as serum starvation for inducing arrest in the G0/G1 phase of the cell cycle in granulosa and fibroblast cells of cattle[J].
Anim Reprod Sci,2005, 87 (3/4) : 181-92.
( 0) 0)
|
| [14] |
高世勇, 曲笑莹. 细胞周期同步化研究进展[J].
中国药理学通报,2014, 30 (1) : 17-21.
( 0) 0)
|
| [15] |
Cooper S. Reappraisal of serum starvation, the restriction point, G0, and G1 phase arrest points[J].
FASEB J,2003, 17 (3) : 333-40.
DOI: 10.1096/fj.02-0352rev. ( 0) 0)
|
| [16] |
Kues WA, Anger M, Carnwath JW, et al. Cell cycle synchronization of porcine fetal fibroblasts: effects of serum deprivation and reversible cell cycle inhibitors[J].
Biol Reprod,2000, 62 (2) : 412-9.
DOI: 10.1095/biolreprod62.2.412. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
