肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一,严重威胁人类的健康[1]。目前,肝细胞癌的主要治疗方法包括手术切除、介入治疗、射频消融、分子生物靶向治疗以及肝移植等[2-3]。近年来,随着现代医学的不断发展以及肿瘤诊疗技术的不断提高,肝细胞癌患者的总体预后也较过去有所改善,但是,复发和转移仍然是影响肝细胞癌患者治疗效果的一个重要瓶颈[4-5]。循环肿瘤细胞(CTCs)是指自发或因诊疗操作进入外周血中的肿瘤细胞[6]。有研究表明,CTCs与乳腺癌、结直肠癌、非小细胞肺癌等多种肿瘤的转移和复发显著有关,因此研究者提出,准确检测肿瘤患者外周血中CTCs的分布情况对监测肿瘤患者的预后和治疗反应以及治疗方案的选择有重要意义[7-10]。然而截止目前,CTCs在肝细胞癌复发及转移中的作用尚缺乏较全面的研究,本研究通过检测肝细胞癌患者外周血中的CTCs,分析其与肝细胞癌患者临床病理参数以及预后的关系,初步探讨CTCs检测在肝细胞癌临床诊治中的应用价值。
1 资料和方法 1.1 临床资料随机选取2013年7月~2015年1月期间南方医院肝胆外科收治的肝细胞癌患者296例及非肿瘤或肝脏良性肿瘤患者39例,其中,127例患者接受根治性手术治疗,且被术后病理学检查证实为肝细胞癌。肝细胞癌患者的纳入标准为:(1)满足《原发性肝癌诊疗规范2011版》中肝细胞肝癌的临床诊断标准;(2)入院前未接受过任何治疗;(3)未合并患有其他原发肿瘤。所有研究对象均签署知情同意书。
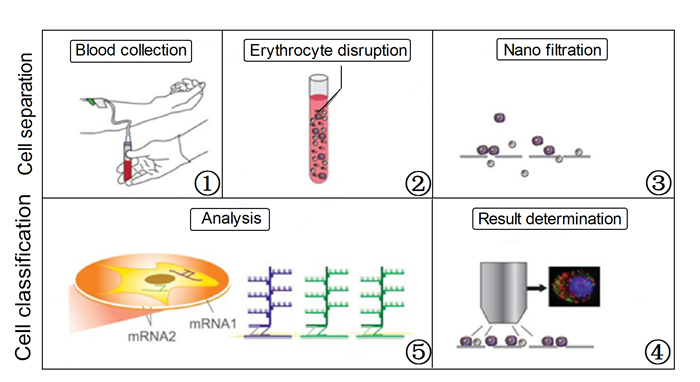
1.2 检测方法本研究采用广州益善公司开发的CanPatrolTM方法检测肝细胞癌患者外周血中的CTCs。其实验原理为:首先裂解外周血中的红细胞,并利用CTCs与白细胞的大小差异通过纳米技术进行CTCs的分离和富集,然后通过多重mRNA原位分析方法对富集的CTCs进行特异性基因核酸定位,从而达到对CTCs进行分型和鉴定的目的,所用到的核酸探针及其序列见表 1 [11],具体步骤如图 1。
| 表 1 核酸探针序列 Table 1 Nucleic acid probe sequence |
|
图 1 CanPatrolTM方法CTCs检测步骤 Figure 1 Process of CTCs detection by CanPatrolTM method. |
使用8号采血针和EDTA抗凝采血管采集10 mL外周血,血样采集后,将EDTA抗凝采血管上下颠倒混匀10次,再经样本采集连通器将血液输入样本保存管内,上下颠倒10次,充分混匀,室温放置30 min。
1.2.2 人外周血CTCs富集将样本保存管内的血液离心,去除上清,再将样本保存管中的液体转移至过滤器中,过滤后用甲醛溶液室温固定60 min。
1.2.3 多重RNA原位分析检测经透化和消化后依次加入探针工作液、预扩增工作液、显色工作液,在样本上加抗淬灭剂(含DAPI)后,再放置5 min于显微镜下直接进行观察。
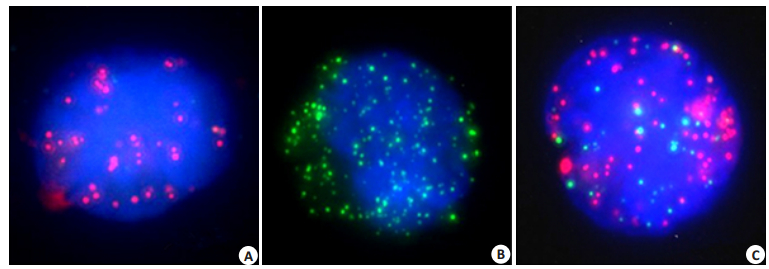
1.3 CTCs阳性判定标准本研究采用多重RNA探针,分别针对多种CTCs特异性基因,通过不同颜色荧光信号将CTCs分型:细胞内CD45(-)、EpCAM(+)和CK8/18/19(+)时,显微镜下可见红色荧光信号,为上皮型CTCs;细胞内CD45(-)、vimentin(+)和twist(+),显微镜下可见绿色荧光信号,为间质性CTCs;细胞内同时显示红色荧光及绿色荧光信号的则为混合型CTCs(图 2)。我们定义:肝细胞癌患者外周血中检测到的CTCs数量≥2个/5 mL为CTCs阳性,而CTCs数量< 2个/5 mL为CTCs阴性。
|
图 2 荧光显微镜下CTCs分型 Figure 2 Classification of CTCs under fluorescent microscope. A: Mesenchymal CTCs; B: Epithelial CTCs; C: Hybrid CTCs. |
我们对127例接受根治性手术治疗的肝细胞癌患者进行电话或门诊随访,随访内容:肝功能、血常规、AFP动态监测、腹部彩超、CT或MRI,必要时行PET-CT检查等。我们定义肝细胞癌患者术后复发的标准为:(1)术后AFP下降至正常又升高或术前阴性术后升高的病人,其血清AFP持续进行性升高≥400μg/L超过1个月或持续升高≥200μg/L超过2个月,排除活动性肝炎或妊娠、生殖系统肿瘤的患者;(2)影像学检查提示肝内出现实性占位性病变,具有典型肝细胞肝癌影像学表现的患者。随访终止时间为2016年1月。
1.5 统计方法数据统计采用SPSS21.0统计软件进行分析;CTCs与肝细胞癌患者临床病理参数之间的关系采用χ2检验。所有结果表述包括均数±标准误,统计量值和具体P值;所有检验方法均采用双侧检验,检验水准α=0.05。
2 结果 2.1 CTCs检测结果在对照组39例患者的外周血中均未检测到CTCs,而在肝细胞癌组296例患者中,191例患者外周血中检测到CTCs,两组之间CTCs阳性率具有显著性差异(P < 0.05,表 2)。在外周血CTCs阳性肝细胞癌中,CTCs数量分布于0~76/5 mL之间,中位数为14/5 mL。
| 表 2 CTCs在肝细胞癌组及对照组患者中阳性率差异的比较 Table 2 Comparison of CTCs positive rate between the HCC and control groups |
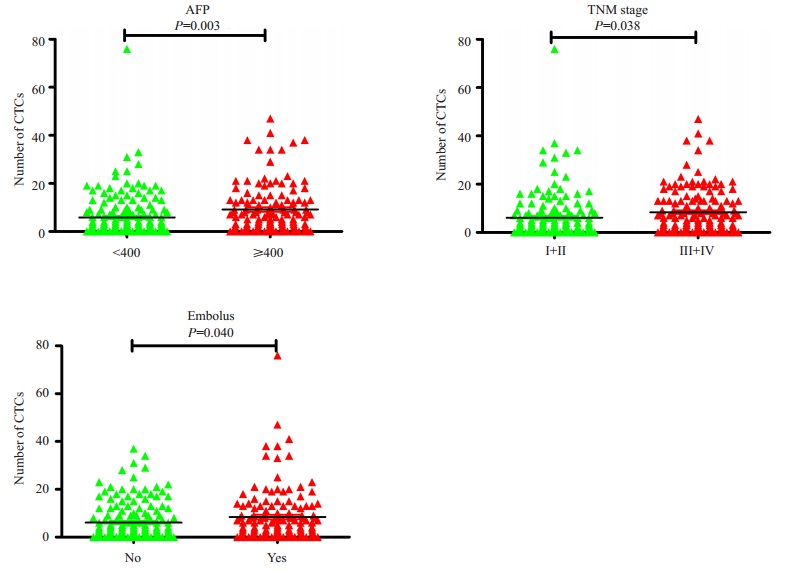
经统计分析,在296例肝细胞癌患者中,外周血中CTCs阳性与患者血清甲胎蛋白水平、肿瘤数量、TNM分期、BCLC分期、门静脉癌栓及转移等显著相关(P < 0.05,表 3);logistic回归分析表明,血清甲胎蛋白水平大于400μg/L、多发肿瘤以及影像学检查提示有门静脉癌栓的肝细胞癌患者外周血中CTCs的阳性率显著升高(P < 0.05,表 3);且在血清甲胎蛋白水平大于400μg/L,伴有门静脉癌栓的晚期肝细胞癌患者的外周血中检测到的CTCs数目显著增高(P < 0.05,图 3)。
| 表 3 肝细胞癌患者外周血中CTCs与临床病理参数的关系 Table 3 Relationship between circulating tumor cells (CTCs) in peripheral blood and clinicopathological factors in HCC patients |
|
图 3 细胞癌患者夕卜周血中CTCs数目与AFP、TNM分期及门静脉癌栓的关系 Figure 3 Correlation of CTC number in peripheral blood with AFP level, TNM stage and embolus in the portal |
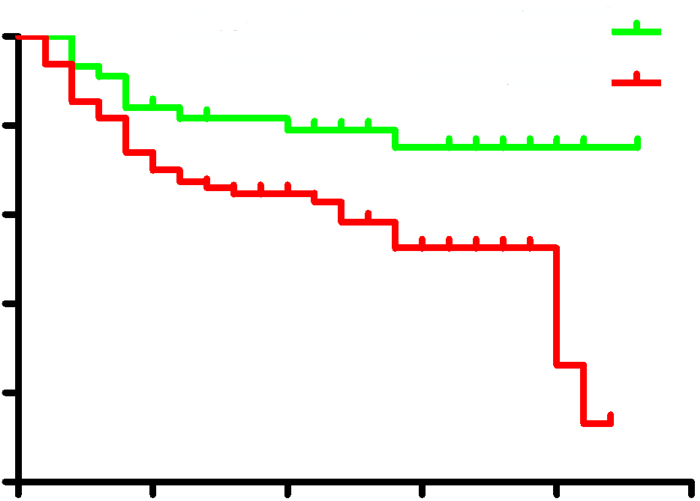
我们后续对127例接受根治性手术治疗的肝细胞癌患者术后无瘤生存时间进行Kaplan-Meier生存分析,结果显示:外周血中CTCs阳性的肝细胞癌患者术后无瘤生存时间(18.8月)显著长于CTCs阴性的患者(13.7月)(P < 0.05,图 4)。
|
图 4 肝细胞癌患者CTCs阳性组与CTCs阴性组无瘤生存期的比较 Figure 4 Survival analysis in relation to CTCs positivity in HCC patients. |
1896年,澳大利亚学者Ashworth从一例转移性肿瘤患者血液中发现有一种血细胞与肿瘤细胞极为相似,并率先提出CTCs概念[12]。越来越多的研究表明:CTCs肿瘤患者外周血中的检测对肿瘤早期诊断、预后评估以及个体化治疗具有重要意义[13]。目前,CTCs的检测方法有很多种,如CellSearch System、ELISPOT(酶联免疫斑点技术)、CTC芯片技术、FAST(光导纤维阵列扫描)、LSC(激光扫描细胞计量技术)及qRT-PCR等,其中最具代表的是经美国食品和药品管理局批准并用于临床的CellSearch系统。CellSearch系统主要是基于EpCAM来富集CTCs [14-17]。从理论上来讲CellSearch系统适用于所有上皮源性恶性肿瘤的CTCs检测,但实际上CellSearch系统并不适用于肝细胞肝癌CTCs的检测,因为肝细胞癌的上皮细胞标志物EpCAM的表达水平较低。CanPatrolTM系统是目前唯一可以同步实现CTCs形态分型、细胞分型和分子分型的先进检测技术,该系统主要通过纳米过滤技术来富集CTCs,而不需要依赖特异生物标志物(如EpCAM),从而可以减少肝细胞癌患者CTCs的丢失,具有高灵敏度、高特异性、可重复性等优点[11]。在本研究中,我们发现在64.5%的肝细胞癌患者的外周血中检测到CTCs的存在,CTCs数量分布于0~76/5 mL之间,中位数为14/5 mL;而在对照组患者外周血中并未检测到CTCs的存在,这说明CanPatrolTM系统在肝细胞癌患者外周血中CTCs的检测中具有较好的敏感性和特异性。
目前认为,肿瘤转移的过程是由一系列的生物学过程导致的,其中最主要的过程为肿瘤细胞从瘤体脱落、进入血液,然后到远处转移[18]。进一步统计分析表明,肝细胞癌患者外周血中CTCs阳性与患者血清甲胎蛋白水平、肿瘤数量、TNM分期、BCLC分期、门静脉癌栓及转移等显著相关,且在血清甲胎蛋白水平大于400μg/L和伴有门静脉癌栓的晚期肝细胞癌患者的外周血中检测到的CTCs数目也显著增高;此外,在127例接受根治性手术治疗的肝细胞癌患者中,外周血CTCs阳性的肝细胞癌患者术后无瘤生存时间显著缩短;以上结果说明肝细胞癌患者外周血CTCs阳性提示预后不良。目前,肝细胞癌的临床分期常采用BCLC分期和TNM分期,但这两种分期标准在临床应用上均有其局限性,如BCLC分期主要依据肿瘤大小、肿瘤数量和肝功能进行评估,但在我们的研究中我们发现,即使是BCLC分期为A期或TNM分期为I期的部分患者,在手术后依然出现了早期复发的现象,说明在肿瘤体积较小时就可能已经存在目前影像学无法检测的微转移灶。可想而知,此时的分期结果将不能准确地反映出肿瘤的进展程度,得出的分期结果往往与当时肿瘤的真实情况相差甚远,致使临床医生对肿瘤状况的误判而贻误治疗时机[19-21]。或许,我们应该对BCLC分期和TNM分期进行优化,同时把CTCs检测作为肝细胞癌临床分期的另一个指标,进而提高对肿瘤转移复发能力的预测水平。当然,本研究中由于样本有限,要明确CTCs在肝细胞癌远处转移病灶形成中起重要作用,仍需扩大样本量进一步验证。
综上所述,通过本研究我们发现,肝细胞癌患者外周血中CTCs阳性是患者预后的一个危险因素;外周血CTCs阳性提示肝细胞癌患者预后不良。因此我们认为,肝细胞癌患者外周血CTCs检测可以成为监测肝细胞癌患者预后一个较好的辅助指标。
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J].
CA Cancer J Clin,2016, 66 (2) : 115-32.
DOI: 10.3322/caac.21338. ( 0) 0)
|
| [2] |
Colombo M, Sangiovanni A. Treatment of hepatocellular carcinoma: beyond international guidelines[J].
Liver Int,2015, 35 (suppl 1) : 129-38.
( 0) 0)
|
| [3] |
Gao JJ, Shi ZY, Xia JF, et al. Sorafenib-based combined molecule targeting in treatment of hepatocellular carcinoma[J].
World J Gastroenterol,2015, 21 (42) : 12059-70.
DOI: 10.3748/wjg.v21.i42.12059. ( 0) 0)
|
| [4] |
Llovet JM, Fuster J, Bruix J. Prognosis of hepatocellular carcinoma[J].
Hepatogastroenterology,2002, 49 (43) : 7-11.
( 0) 0)
|
| [5] |
Lacaze L, Scotté M. Surgical treatment of intra hepatic recurrence of hepatocellular carcinoma[J].
World J Hepatol,2015, 7 (13) : 1755-60.
DOI: 10.4254/wjh.v7.i13.1755. ( 0) 0)
|
| [6] |
Pantel K, Speicher MR. The biology of circulating tumor cells[J].
Oncogene,2016, 35 (10) : 1216-24.
DOI: 10.1038/onc.2015.192. ( 0) 0)
|
| [7] |
Masuda T, Hayashi N, Iguchi T, et al. Clinical and biological significance of circulating tumor cells in cancer[J].
Mol Oncol,2016, 10 (3) : 408-17.
DOI: 10.1016/j.molonc.2016.01.010. ( 0) 0)
|
| [8] |
Barbazan J, Dunkel Y, Li H, et al. Prognostic impact of modulators of G proteins in circulating tumor cells from patients with metastatic colorectal cancer[J].
Sci Rep,2016, 6 (6) : 22112-8.
( 0) 0)
|
| [9] |
Bayarri-Lara C, Ortega FG, Cueto Ladrón de Guevara A, et al. Circulating tumor cells identify early recurrence in patients with non-small cell lung cancer undergoing radical resection[J].
PLoS One,2016, 11 (2) : e0148659-63.
DOI: 10.1371/journal.pone.0148659. ( 0) 0)
|
| [10] |
Bidard FC, Proudhon C, Pierga JY. Circulating tumor cells in breast cancer[J].
Mol Oncol,2016, 10 (3) : 418-30.
DOI: 10.1016/j.molonc.2016.01.001. ( 0) 0)
|
| [11] |
Wu S, Liu S, Liu Z, et al. Classification of circulating tumor cells by epithelial-mesenchymal transition markers[J].
PLoS One,2015, 10 (4) : e0123976-81.
DOI: 10.1371/journal.pone.0123976. ( 0) 0)
|
| [12] |
Ashworth T. A case of cancer in which cells similar to those in the tumours were seen in the blood after death[J].
Austral Med J,1869, 20 (14) : 146-7.
( 0) 0)
|
| [13] |
de Wit S, van DG. Detection of circulating tumor cells[J].
Scientifica (Cairo),2014, 45 (7) : 819362-73.
( 0) 0)
|
| [14] |
Hong B, Zu Y. Detecting circulating tumor cells: current challenges and new trends[J].
Theranostics,2013, 3 (6) : 377-94.
DOI: 10.7150/thno.5195. ( 0) 0)
|
| [15] |
Lu J, Fan T, Zhao Q, et al. Isolation of circulating epithelial and tumor progenitor cells with an invasive phenotype from breast cancer patients[J].
Int J Cancer,2010, 126 (3) : 669-83.
DOI: 10.1002/ijc.v126:3. ( 0) 0)
|
| [16] |
Zhang Y, Shi ZL, Yang X, et al. Targeting of circulating hepatocellular carcinoma cells to prevent postoperative recurrence and metastasis[J].
World J Gastroenterol,2014, 20 (1) : 142-7.
DOI: 10.3748/wjg.v20.i1.142. ( 0) 0)
|
| [17] |
Shariff MI, Cox IJ, Gomaa AI, et al. Hepatocellular carcinoma: current trends in worldwide epidemiology, risk factors, diagnosis and therapeutics[J].
Expert Rev Gastroenterol Hepatol,2009, 3 (4) : 353-67.
DOI: 10.1586/egh.09.35. ( 0) 0)
|
| [18] |
Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges[J].
Nat Med,2006, 12 (8) : 895-904.
DOI: 10.1038/nm1469. ( 0) 0)
|
| [19] |
Matsusaka S, Chìn K, Ogura M, et al. Circulating tumor cells as a surrogate marker for determining response to chemotherapy in patients with advanced gastric cancer[J].
Cancer Sci,2010, 101 (4) : 1067-71.
DOI: 10.1111/j.1349-7006.2010.01492.x. ( 0) 0)
|
| [20] |
Yokobori T, Iinuma H, Shimamura T, et al. Plastin3 is a novel marker for circulating tumor cells undergoing the epithelialmesenchymal transition and is associated with colorectal cancer prognosis[J].
Cancer Res,2013, 73 (7) : 2059-69.
DOI: 10.1158/0008-5472.CAN-12-0326. ( 0) 0)
|
| [21] |
Liu MC, Shields PG, Warren RD, et al. Circulating tumor cells: a useful predictor of treatment efficacy in metastatic breast cancer[J].
J Clin Oncol,2009, 27 (31) : 5153-9.
DOI: 10.1200/JCO.2008.20.6664. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
