室性早搏(简称室早)是临床上最常见的心律失常[1-3],其中发生于无结构器质性心脏病患者,并排除了其他诱因所引起的室性早搏被称为特发性室性早搏,起源于主动脉窦内的特发性室性早搏比较常见,其发生率仅次于右室流出道[4-6],占特发性流出道室性早搏的17%~21%,随着导管技术的日益成熟,对于症状明显,并且药物治疗效果不佳或者不能耐受药物治疗的特发性主动脉窦内室性早搏,导管射频消融是一种安全、高效的方法。目前室早的射频消融术常规应用普通二维标测方法,需要在X线透视指导下完成消融手术的操作,但X线对患者和医护人员均有可能产生放射性的损伤[7-8],主动脉窦位于心底部中心位置,根据冠状动脉的起源部位,将主动脉窦分为左冠窦、右冠窦和无冠窦。冠状动脉左右主干开口于左右冠窦内,常规在X线指导下标测消融特发性主动脉窦内室性早搏时有一定的风险性,由于传统在X线指导下仅能提供心脏的二维结构,缺乏心脏的三维立体感,使得消融导管定位很困难,需持续在X线透视下观察消融大头与左右主干的距离,使X线曝光时间长。CARTO三维标测系统可实时显示消融导管在心腔内的具体位置,指导消融导管的移动方向。并可直观的显示需要消融的关键部位,Carto系统使得消融导管具有标测定位记忆功能,当消融导管偏离理想位置时,Carto系统可使消融导管再重新回顾至最佳消融靶点。从而减少总放电次数且不增加手术总时间。Carto3系统可立体直观地展示心脏及主动脉的三维结构,并标示出左右主干开口及消融大头位置,有利于提高手术成功率,增加手术安全性。因此在Carto3指导下行主动脉窦室早消融可大幅度降低X线照射甚至手术全程零射线;近年国外许多研究已经报导过零射线下射频消融阵发性室上速的可行性、有效性、安全性[9-11],而国内外尚未报道零射线下主动脉窦内室早射频消融,本文旨在探讨Carto3系统指导下零射线射频消融治疗源于主脉窦内特发性室早的可行性、安全性及有效性。
1 对象和方法 1.1 研究对象入选2013年4月~2015年10月于南方医院因特发性主动脉窦内室早(ASC-PVCs)行射频消融(RFCA)治疗的患者52例,根据标测消融过程中是否需要X线曝光将患者分为常规方法消融组29例(常规组),男12例、女17例,年龄45.9±10.8岁;Carto系统指导下零射线标测消融组23例(零射线组),男9例、女14例,年龄44.5±6.7岁。其中零射线组中包括3例常规消融治疗复发再消融的患者。患者术前均检查心电图、24 h动态心电图、心脏彩超等检查。病例入选标准:心电图、胸片、超声心动图等常规检查均未发现器质性心脏病,必要时行冠状动脉造影检查,排除冠心病;24 h动态心电图室早负荷≥10%。对多种抗心律失常药物无明显疗效或不能耐受长期药物治疗;室早体表心电图特点符合主动脉窦内起源:Ⅱ、Ⅲ、aVF导联呈高幅R波,胸导联QRS波呈右束支阻滞形态。排除标准:成功消融靶点并非位于主动脉窦内者。
1.2 方法 1.2.1 准备工作手术在签署知情同意书并停用抗心律失常药物至少5个半衰期后进行。所有患者起源点均经电生理检查确认。52例患者经电生理检查均起源于主动脉窦内。
1.2.2 常规在X线指导下标测消融所有患者消融前行冠状动脉造影明确靶点与冠状动脉的位置关系,防止损伤冠状动脉。并行主动脉脉根部造影,确定左、右冠窦及无冠窦的位置关系,射频消融术前如果室早频繁、持续出现,则移动消融导管寻找靶点;如果无室早, 则需要静脉滴注异丙肾上腺素,直至可监测到恒定的自发室早。在监测到恒定的频发室性早搏时行射频消融治疗。根据体表心电图室早形态大致判定室性心律失常的起源部位。将消融电极经股动脉送入主动脉窦内。标测采用激动顺序标测与起搏标测的方法。激动标测是根据消融大头记录到的局部电位与早搏QRS波起始之间的时间关系,逐点标测,直至寻找到最早的心室激动点。有效靶点的局部电位至少领先自发室早QRS波起始点20 ms以上,且单极导联呈Qs型。然后在最早的心室激动点行起搏标测,以起搏与自然发作的室早12导联心电图QRS波形态至少有11个导联心电图图形完全相同的部位作为消融靶点。预置能量30 W,温度设定为55℃,试放电10 s。放电后出现同形早搏先增多后消失或放电后出现短阵同形室速为消融有效标志,早搏完全消失后再持续消融60~90 s,在紧邻靶点周围补充消融3~5点。1.2.3 CARTO3指导下零射线标测消融Carto3系统是三维的电解剖标测系统,可以实时直视及定位任何电极导管在心脏、血管腔内的移动,能避免在X线透视指导下操作消融导管到心腔内相应的位置。零射线组患者从穿刺或推送电极导管到位并建立心脏三维解剖模型、射频消融过程均在无射线下完成。射频消融术的整个过程,医生与护士、患者都没穿铅衣铅脖等保护装置。根据患者自发室早的起源部位,常规穿刺右股脉,留置7F鞘管, 置入消融导管.然后用消融大头构建主动脉窦(图 1),可在后前位构建无冠窦时(消融导管往下送至NCC,大头电位只见可见大A波),在右侧位下构建右冠窦(大头电位只见可见大V波),在左侧位下构建左冠窦(大头电位可见A、V波)。并可确定左右冠脉开口,以窦性心律时体表Ⅱ导联中R波振幅最高处为采样时间0点,并标记参考标测点。Carto系统在室性期前收缩发作时可开启自动冻(Auto-Freeze)功能,自动冻结室早发作时最早激动点作为消融靶点(图 2),然后在该处行起搏标测方法来验证消融靶点的可靠性,最后确定消融导管的贴靠程度,及消融靶点的电生理特征,它们均稳定后可放电消融。消融的温度和能量设置为30 W及55℃。在最佳靶点试放电10 s,放电后如果自发早搏消失或出现短阵同形室,则连续放电达60~90 s。
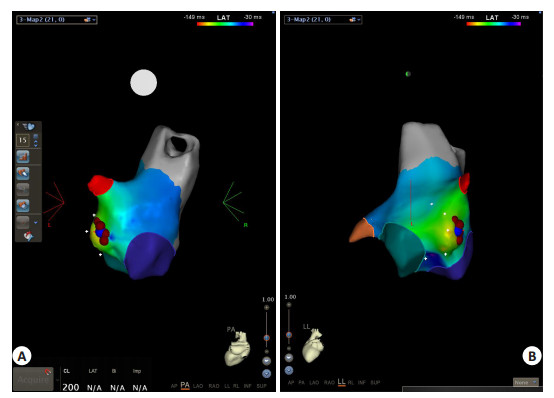
|
图 1 1例起源于左冠窦室性早搏在消融过程中的Carto三维解剖图 Figure 1 A case of PVCs originating from the left coronary cusp. A: CARTO electroanatomic map (posteranterior view) of the left coronary cusp (LCC) displaying the endocardial activation sequence during PVCs originating from the LCC. Blue indicates the area with the earliest endocardial activation, which was observed in the left coronary cusp. The red points indicate the successful ablation sites (and the number of radiofrequency applications); B: CARTO electroanatomic map (left lateral view) of the left coronary cusp. |
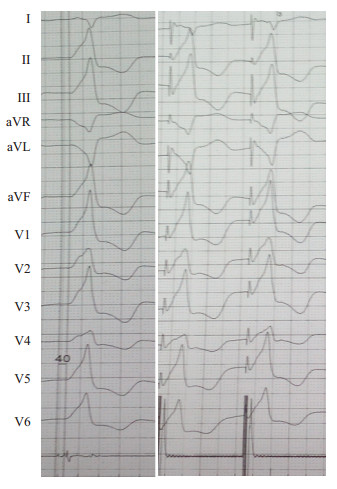
|
图 2 Carto系统标测的靶点验证图 Figure 2 Twelve-lead electrocardiograms of PVCs originating from the LCC. A: LCC-PVCs eliminated by a radiofrequency application at the ablation site where the local activation preceded the QRS onset of PVC by 40 ms; B: A perfect pace map was achieved. |
以消融后室性早搏消失,且静脉滴注异丙肾上腺素30 min后室性早搏不再出现为即刻成功标志;(2)远期成功标准:术后3个月行24 h行动态心电图检查,室性早搏消失或总数较术前减少80%以上,不适症状明显改善。
1.4 术后随访术后l、3、6个月门诊随访,随后隔半年随访;症状再发随诊。通过症状、心电图、24 h Hoher判断是否复发,在未服任何抗心律失常药物下心律失常相关症状消失、心电图无主动脉窦起源的室早、术后3个月24 h Hoher室早数较术前减少80%以上作为消融成功的随访标准。
1.5 统计学方法应用SPSS20.0统计软件,计量资料以均数±标准差表示,两组间比较采用t检验,计数资料采用χ2校验,P < 0.05为差异有统计学意义。
2 结果 2.1 基本资料比较本研究共纳入52例特发性主动脉窦内室早(ASC-PVCs)并行导管射频消融治疗的患者,其中常规组29例,零射线组23例,两组患者临床基线资料(术前)的比较(表 1),两组患者的年龄、性别、室早负荷及室早起源部位差异均无统计学意义。
| 表 1 两组患者临床基线资料(术前)的比较 Table 1 Baseline and electrophysiological characteristics for patients in the conventional and zero-fluoroscopy groups |
| 表 2 两组患者手术过程中及手术后变量的比较 Table 2 Comparison of procedural variables between the conventional and zero-fluoroscopy groups |
两组患者手术即时成功率差异无统计学意义(96% vs 83%,P=0.21);两组患者术中均无并发症发生。与常规组相比,零射线组靶点标测时间明显缩短(4.3±1.7 vs 7.8±2.6 min,P < 0.01),零射线组与常规组手术总时间差异无统计学意义(79.6±8.8 vs 77.4±7.2 min,P=0.332)。与零射线组比较,常规消融组放电次数明显较多(7.9±3.2 vs 4.8±1.1,P < 0.01),零射线组整个手术过程完全零射线,而常规组X线曝光时间为23.1±6 min,随访5~20月,常规消融组复发4例,CARTO3零射线消融组1例复发。
3 讨论射频消融是治疗ASC-PVCs的标准治疗方法,但传统的心律失常射频消融(RFCA)必须在X射线透视下进行,而X线电离辐射危害直接关系到医护人员、患者的安全。现有的证据支持致癌风险与X线曝光量的关系是一个线性且无阈值的关系[12]。研究报道在射频消融过程中,X线曝光时间累计60 min以上,致命恶性肿瘤的发生率约为0.03%~0.23% [13-14]。近几年来, 射频消融过程中“X线电离辐射问题”引起了广泛关注“;近来Carto3的日益改进与推广。使无X射线曝光下操作射频消融术成为可能。近年国外许多研究已经报导过零射线下射频消融阵发性室上速的可行性、有效性、安全性,甚至零射线下行起搏器植入术[15],但国内外尚未报道过关于零射线下消融频发室早的研究。因此我们对零射线下消融主动脉窦内起源的室早时进行了相关研究。
主动脉窦解剖复杂,且与冠状动脉等重要解剖结构相邻,因此,主动脉窦内起源室早消融难度较高,导管的小范围移动可能会使消融导管进入冠状动脉开口处,导管消融放电有损伤冠状动脉的风险。因此传统在X线消融主动脉窦起源的室早,必须先行主动脉根部造影及冠脉造影,明确左右冠脉开口,且放电时需持续在X线透视下观察消融大头与左右主干开口的距离,因此患者及医护人员将会受到较大剂量的X线曝光,Carto3系统可立体直观地展示心脏及主动脉的三维结构,并可确定左右冠脉开口,直观得显示消融大头与左右冠脉开口的距离,有利于增加手术的安全性,提高手术成功率,并且不需要X线的曝光,本研究发现所有患者手术过程均未发生手术并发症。在本研究中零射线组所有室早患者的消融过程在均在无射线下完成。而常规消融组的平均X线暴光时间为23.1±6 min。
Fernandez等[16]对在6年内340例因心律失常并三维指导下零射线射频消融的患者进行了相关分析,其中153例为典型房扑,146例为房室结折返性心动过速,35例为房室折返性心动过速。2例为局灶房速;4例为非典型房扑。其中337例成功进行了消融治疗(成功率为99.1%),322位患者(94.7%)完全避免了X线的接触,达到了“零射线曝光”,其中平均手术时间为110.5±51.8 min。但在该研究中并未纳入室性心律失常的患者,我们的研究发现零射线组平均手术时间为79.6±8.8 min,与常规组相比无统计学差异,尽管主动脉窦的建模需要消耗一定的时间,但Carto系统重构主动脉窦后,在标测消融定早过程中需要多角度观察,从而清楚暴露需要关键标测消融的区域。而且CARTO系统具有标测定位记忆功能,对每次放电消融部位均可作准确的标识,准确地定位和区别有效的消融靶点及无效的消融靶点,从而抵消了建模所多消耗的时间,并不延长手术时间。
Yamada [17]将134例右室流出道室早患者随机分为三维标测组及常规标测组,并发现相对于常规组,三维标测组可以减少放电次数及缩短手术总时间,大大缩短了X线的曝光时间,但该研究三维标测组并不是零射线。我们的研究同样发现对于主动脉窦内室早的消融,Carto指导下零射组明显优于常规组。它的优势除了医生及患者完全避免了X线的暴露;本研究还发现相对于常规组,它还可以缩短靶点测时间及放电时间,减少总放电次数且无效放电少,且不增加手术总时间。这是因为Carto系统使消融导管拥有记忆功能及复位功能,以及可以直观显示消融导管在心室流出道的微移动,从而可在Carto3指导下可观察分析瞬间的导管微移与局部腔内电位的关系,因而能更加准确地确定消融靶点。当不易准确定位消融靶点的位置时,可以通过全程记录消融导管移动时相关标测的点及相应的电位变化,再回顾确定最佳消融靶点。从而减少总放电次数及标测靶点时间,另外Carto3系统的自动冻结(Auto-Freeze)功能对标测目标室早是相当有用的,标测过程中它可以忽略目标以外的PVC,有益于发现PVC的最早激动点,从而减少了标测时间。
CARTO3指导下零射线导管射频消融治疗特发性主动脉窦内频发室性早搏是一种安全、有效、可行的方法。CARTO3指导零射线射频消融相对常规消融方法,其靶点标测时间缩短、总放电次数减少且不延长手术总时间,且手术全过程为零射线。
| [1] |
Takemoto M, Yoshimura H, Ohba Y, et al. Radiofrequency catheter ablation of premature ventricular complexes from right ventricular outflow tract improves left ventricular dilation and clinical status in patients without structural heart disease[J].
J Am Coll Cardiol,2005, 45 (8) : 1259-65.
DOI: 10.1016/j.jacc.2004.12.073. ( 0) 0)
|
| [2] |
Wang K, Hodges M. The premature ventricular complex as a diagnostic aid[J].
Ann Intern Med,1992, 117 (9) : 766-70.
DOI: 10.7326/0003-4819-117-9-766. ( 0) 0)
|
| [3] |
Ling Z, Liu Z, Su L, et al. Radiofrequency ablation versus antiarrhythmic medication for treatment of ventricular premature beats from the right ventricular outflow tract: prospective randomized study[J].
Circ Arrhythm Electrophysiol,2014, 7 (2) : 237-43.
DOI: 10.1161/CIRCEP.113.000805. ( 0) 0)
|
| [4] |
Valk SD, De Groot NM, Szili-Torok T, et al. Clinical characteristics and acute results of catheter ablation for outflow tract ventricular tachycardia or premature beats[J].
J Interv Card Electrophysiol,2012, 35 (3) : 301-9.
DOI: 10.1007/s10840-012-9706-1. ( 0) 0)
|
| [5] |
Lerman BB. Mechanism, diagnosis, and treatment of outflow tract tachycardia[J].
Nat Rev Cardiol,2015, 12 (10) : 597-608.
DOI: 10.1038/nrcardio.2015.121. ( 0) 0)
|
| [6] |
Yamada T, Mcelderry HT, Doppalapudi H, et al. Idiopathic ventricular arrhythmias originating from the aortic root prevalence, electrocardiographic and electrophysiologic characteristics, and results of radiofrequency catheter ablation[J].
J Am Coll Cardiol,2008, 52 (2) : 139-47.
DOI: 10.1016/j.jacc.2008.03.040. ( 0) 0)
|
| [7] |
Theocharopoulos N, Damilakis J, Perisinakis K, et al. Occupational exposure in the electrophysiology laboratory: quantifying and minimizing radiation burden[J].
Br J Radiol,2006, 79 (944) : 644-51.
DOI: 10.1259/bjr/76128583. ( 0) 0)
|
| [8] |
Clay MA, Campbell RM, Strieper M, et al. Long-term risk of fatal malignancy following pediatric radiofrequency ablation[J].
Am J Cardiol,2008, 102 (7) : 913-5.
DOI: 10.1016/j.amjcard.2008.05.033. ( 0) 0)
|
| [9] |
Alvarez M, Tercedor L, Almansa I, et al. Safety and feasibility of catheter ablation for atrioventricular nodal re-entrant tachycardia without fluoroscopic guidance[J].
Heart Rhythm,2009, 6 (12) : 1714-20.
DOI: 10.1016/j.hrthm.2009.08.037. ( 0) 0)
|
| [10] |
Seizer P, Bucher V, Frische C, et al. Efficacy and safety of zero-fluoroscopy ablation for supraventricular tachycardias: Use of optional contact force measurement for zero-fluoroscopy ablation in a clinical routine setting[J].
Herz,2016, 41 (3) : 241-5.
DOI: 10.1007/s00059-015-4358-4. ( 0) 0)
|
| [11] |
Ma Y, Qiu J, Yang Y, et al. Catheter ablation of Right-Sided accessory pathways in adults using the three-dimensional mapping system: a randomized comparison to the conventional approach[J].
PLoS One,2015, 10 (6) : e0128760.
DOI: 10.1371/journal.pone.0128760. ( 0) 0)
|
| [12] |
Editors National Research Council (US) Committee on Health Effects of Exposure to Low Levels of Ionizing Radiations (BEIRVⅡ). Health Effects of Exposure to Low Levels of Lonizing Radiations: Time for Reassessment[B]. Source Washington (DC): National Academies Press (US); 1998.
( 0) 0)
|
| [13] |
Perisinakis K, Damilakis J, Theocharopoulos N, et al. Accurate assessment of patient effective radiation dose and associated detriment risk from radiofrequency catheter ablation procedures[J].
Circulation,2001, 104 (1) : 58-62.
DOI: 10.1161/hc2601.091710. ( 0) 0)
|
| [14] |
Kerst G, Weig HJ, Weretka S, et al. Contact force-controlled zero-fluoroscopy catheter ablation of right-sided and left atrial arrhythmia substrates[J].
Heart Rhythm,2012, 9 (5) : 709-14.
DOI: 10.1016/j.hrthm.2011.12.025. ( 0) 0)
|
| [15] |
Colella A, Giaccardi M, Colella T, et al. Zero x-ray cardiac resynchronization therapy device implantation guided by a nonfluoroscopic mapping system: A pilot study[J].
Heart Rhythm,2016, 13 (7) : 1481-8.
DOI: 10.1016/j.hrthm.2016.03.021. ( 0) 0)
|
| [16] |
Fernández-Gómez JM, Moriña-Vázquez P, Morales Edel R, et al. Exclusion of fluoroscopy use in catheter ablation procedures: six years of experience at a single center[J].
J Cardiovasc Electrophysiol,2014, 25 (6) : 638-44.
DOI: 10.1111/jce.2014.25.issue-6. ( 0) 0)
|
| [17] |
Yamada T, Murakami Y, Yoshida N, et al. Efficacy of electroanatomic mapping in the catheter ablation of premature ventricular contractions originating from the right ventricular outflow tract[J].
J Interv Card Electrophysiol,2007, 19 (3) : 187-94.
DOI: 10.1007/s10840-007-9160-7. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
