2. 广州中医药大学, 广东 广州 510405 ;
3. 南方医科大学珠江医院神经外科, 广东 广州 510280
2. Guangzhou University of Traditional Chinese Medicine, Guangzhou 510405, China ;
3. Department of Neurosurgery, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
创伤性颅脑外伤(TBI)的发病率居创伤的首位,据统计,全球每年约有1000多万人遭受各种类型和不同程度的颅脑损伤[1],流行病学调查表明,儿童和青少年TBI后致残率>20% [2]。有关颅脑损伤后的继发性损伤与修复机制非常复杂,由于损伤局部恶劣的微环境,使得成熟中枢神经系统(CNS)轴突再生非常困难[3],到目前为止,仍然没有一种有效的方法可以很好的防止TBI导致的各种长远期并发症,或者加速患者功能的康复[4]。
神经干细胞(NSCs)在机体中具有重要作用,能够对颅脑损伤后脑组织中受到损害的神经元进行补充,对患者脑组织中受损的部分环路及功能进行重建[5],达到修复神经损伤的目的。现代研究已证实,NSCs存在于成熟中枢神经系统的多个区域[6],主要有脑室下区(SVZ)和海马的颗粒层下区(SGZ)的齿状回,特别是SVZ是NSCs增殖的一个重要地方,它能够产生瞬时增殖细胞,然后生成神经细胞和胶质细胞,这有助于神经细胞自我更新和对受伤做出反应[7]。但由于伦理学及技术方面的问题,目前NSCs移植治疗TBI尚难运用于临床。因此,对于内源性NSCs增殖、分化及修复受损组织的机制研究是解决NSCs来源的关键问题,是干细胞技术由实验走向临床必须解决的重要课题[8]。
本实验拟通过Feeney's自由落体法建立大鼠颅脑损伤模型[9],采用免疫组织化学及免疫荧光化学等技术方法,检测TBI后伤侧SVZ内源性NSCs的增殖、分化情况,研究TBI后内源性NSCs原位增殖、分化、迁移的变化及规律,为TBI后调动诱导自体NSCs参与颅脑组织、功能修复的临床应用提供可借鉴的实验依据。
1 材料和方法 1.1 实验分组SD大鼠鼠龄2~3个月,体质量约200 g。共48只,采用随机数字表法分为3个组,分别为假手术组、对照组和实验组。其中8只为假手术组仅切开头皮和颅骨开窗,不致脑损伤;8只为对照组不做任何处理;实验组又依据损伤后时间不同分为4个组,分别为1、3、7、14 d组;每组8只大鼠。
1.2 模型制备将大鼠以10%水合氯醛、依0.4 mL/100 g体质量行腹腔内注射麻醉,其头部被固定于立体定向仪上,常规手术开颅骨窗(直径5 mm)后,在硬膜保持完整的情况下、用20 g砝码于30 cm高处通过一金属导杆坠落(使致伤冲击力为600 g·cm),以通过该冲击力撞击置于硬膜上的圆锥、造成颅脑的损伤。伤后1 h参照Wayne Clark [10]方法,进行神经行为学观察及评分,该方法大鼠颅脑损伤轻、中、重型的神经行为学评分依次分别为6分、12分和18分。选用其中的中型损伤作为研究模型。
1.3 组织标本一般形态学检测取不同分组(对照组、假手术组、实验组)、不同时间点(脑损伤模型后1、3、7、14 d)SVZ的脑组织标本,常规冰冻切片法制作组织切片标本,并对组织切片行HE及Nissl染色,后置普通光学显微镜下观察变化结果,并拍照记录。
1.4 免疫组织化学检测取对照组、假手术组和实验组不同时间(脑损伤模型后1、3、7、14 d),伤侧SVZ组织切片,进行NSCs的标记蛋白[巢蛋白(Nestin)和溴脱氧尿苷(BrdU)]以及神经元的特异标记蛋白[神经元特异性烯醇化酶(NSE)]、神经胶质细胞特异标记蛋白[胶质原性纤维酸性蛋白(GFAP)]等不同标记蛋白的免疫组织化学(单标及双标)检测,以检测脑损伤后、分化自NSCs的神经元和神经胶质细胞,明确大鼠颅脑损伤后自体NSCs原位增殖分化、迁移的变化及在脑功能修复中的作用。
1.4.1 NSCs标志蛋白Nestin、BrdU的免疫组织化学单标检测的大概实验步骤切片标本以TBS清洗后,先后以50%甲酰胺/2×SSC,2N HCL,pH8.5硼酸缓冲液,0.3% H2O2,含5%羊血清、0.1% BSA、0.1% TritonX-100的TBS,1:100小鼠抗Nestin、和/或l:200小鼠抗BrdU单克隆抗体,1:100稀释的生物素化羊抗小鼠二抗,1: 100稀释的辣根酶标记链亲和素作用处理相应的时间;再用DAB试剂盒显色;裱片、封片后,显微镜观察、照相。对空白对照实验:用PBS代替一抗,其余步骤不变。
1.4.2 分化自NSCs的神经元和神经胶质细胞的免疫荧光组织化学双标检测大概实验步骤将冰冻切片置于24孔板内,孔内预先加入TBS。分成4组:Al-A6孔做Nestin和NSE双标;B1-B6孔做Nestin和GFAP双标;Cl-C6孔做BrdU和NSE双标:Dl-D6孔做BrdU和GFAP双标。按照顺序处理,裱片、封片后,立即置激光共聚焦显微镜下观察、扫描,用于FITC、罗丹明的激发光波长分别为488、543 nm,保存扫描照片。
1.5 细胞计数用LeciaQ Win计算机图像分析系统软件,计数脑损伤后不同时间点的脑损伤灶SVZ处Nestin/NSE、Nestin/GFAP、BrdU/NSE及BrdU/GFAP双标荧光阳性细胞数。
1.6 统计学处理采用统计软件SPSS17.0对数据进行处理,实验数据均采用均数±标准差表示,实验结果组间比较采用方差分析及两两比较(LSD),多个时点比较采用重复测量方差分析,检验水准α=0.05。
2 结果 2.1 各组SVZ光镜下的变化肉眼观对照组、假手术组、实验组7 d SVZ变化可见:对照组、假手术组及实验组SVZ形态均正常,呈苍白色,无渗血,3者之间肉眼观未见明显差异。HE和尼氏染色观察可见:对照组及假手术组SVZ组织无明显差异,细胞形态正常,布局有序,神经元无损伤缺失,胞体、胞核清楚,核仁明显,尼氏体密集,均匀分布于核周;实验组SVZ神经细胞密集、层次不清,有的细胞旁有空泡变,核仁不清,可见核固缩、核碎裂,与对照组及假手术组相比有明显差异。
2.2 各组SVZ免疫组织化学染色结果 2.2.1 各组SVZ Nestin免疫组织化学染色结果光镜下可见对照组、假手术组和实验组SVZ组织均出现不同程度的BrdU、Nestin免疫组化阳性染色,可见有大量细胞呈棕褐色颗粒,分别位于细胞核和细胞质明显。其中实验组BrdU、Nestin免疫组织化学染色相对较强,其余两组相对较弱。
2.2.2 各组SVZ BrdU免疫组织化学染色结果光镜下可见对照组、假手术组和实验组SVZ组织均出现不同程度的BrdU免疫组化阳性染色,可见有大量棕褐色颗粒着色,主要在分布细胞核。其中实验组BrdU免疫组织化学染色相对较强,其余两组相对较弱。
2.3 各组SVZ组织激光共聚焦显微镜检测双标结果 2.3.1 各组SVZ组织激光共聚焦显微镜Nestin/NSE标记及计数结果共聚激光显微镜可见3个组不同时间点的SVZ组织均呈现不同程度的Nestin/NSE双标抗体标记阳性细胞(下称阳性细胞1),Nestin和NSE荧光染色镜下分别呈绿色及红色,细胞呈神经元形态,Nestin及NSE主要分布在细胞浆和细胞膜。对各个组不同时间SVZ组织阳性细胞1进行细胞数量计数,结果显示:对照组与假手术组SVZ组织,在相应处理后的第1、3、7、14天,阳性细胞1计数均无显著统计学差异;但实验组大鼠SVZ组织阳性细胞1计数在第1天时即已升高为57.3,第3天出现峰值67.9,第7天时开始下降为59.7,第14天基本恢复正常为29.1;实验组4个时间点的阳性细胞1计数有显著统计学差异。而在第1、3、7天,对照组和假手术组,与实验组SVZ组织的阳性细胞1计数相比,均有显著统计学差异,而对照组和假手术组间均无统计学差异;在第14天,对照组、假手术组与实验组之间的阳性细胞1计数则无显著统计学差异。详细结果表 1。
| 表 1 各组SVZ激光共聚焦显微镜Nestin/NSE标记计数结果 Table 1 Nestin/NSE-positive cells in the SVZ measured by laser scanning confocal microscopy in each group (Mean±SD) |
共聚激光显微镜可见,对照组和假手术组SVZ组织中都有不同程度Nestin/GFAP双标抗体标记阳性细胞染色(下称阳性细胞2);而实验组不同时间点(脑损伤后第1、3、7及14天)的SVZ组织均呈现不同程度的阳性细胞2,Nestin和GFAP荧光染色镜下分别呈绿色及红色,细胞呈胶质细胞形态,主要分布在细胞浆及细胞轴突。对各个组不同时间SVZ组织阳性细胞2数量计数,结果显示:对照组与假手术组SVZ组织,在相应处理后的第1、3、7、14天时间点,阳性细胞2计数均无显著统计学差异;但实验组大鼠SVZ组织的该细胞计数在脑损伤后第1天升高为27.5,第3天出现峰值39.9,第7天降为28.7;第14天基本恢复正常为20.3;实验组4个时间点的阳性细胞2计数有显著统计学差异。而在第1、3、7天,对照组和假手术组,分别与实验各组SVZ组织的阳性细胞2计数相比,均有显著统计学差异,而对照组和假手术组间均无统计学差异。而在第14天,3组之间的阳性细胞2计数又无显著统计学差异。详细结果表 2。
| 表 2 各组SVZ激光共聚焦显微镜检查Nestin/GFAP标记计数结果 Table 2 Nestin/GFAP-positive cells in the SVZ measured by laser scanning confocal microscopy in each group (Mean±SD) |
共聚激光显微镜检测可见,对照组和假手术组大鼠SVZ组织中有少量BrdU/NSE双标抗体标记阳性细胞染色(下称阳性细胞3);而实验组不同时间点(脑损伤后第1、3、7及14天)的SVZ组织均呈现不同程度的阳性细胞3,细胞呈神经细胞形态,BrdU和NSE主要分布在细胞核及细胞浆。对各个组不同时间SVZ组织阳性细胞3进行数量计数,结果显示:对照组与假手术组SVZ组织,在处理后的第1、3、7、14天时间点,阳性细胞3计数均无显著统计学差异;但实验组SVZ组织阳性细胞3数量在脑损伤后的第1天升高为15.2,第3天达峰值19.9,第7天降为14.9;第14天则基本恢复正常为9.6;实验组4个时间点的阳性细胞3细胞数有显著统计学差异。而在第1、3、7天,对照组和假手术组,分别与实验各组SVZ组织的阳性细胞3细胞计数相比,均有显著统计学差异。而对照组和假手术组间均无统计学差异;而在第14天,3组之间的阳性细胞3细胞数又无显著统计学差异(图 1,表 3)。
| 表 3 各组SVZ激光共聚焦显微镜BrdU/NSE标记计数结果 Table 3 BrdU/NSE-positive cells in the SVZ measured by laser scanning confocal microscopy in each group (Mean±SD) |
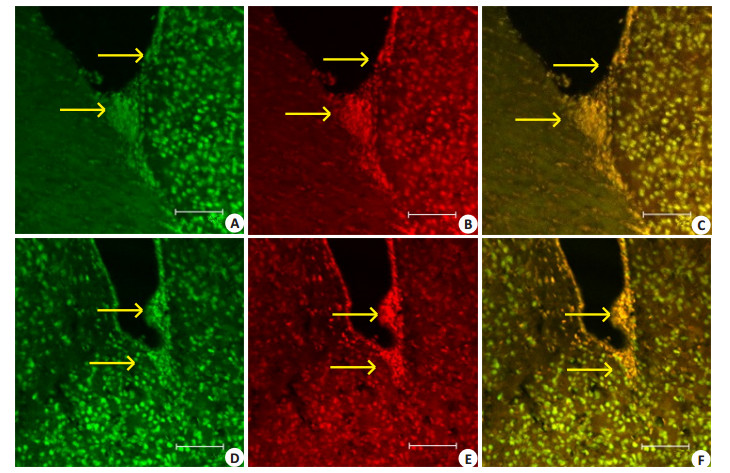
|
图 1 实验组各时间点伤侧SVZ激光共聚焦显微镜BrdU/NSE标记结果 Figure 1 Brdu/NSE-positive cells in the SVZ on the injured side observed by laser scanning confocal microscopy at different time points following TBI (×20). A: Day 7 after TBI. Arrows indicate BrdU-positive cells in the SVG with FITC green fluorescent labeling of the cell nuclei; B: Day 7 after TBI. Arrows indicate positive cells for NSE in the SVG with Rodanmin red fluorescent labeling of the cytoplasm; C: Day 7 after TBI. Arrows indicate positive cells for BrdU/NSE double labeling with FITC and Rodanmin fluorescent labeling of the cell nuclei and cytoplasm, respectively; D: Day 3 after TBI. Arrows indicate positive cells for BrdU in the SVG with FITC green fluorescent labeling of the cell nuclei; E: Day 3 after TBI. Arrows indicate positive cells for NSE in the SVG with Rodanmin red fluorescent labeling of the cytoplasm; F: Day 3 after TBI. Arrows indicate positive cells for nestin/NSE double labeling in the SVG with FITC and Rodanmin fluorescent labeling of the cell nuclei and cytoplasm, respectively. |
共聚激光显微镜检测可见,对照组和假手术组大鼠SVZ组织中有少量BrdU/GFAP双标阳性染色细胞(下称阳性细胞4);而实验组不同时间点的大鼠SVZ组织均呈现不同程度的阳性细胞4,镜下呈绿色及红色着色,主要分别分布在细胞核和细胞轴突。对各个组不同时间SVZ组织阳性细胞4进行数量计数,结果显示:对照组与假手术组SVZ组织,在处理后的第1、3、7、14天时间点阳性细胞4计数均无显著统计学差异;但实验组的阳性细胞数量在第1天升高为13.2,第3天达峰值18.9,第7天降为14.7;第14天则基本恢复正常为9.3;实验组4个时间点的阳性细胞数有显著统计学差异;而在第1、3、7天,无对照组和还是假手术组,分别与实验各组阳性细胞计数相比,均有显著统计学差异,而对照组和假手术组间均无统计学差异;而在第14天,3组之间的阳性细胞数又无显著统计学差异(表 4)。
| 表 4 各组SVZ激光共聚焦显微镜BrdU/GFAP标记计数结果 Table 4 BrdU/GFAP-positive cells in the SVZ measured by laser scanning confocal microscopy in each group (Mean±SD) |
研究认为[11],NSCs可以有效修复受损CNS的功能,在脑组织与脑功能的损伤修复与替代中,干细胞技术是最为有效的方法之一。在正常成年个体的正常情况下,NSCs处于静止状态;在某些疾病、创伤等刺激下,体内的NSCs能被诱导活化,以替代结构与功能缺失的神经细胞。Zhang等[12]研究表明,中度的TBI能促进静止期的神经祖细胞在TBI后第3,7,49天增殖分化,在SVZ和SGZ两个区域中,已经观察到TBI迅速诱导神经发生、提升细胞增殖水平的现象。但目前仍缺乏系统而确切的证据。因此模拟临床TBI情况下NSCs原位动员并参与CNS的修复过程,成为神经外科学术领域关注的热点。
目前用于实验研究的TBI模型有很多种, 应用较多的主要有惯性加速TBI模型、固定冲击TBI模型、自由落体闭合TBI模型、液压冲击TBI模型等,其中自由落体TBI模型脑组织损伤局限,伤后可出现局灶性脑挫裂伤、皮质出血以及脑水肿,损伤机制与临床TBI相似,适用于制造临床TBI动物研究模型[13]。本实验采用自由落体TBI模型,由于中型颅脑损伤模型创伤条件稳定可靠、单一,创伤程度适中,损伤模型动物的致死率低,适于大批量的实验研究,故选用中型作为研究依托模型,使得实验结果更具参考价值。同时,为了提高结果的客观性,本实验选取了两个NSCs的特异性标志物Nestin与BrdU。Nestin属于第Ⅵ类中间丝蛋白,以胚胎组织及成年哺乳动物脑内室管膜下区和齿状回颗粒下区神经前体细胞内分布为主,被认为是CNS发育过程中NSCs的标志之一[14],主要定位于细胞质。BrdU作为细胞增殖的标志物,可代替胸腺嘧啶在细胞的DNA合成期(S期)起到核标记作用,利用免疫荧光化学染色跟踪检测NSCs中BrdU的表达情况,可以间接检测NSCs的增殖、分化等情况[15-17]。利用Nestin与BrdU所建立的定性、定量检测细胞增殖和分化的标记方法,结合神经元特异标志物NSE及胶质细胞标志物GFAP,双标方法可明确来源于CNS的神经元及神经胶质细胞分化状态。
本实验模拟临床TBI情况下NSCs原位动员并参与CNS的修复过程,研究大鼠中型TBI后、不同部位原位诱导内源性NSCs增殖、分化的病理生理变化趋势。结果表明,在TBI后的伤侧SVZ中NSCs增殖分裂, 以伤后第3天时最明显,到伤后第14天时,下降至接近正常水平。提示中度TBI后第3天明显动员伤侧的SVZ中NSCs,使其增殖分化,并且以NSCs来源为主。表明SVZ是NSCs增殖分化的重要的生发中心。但该实验未研究NSCs主要向何种类型的细胞分化。因此NSCs向神经元分化的潜在调节机制,以及NSCs分化以何种类型的细胞为主将是下一步研究重点。
综上所述,本实验建立了简单可控、重复性好的临床TBI动物实验模型,初步揭示了TBI后NSCs原位动员及增殖分化的动态变化规律,可为进一步研究NSCs移植的相关实验提供重要参考,为未来临床上治疗TBI提供可借鉴的实验依据及策略。
| [1] |
Feigin VL, Theadom A, Barker-Collo S, et al. Incidence of traumatic brain injuryin bew zealand: a population-based study[J].
Lancet Neurol,2013, 12 (1) : 53-64.
DOI: 10.1016/S1474-4422(12)70262-4. ( 0) 0)
|
| [2] |
Thurman DJ. The epidemiology of traumatic brain injury in chil-dren and youths: a review of research since 1990[J].
J Child Neurol,2014, 10 (1177) : 1-8.
( 0) 0)
|
| [3] |
李晓光, 孙毅, 杨朝阳. NT3-壳聚糖支架诱导内源性神经发生修复脊髓损伤[J].
前沿科学,2016, 10 (1) : 4-10.
( 0) 0)
|
| [4] |
Fenn AM, Skendelas JP, Moussa DN, et al. Methylene blue attenuates traumatic brain injury-associated neuroinflammation and acute depressive-like behaviorin mice[J].
J Neurotrauma,2015, 32 (2) : 127-38.
DOI: 10.1089/neu.2014.3514. ( 0) 0)
|
| [5] |
Michelsen KA, Acosta-Verdugo S, Benoit-Marand M, et al. Areaspecific reestablish-ment of damaged circuits in the adult cerebral cortex by cortical neurons derived from mouse embryonic stem cells[J].
Neuron,2015, 85 (5) : 982-99.
DOI: 10.1016/j.neuron.2015.02.001. ( 0) 0)
|
| [6] |
Luo YP, Coskun V, Liang AB, et al. Single-cell transcriptome analyses reveal signals to activate dormant neural stem cells[J].
Cell,2015, 161 (5) : 1175-86.
DOI: 10.1016/j.cell.2015.04.001. ( 0) 0)
|
| [7] |
Ming GL, Song H. Adult neurogenesis in the mammalian brain: significant answers and significant questions[J].
Neuron,2011, 70 (4) : 687-702.
DOI: 10.1016/j.neuron.2011.05.001. ( 0) 0)
|
| [8] |
Masatake F, Fusako U. Low concentrations of methylmercury inhibitneural proge-nitor cell proliferation associated with up-regulation of glycogen synthase kinase 3 beta and subsequent degradation of cyclin E in rats[J].
Toxicol Appl Pharmacol,2015, 288 (1) : 19-25.
DOI: 10.1016/j.taap.2015.07.006. ( 0) 0)
|
| [9] |
Prigatano. Impaired self-awareness after moderately severe to severe traumatic brain injury[J].
Acta Neurochir Suppl,2005, 93 (93) : 39-42.
( 0) 0)
|
| [10] |
Feeney DM, Bailey BY, Boyeson MG, et al. Animal models of traumatic brain injury: a review[J].
Aust Vet J,2001, 79 (9) : 628-33.
DOI: 10.1111/j.1751-0813.2001.tb10785.x. ( 0) 0)
|
| [11] |
李达, 郑季南, 林淑瑜, 等. 脊髓损伤患者神经功能恢复的治疗研究新进展[J].
临床军医杂志,2014, 42 (6) : 620-3.
( 0) 0)
|
| [12] |
Zhang Z, Yan R, Zhang Q, et al. Hes1, a notch signaling downstream target, regulates adult hippocampal neurogenes is following traumatic brain injury[J].
Brain Res,2014, 1583 (1) : 65-78.
( 0) 0)
|
| [13] |
潘智勇, 徐成仕, 王泽芬, 等. 大鼠不同程度颅脑损伤模型的建立及评估[J].
,2015, 20 (7) : 413-8.
( 0) 0)
|
| [14] |
Guo KH, Li DP, Gu HY, et al. Postnatal development of nestin positive neurons in rat basal forebrain: different onset and topography with choline acetyltransferase and parvalbumin expression[J].
In J Dev Neuro Sci,2014, 35 (3) : 72-9.
( 0) 0)
|
| [15] |
Ziv-Polat O, Margel S, Shahar A. Application of Iron oxide anoparticles in neuronal tissue engineering[J].
Neural Regene Res,2015, 10 (2) : 189-91.
DOI: 10.4103/1673-5374.152364. ( 0) 0)
|
| [16] |
Tsuji T, Itoh M, Kikuchi R. Repeated exposure to 5-bromo-2'-deoxyuridine causes decreased proliferation and lowgradeinflammation in the lungs of mice[J].
Exp Toxicol Pathol,2015, 67 (5-6) : 355-60.
DOI: 10.1016/j.etp.2015.04.003. ( 0) 0)
|
| [17] |
Asano M, Yamamoto T, Tsuruta T. Dual labeling with 5-bromo-2'-deoxyuridine and 5-ethynyl-2'-deoxyuridine for estimation of cellmigration rate in the small intestinal epithelium[J].
Dev Growth Differ,2015, 57 (1) : 68-73.
DOI: 10.1111/dgd.12191. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
