2. 广东省医学科学院, 广东省人民医院东病区内分泌科, 广东 广州 510080 ;
3. 南方医科大学附属柳州医院内分泌科, 广西 柳州 545007 ;
4. 中山大学附属第一医院黄埔院区心血管 内科, 广东 广州 510700
2. Department of Endocrinology, East Ward, Guangdong Academy of Medical Sciences/Guangdong General Hospital, Guangzhou 510080, China ;
3. Department of Endocrinology, Liuzhou Hospital Affiliated to Southern Medical University, Liuzhou 545007, China ;
4. Department of Cardiology, Huangpu Division of First Affiliated Hospital of Sun Yat-sen University, Guangzhou 510700, China
我国糖尿病患者人数众多,目前已超过1亿人,糖尿病的主要危害在于慢性并发症。高血糖是糖尿病的一个重要特征,是引起糖尿病几乎所有并发症(如大血管病变、微血管病变、神经病变等)的最直接因素。高血糖引起糖尿病血管病变的机制是多方面的,包括细胞内活性氧(ROS)的产生[1-2]、炎性细胞因子的产生增多[3]、线粒体损伤[4]等。
硫化氢(H2S)是近年来研究较多的内源性气体信号分子,生理浓度H2S对多种细胞有保护作用。体内许多组织细胞,如心肌细胞、内皮细胞等能产生内源性H2S。2型糖尿病患者及链脲霉素诱导的糖尿病大鼠,其血浆H2S水平明显降低[5]。
瘦素是一种由脂肪细胞和其他细胞释放的相对分子质量为16 000的多肽,参与食欲与能量代谢的调节[6],在维持能量代谢内环境的作用日益受到重视[7],瘦素是通过瘦素受体而产生生理与病理生理作用的。有研究证实外源性H2S能通过抑制瘦素/瘦素受体通路对抗高糖引起的心肌细胞损伤[8]。人脐静脉内皮细胞(HUVECs)可分泌瘦素[9],而高瘦素血症与血管病变有关,其作用机制与胰岛素抵抗不同[10]。因此我们推测,外源性H2S在高糖引起的血管内皮细胞损伤中亦可能起到保护作用,且可能是通过抑制瘦素/瘦素受体通路实现的。
本文应用40 mmol/L葡萄糖处理HUVECs 24 h建立高糖(high glucose, HG)损伤内皮细胞模型,探讨:外源性H2S能否抑制高糖引起的HUVECs损伤;H2S的保护作用是否通过调控瘦素/瘦素受体通路实现。
1 材料和方法 1.1 材料人脐静脉内皮细胞(广州吉妮欧);瘦素抗体、瘦素受体抗体、GAPDH抗体(Proteintech);瘦素拮抗剂(leptin antagonist, LA)(Prospec);硫氢化钠、Hoechst 33258、DCFH-DA、罗丹明123(Sigma);细胞计数试剂盒-8(Cell Counter Kit-8,CCK-8)(Dojindo);DMEM培养基、胎牛血清(fetal bovine serum, FBS)(Hyclone, Gibco)。
1.2 细胞培养HUVECs培养于含有10% FBS的DMEM培养基中,置于37℃、5% CO2条件下的培养箱中培养。
1.3 实验分组实验分为6组:(1)正常对照组(control):无血清的DMEM培养基(含5.5 mmol/L葡萄糖)处理HUVECs 24 h;(2)HG损伤组:40 mmol/L葡萄糖作用于HUVECs 24 h;(3)NaHS预处理+HG损伤组:400μmol/L NaHS作用于HUVECs 30min之后撤去,PBS冲洗2次,接着用40 mmol/L葡萄糖作用24 h;(4)LA预处理+HG损伤组:50 ng/mL LA作用于HUVECs 1 h之后撤去,PBS洗2次,接着用40 mmol/L葡萄糖作用24 h;(5)NaHS处理组:400μmol/L NaHS作用于HUVECs 30 min之后撤去,PBS洗2次,接着用无血清DMEM培养基培养24 h;(6)LA处理组:50 ng/mL LA作用于HUVECs 1 h之后撤去,PBS洗2次,接着用无血清DMEM培养基培养24 h。
1.4 CCK-8法检测细胞存活率将HUVECs接种于96孔培养板当中,每组5个复孔。当细胞生长到占培养孔面积70%~80%时,按分组进行处理后,于每孔中加入10μL CCK-8、90μL不含血清的DMEM,于37℃培养箱孵育2 h,用酶标仪记录450 nm波长处各孔的吸光度D值。取5孔D值的平均数,按以下公式计算细胞存活率:细胞存活率(%)=处理组D/对照组D×100,实验重复3次进行统计分析。
1.5 Western blot法检测瘦素、瘦素受体(LEPR)蛋白的表达将HUVECs接种于直径为35 mm的培养皿内,当细胞生长到占培养皿面积70%~80%时,按分组进行处理后,用预冷的PBS洗3次,加入细胞裂解液(70μL),于4℃静置30 min,后12 000 r/min、4℃离心15 min,取上清液(即蛋白提取物),采用BCA蛋白定量试剂盒进行蛋白定量。总蛋白经十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶分离后,转移至PVDF膜上。用5%的脱脂奶粉(TBST配置)室温封闭1.5 h,然后分别加入特异性的一抗,即抗瘦素抗体(1:1000)、抗瘦素受体抗体(1:1000)、GAPDH(1:10 000),4℃孵育过夜,第2天早上TBST漂洗3次,每次5 min,随后与耦联辣根过氧化物酶(HRP)标记的二抗(1:5000)室温孵育1 h。为了观察总蛋白的量,用GAPDH作为内参。PVDF膜经TBST漂洗3次,每次5 min,用发光试剂ECL显色,暗室曝光到X光胶片上,将胶片扫描后,用ImageJ 1.47i软件[National Institutes of Health(NIH),Bethesda,MD,USA]分析目标带的密度灰度比值比较结果。重复3次。
1.6 Hoechst 33258核染色法检测细胞凋亡将HUVECs接种于24孔培养板当中,当细胞生长到占培养孔面积70%~80%时,按分组进行处理后,吸出培养基,用PBS洗3次,接着用4%多聚甲醛于4℃冰箱中固定10 min,PBS漂洗后,加入5 mg/L Hoechst 33258,于37℃温箱中孵育30 min。在倒置荧光显微镜下摄片,染色质均匀分布,细胞核被染成均匀蓝色的细胞认定为正常细胞,细胞核呈浓缩、碎裂的明亮蓝色的细胞认定为凋亡细胞,随机地选取视野在倒置荧光显微镜下摄片。重复3次。
1.7 DCFH-DA染色测定ROS水平将HUVECs接种于24孔培养板当中,当细胞生长到占培养孔面积的70%~80%时,按分组进行处理后,吸出培养基,用PBS洗3次,风干。在含有10μmol/L DCFHDA的无血清培养基中置于37℃温箱中孵育30 min,后用PBS漂洗3次,在倒置荧光显微镜下随机地选取5个不重复区摄片,荧光强度用ImageJ 1.410软件进行半定量分析。重复3次。
1.8 罗丹明123(Rh123)染色法检测HUVECs线粒体膜电位(MMP)将HUVECs接种于24孔培养板当中,当细胞生长到占培养孔面积的70%~80%时,按分组进行处理后,吸出培养基,用PBS冲洗3次,风干。在含有10μg/L Rhl23的无血清培养基当中于37℃温箱孵育30 min,吸出培养基,PBS漂洗3次。在倒置荧光显微镜下随机地选取5个不重复区摄片,细胞核周围的绿色亮点即为摄取了Rhl23的线粒体。用ImageJ 1.410软件对荧光强度进行半定量分析。重复3次。
1.9 统计学处理实验数据以均数±标准差表示,用SPSS 20.0软件进行统计分析,实验组组间比较采用SNK-q检验,实验组与对照组比较采用Dunnett-t检验。以P < 0.05为差异有统计学意义。
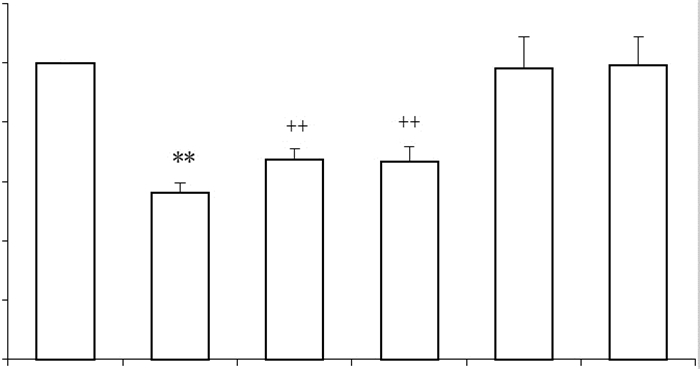
2 结果 2.1 外源性H2S和LA抑制高糖引起的HUVECs细胞毒性如图 1所示,高糖能明显增加HUVECs的细胞毒性,导致细胞存活率下降到(56.1±3.4)%,与正常对照组相比,差异有统计学意义(P < 0.01)。在高糖处理HUVECs之前,应用400μmol/L NaHS预处理30 min可以明显阻断高糖导致的细胞毒性,使细胞存活率增加到(67.4±3.7)%,与高糖处理组相比较,差异显著(P < 0.01)。和NaHS的抗细胞毒性作用相似,50 ng/mL LA预处理HUVECs 1 h也能显著抑制高糖引起的细胞毒性,使细胞存活率增加至(66.7±4.9)%(P < 0.01)。单独用400μmol/L NaHS或50 ng/mL LA处理HUVECs对细胞毒性无明显影响(P>0.05)。
|
图 1 外源性H2S与LA抑制高糖引起的HUVECs细胞毒性 Figure 1 Exogenous H2S and leptin antagonist (LA) alleviate high-glucose (HG, 40 mmol/L)-induced cytotoxicity in HUVECs (Mean±SD, n=3). **P < 0.01 vs control group; ++ P < 0.01 vs HG-treated group. |
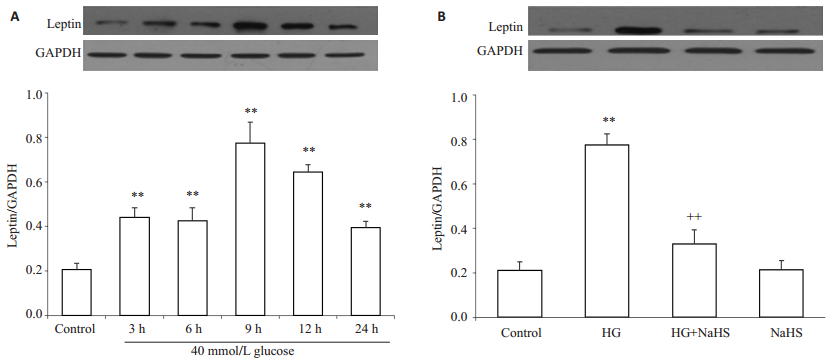
如图 2A所示,应用40 mmol/L葡萄糖分别处理HUVECs 3、6、9、12、24 h均能明显上调瘦素的表达水平,于9 h时达到高峰。如图 2B所示,为了检测H2S对瘦素表达的影响,用400μmol/L NaHS预处理HUVECs 30 min,再用高糖处理9 h,结果显示,能明显抑制瘦素的表达水平,与高糖组比较,差异有统计学意义(P < 0.01)。单独用400μmol/L NaHS处理HUVECs对瘦素基础表达水平未见明显影响(P>0.05)。
|
图 2 外源性H2S抑制高糖对HUVECs瘦素表达的促进作用 Figure 2 Exogenous H2S inhibits the high glucose (HG, 40 mmol/L glucose)-induced up-regulation of leptin expression in HUVECs (Mean±SD, n=3). **P < 0.01 vs control group. ++P < 0.01 vs HG-treated group. |
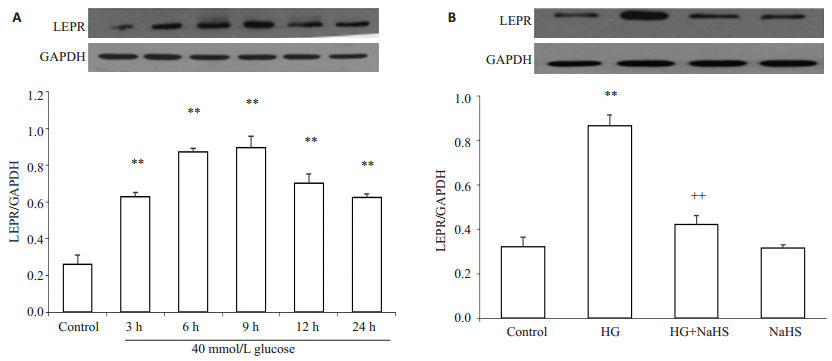
如图 3A所示,应用40 mmol/L葡萄糖分别处理HUVECs 3、6、9、12、24 h均能明显上调LEPR的表达水平,于9 h时达到高峰。如图 3B所示,为了检测H2 S对LEPR表达的影响,用400μmol/L NaHS预处理HUVECs 30 min,再用高糖处理9 h,结果显示,能明显抑制LEPR的表达水平,与高糖组比较,差异有统计学意义(P < 0.01)。单独用400μmol/L NaHS处理HUVECs对LEPR基础表达水平未见明显影响(P>0.05)。
|
图 3 外源性H2S抑制高糖对HUVECs瘦素受体表达的促进作用 Figure 3 Exogenous H2S inhibits the high-glucose (HG, 40 mmol/L glucose)-induced up-regulation of leptin receptor expression in HUVECs (Mean±SD, n=3). **P < 0.01 vs control group; ++P < 0.01 vs HG-treated group. |
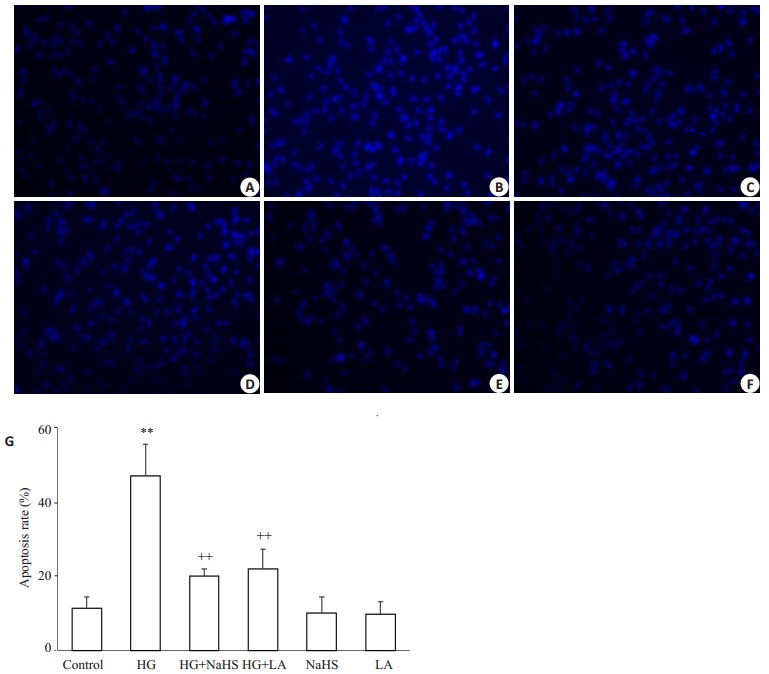
如图 4所示,Hoechst 33258核染色检测结果显示,40 mmol/L葡萄糖作用HUVECs 24 h可诱导细胞凋亡,使HUVECs的凋亡率从(11.3±3.1)%(图 4A、G)升高至(47.0±8.5)%(图 4B、G),与正常对照组比较,差异显著(P < 0.01)。在高糖处理HUVECs前应用400μmol/L NaHS预处理30 min能显著抑制高糖的致细胞凋亡作用,使HUVECs凋亡率降低至(20.0±2.0)%(图 4C、G),与高糖处理组比较,差异明显(P < 0.01)。与NaHS的作用相似,用50 ng/mL LA预处理HUVECs 1 h也能对抗高糖引起的的致细胞凋亡作用,使HUVECs凋亡率降低至(22.0±5.3)%(图 4D、G)(P < 0.01)。单独用400μmol/L NaHS(图 4E、G)或50 ng/mL LA(图 4F、G)处理HUVECs对细胞凋亡无明显影响(P>0.05)。
|
图 4 外源性H2S与LA抑制高糖引起的HUVECs凋亡 Figure 4 Exogenous H2S and leptin antagonist (LA) reduce high-glucose (HG, 40 mmol/L glucose)-induced apoptosis of in HUVECs (Mean±SD, n=3) (Original magnification:×200). **P < 0.01 vs control group; ++P < 0.01 vs HG-treated group. A: Control; B: HG; C: HG+NaHS; D: HG+LA; E: NaHS; F: LA. |
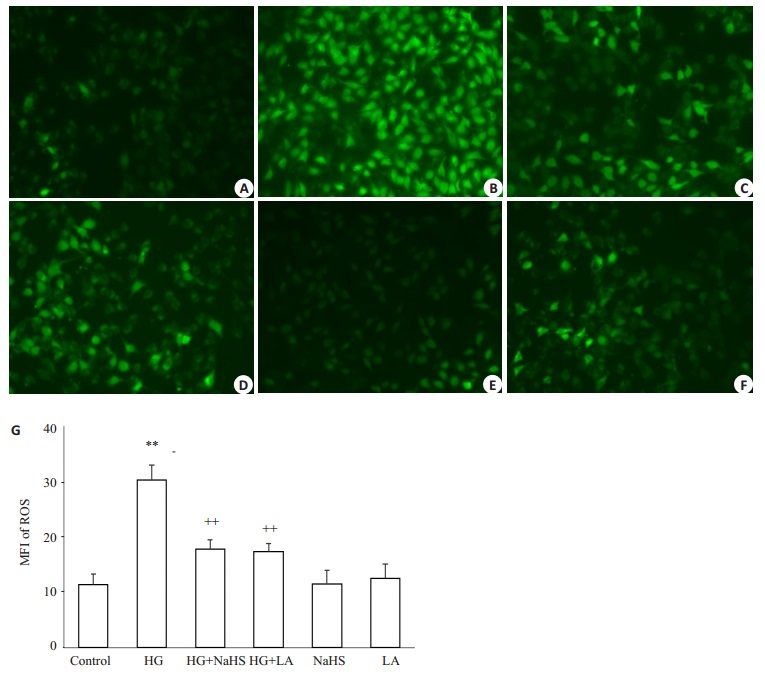
如图 5所示,DCFH-DA染色的检测结果显示,40 mmol/L葡萄糖作用HUVECs 24 h可使胞内的DCFH平均荧光强度(MFI,可反映ROS水平)明显增强,从(11.4±1.8)%(图 5A、G)升高至(30.3±2.6)%(图 5B、G),与正常对照组比较,差异显著(P < 0.01),提示高糖可引起HUVECs胞内ROS生成增多。在高糖处理HUVECs前应用400μmol/L NaHS预处理30 min可使高糖引起的胞内ROS堆积减少,MFI减少至(17.8±1.6)%(图 5C、G),与高糖处理组比较,差异明显(P < 0.01)。与NaHS作用相似,应用50 ng/mL LA预处理HUVECs 1 h也能对抗高糖引起的胞内ROS堆积,MFI减少至(17.3±1.5)%(图 5D、G)(P < 0.01)。单独用400μmol/L NaHS(图 5E、G)或50 ng/mL LA(图 5F、G)处理HUVECs对胞内ROS水平无明显影响(P>0.05)。
|
图 5 外源性H2S与LA抑制高糖引起的HUVECs内ROS堆积 Figure 5 Exogenous H2S and leptin antagonist (LA) reduce high-glucose (HG, 40 mmol/L glucose)-induced accumulation of reactive oxygen species (ROS) in HUVECs (Mean±SD, n=3) (Original magnification:×100). **P < 0.01 vs control group; ++P < 0.01 vs HG-treated group. A: Control; B: HG; C: HG+NaHS; D: HG+LA; E: NaHS; F: LA. |
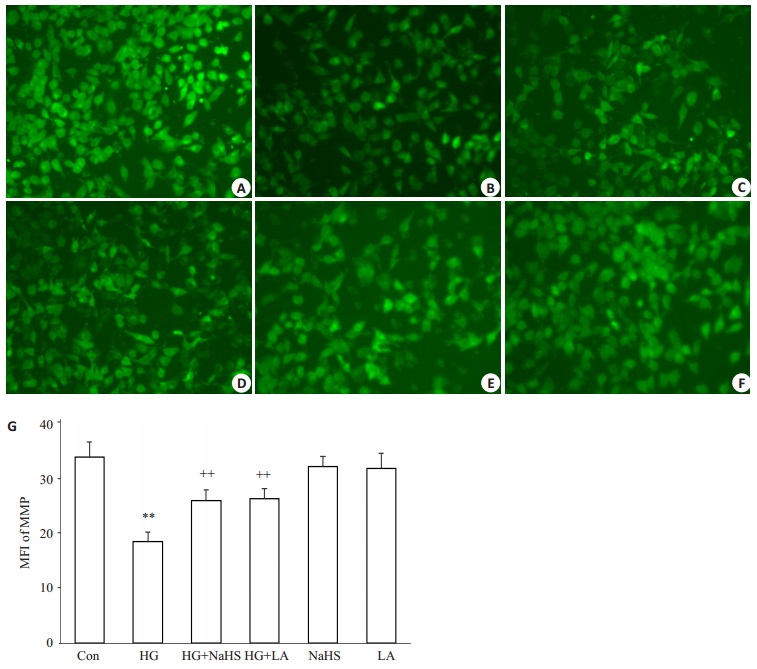
如图 6所示,Rh123染色的检测结果显示,40 mmol/L葡萄糖作用HUVECs 24 h可使Rhl23的平均荧光强度(MFI,反映MMP高低)明显减弱,从(33.3±2.7)%(图 6A、G)降低至(18.2±1.7)%(图 6B、G),提示MMP丢失,与正常对照组比较,差异显著(P < 0.01),提示高糖对HUVECs线粒体的损伤。在高糖处理HUVECs前应用400μmol/L NaHS预处理30 min可使高糖引起的MMP丢失减少,MFI升高至(25.5±2.0)%(图 6C、G),与高糖处理组比较,差异明显(P < 0.01)。与NaHS作用相似,应用50 ng/mL LA预处理HUVECs 1 h也能对抗高糖引起的线粒体损伤,MFI升高至(25.9±1.8)%(图 6D、G),P < 0.01)。单独用400μmol/L NaHS(图 6E、G)或50 ng/mL LA(图 6F、G)处理HUVECs对MMP水平无明显影响(P>0.05)。
|
图 6 外源性H2S与LA抑制高糖对HUVECs线粒体的损伤作用 Figure 6 Exogenous H2S and leptin antagonist (LA) attenuate high-glucose (HG, 40 mmol/L glucose)-induced decrease of mitochondrial member potential (MMP) in HUVECs (Mean±SD, n=3) (Original magnification:×100). **P < 0.01 vs control group; ++P < 0.01 vs HG-treated group. A: Control; B: HG; C: HG+NaHS; D: HG+LA; E: NaHS; F: LA. |
高血糖可通过多种病理生理机制,如引起血管内皮细胞功能损伤等,导致糖尿病的多种并发症。本研究通过建立高糖损伤HUVECs模型,证实了高糖对血管内皮细胞有明显的损伤作用,表现为降低细胞存活率、增加内皮细胞凋亡、氧化应激(胞内ROS堆积)和线粒体损伤(MMP丢失)等。
高糖对内皮细胞H2S的生成具有抑制作用,而外源性H2S可保护高糖诱导的内皮细胞损伤,其机制可能与抗氧化应激、线粒体保护等作用有关。生理浓度的H2S供体(如Na2S及NaHS等)可抑制细胞凋亡[11],H2S还可能对细胞内氧消耗起调节作用[12]。有研究证实,H2S可通过抗氧化等作用对抗高血糖引起的血管内皮细胞损伤[13]。还有研究证实,NaHS能显著阻断氧化型低密度脂蛋白引起的HUVECs线粒体膜电位降低,从而保护内皮细胞[14]。本研究观察到,外源性H2S能保护HUVECs对抗高糖引起的损伤,具体表现为提高细胞存活率,减少细胞凋亡及ROS的生成,减少线粒体膜电位的丢失。
本研究还发现,高糖在引起HUVECs损伤的同时,还能上调内皮细胞瘦素和瘦素受体的表达。而瘦素拮抗剂可保护HUVECs对抗高糖诱导的损伤,提示瘦素/瘦素受体通路介导高糖诱导的内皮细胞损伤。
有研究证实,外源性H2S能通过抑制瘦素、p38丝裂原活化蛋白激酶、细胞外信号调节激酶1/2通路抑制高糖引起的心肌细胞损伤[8, 15]。但目前H2S通过调控有关信号通路保护内皮细胞的相关研究较少。本研究观察到,外源性H2S对HUVECs的保护作用与瘦素拮抗剂类似,因此我们推测这种保护作用可能与抑制瘦素/瘦素受体通路有关。进一步研究发现,外源性H2S可抑制高糖对HUVECs瘦素以及瘦素受体表达的上调作用,也即抑制了瘦素/瘦素受体通路,这就证实了H2S对HUVECs的保护作用与抑制瘦素/瘦素受体通路有关。
综上,本研究证实,外源性H2S可通过抑制瘦素/瘦素受体通路对抗高糖引起的HUVECs损伤,这为深入阐明高血糖对血管内皮细胞损伤的机制以及外源性H2S对内皮细胞的保护机制提供了新的实验依据,为寻找新的防治糖尿病血管病变的治疗策略提供了理论依据。
| [1] |
Peake BF, Nicholson CK, Lambert JP, et al. Hydrogen sulfide preconditions the db/db diabetic mouse heart against ischemiareperfusion injury by activating Nrf2 signaling in an Erk-dependent manner[J].
Am J Physiol Heart Circ Physiol,2013, 304 (9) : H1215-24.
DOI: 10.1152/ajpheart.00796.2012. ( 0) 0)
|
| [2] |
Murali R, Karthikeyan A, Saravanan R. Protective effects of d-Limonene on lipid peroxidation and antioxidant enzymes in Streptozotocin-Induced diabetic rats[J].
Basic Clin Pharmacol Toxicol,2013, 112 (3) : 175-81.
DOI: 10.1111/bcpt.2013.112.issue-3. ( 0) 0)
|
| [3] |
Soetikno V, Sari FR, Sukumaran V, et al. Curcumin prevents diabetic cardiomyopathy in streptozotocin-induced diabetic rats: possible involvement of PKC-MAPK signaling pathway[J].
Eur J Pharm Sci,2012, 47 (3) : 604-14.
DOI: 10.1016/j.ejps.2012.04.018. ( 0) 0)
|
| [4] |
Boudina S, Sena S, Theobald H, et al. Mitochondrial energetics in the heart in obesity-related diabetes: direct evidence for increased uncoupled respiration and activation of uncoupling proteins[J].
Diabetes,2007, 56 (10) : 2457-66.
DOI: 10.2337/db07-0481. ( 0) 0)
|
| [5] |
Zhang Y, Tang ZH, Reng Z, et al. Hydrogen sulphide, the next protect pretentive and therapeutic agent inaging and age-associated diseases[J].
Mol Cell Biol,2013, 33 (6) : 1104-13.
DOI: 10.1128/MCB.01215-12. ( 0) 0)
|
| [6] |
Murad A, Nath AK, Cha ST, et al. Leptin is an autocrine/paracrine regulator of wound healing[J].
FASEB Journal,2003, 17 (11) : 1895.
( 0) 0)
|
| [7] |
Zhang F, Chen Y, Heiman M, et al. Leptin:structure, function and biology[J].
Vitam Horm,2005, 71 : 345-72.
DOI: 10.1016/S0083-6729(05)71012-8. ( 0) 0)
|
| [8] |
Zhang XD, Hu X, Long M, et al. Exogenous Hydrogen sulphide alleviates high glucose-induced cardiotoxicity via inhibition of leptin signaling in H9c2 cells[J].
Mol Cell Biochem,2014, 391 (1/ 2) : 147-55.
( 0) 0)
|
| [9] |
齐菲, 颜光涛. 抑制胞浆型磷脂酶A2活性对内毒素诱导人脐静脉内皮细胞分泌瘦素的影响[J].
中国危重病急救医学,2011, 23 (2) : 68-71.
( 0) 0)
|
| [10] |
Nickola MW, Wold LE, Colligan PB, et al. Leptin attenuates cardiac contraction in rat ventricular myocytes. Role of NO[J].
Hypertension,2000, 36 (4) : 501-5.
DOI: 10.1161/01.HYP.36.4.501. ( 0) 0)
|
| [11] |
Sivarajah A, Collino M, Yasin M, et al. Anti-apoptotic and anti-inflammatory effects of hydrogen sulfide in rat model of regional myocardial I/R[J].
Shock,2009, 31 (3) : 267-74.
DOI: 10.1097/SHK.0b013e318180ff89. ( 0) 0)
|
| [12] |
Kajimura M, Fukuda R, Bateman RM, et al. Interactions of multiple Gas-Transducing systems: hallmarks and uncertainties of CO, NO, and H2S gas biology[J].
Antioxid Redox Signal,2010, 13 (2) : 157-92.
DOI: 10.1089/ars.2009.2657. ( 0) 0)
|
| [13] |
Suzuki K, Olah G, Modis K, et al. Hydrogen sulfide replacement therapy protects the vascular endothelium in hyperglycemia by preserving mitochondrial function[J].
Proc Natl Acad Sci USA,2011, 108 (33) : 13829-34.
DOI: 10.1073/pnas.1105121108. ( 0) 0)
|
| [14] |
任重, 赵战芝, 彭湘萍, 等. 硫化氢对氧化型低密度脂蛋白诱导的人脐静脉内皮细胞凋亡的影响[J].
中国动脉硬化杂志,2011, 19 (11) : 891-6.
( 0) 0)
|
| [15] |
Xu WM, Wu W, Chen JF, et al. Exogenous Hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J].
Int J Mol Med,2013, 32 (4) : 917-25.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
