慢性疼痛是指疼痛持续超过一种急性疾病的一般病程或超过损伤愈合所需的一般时间,或疼痛复发持续超过1个月。在众多的慢性疼痛中,慢性腰背痛(chronic low back pain, CLBP)是影响最广泛致残率最高的疾病。越来越多的证据表明,大脑参与疼痛调节和疼痛防御[1-4]。神经影像学研究发现,慢性腰背痛所谓的大脑“疼痛矩阵”存在结构和功能的重组[4-9]。然而,不同研究报道的灰质异常脑区并不完全一致;对于皮层下灰质形态改变,不同的研究常得出矛盾的结果,一些研究报告丘脑灰质减少[5],而其他的研究报告丘脑和基底节区灰质增加[10]。
基于体素的形态测量学(voxel-based morphometry, VBM),一个局部容积测量方法,已被广泛用于测量各种神经退行性疾病的大脑形态学异常。本研究运用VBM软件评价慢性腰背痛患者大脑灰质形态学的影像学变化,为进一步理解疼痛的发生机制提供影像学依据。
1 资料和方法 1.1 研究对象我们纳入了30例CLBP患者(男性11例,女性19例)和30例健康志愿者(男性11例,女性19例),CLBP患者和健康志愿者在年龄和性别上匹配。所有疼痛患者从本院疼痛科(门诊和住院患者)招募。30例健康志愿者通过广告招募,所有被试填写知情同意书。该研究获得医院伦理委员会的批准。慢性腰背痛的诊断符合国际疼痛研究协会(International Association for the Study of Pain, IASP)规定的标准,即由躯体感觉神经系统损坏或疾病所致的疼痛,部位位于腰背部,反复发作大于1年。具体纳入/排除标准如下:
受试者纳入标准:(1)疼痛患者疼痛反复发作大于1年;(2)疼痛最显著的部位位于背部,以腰骶部为主;(3)初中及以上文化程度,要求能完成量表填写;(4)所有受试者都是右利手。
受试者排除标准:(1)年龄大于70岁;(2)有假牙;(3)伴发神经、精神疾病,如高血压、糖尿病、冠心病等;(4)有MR禁忌症不能完成扫描者;(5)文化程度较低,无法完成量表填写者;(6)有幽闭恐惧症者。
1.2 量表评价疼痛程度的评估采用简式麦吉疼痛问卷(Short-Form McGill Pain Questionnaire, SF-MPQ)[11],其中扫描当天采用视觉模拟量表(Visual Analog Scale,VAS)对受试者进行疼痛强度的评估,评分为0分~10分(0分代表无疼痛,10分代表剧痛)。记录患者的疼痛发病时间。其他认知问卷包括:简易精神状态检查(Mini-Mental State Examination, MMSE),蒙特利尔认知评估问卷(Montreal Cognitive Assessment, MOCA)和汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD)。这些量表评价的结果将被纳入后续的分析中,以观察这些评分与大脑形态学异常之间的相关性。
1.3 数据采集我们采用GE公司3.0T磁共振扫描仪(HDxt)进行扫描。扫描序列包括:一个三维T1加权快速扰相梯度回波(FSPGR)序列,参数如下:重复时间(TR)=10.8 ms,回波时间(TE)=4.8 ms,矩阵大小=256×256,扫描野(FOV)=256 mm×256 mm,1 mm层厚,层间距为零;140层图像,体素大小=1×1×1 mm3。并对被试进行常规T1加权像和常规T2加权像扫描,用于排除有器质性病变的数据。
1.4 数据处理首先对被试的全脑体积进行评估,计算全脑灰质、白质、脑脊液体积数据,用于后续的分析。数据处理采用牛津大学开发的FSL软件(版本号:5.0,http://www.fmrib.ox.ac.uk/fsl)[12]中的SIENAX工具包[13]。SIENAX处理流程如下:先进行脑组织提取,然后将图像配准到MNI152空间;这样可以获得体积比例因子,作为对头颅尺寸进行标准化的依据。然后用部分容积估计方法进行组织类型的分割,获得全脑体积(包括全脑灰质、白质和脑脊液)及新皮层灰质(只含皮层灰质,不包括皮层下灰质)体积。计算标准化后和未标准化的灰质、白质体积数据。组间差异用SPSS 13.0进行分析。
然后用FSL-VBM软件[14]对被试的磁共振数据进行分析,详细的分析步骤见网页http://fsl.fmrib.ox.ac.uk/fsl/fslwiki/FSLVBM/UserGuide。首先,使用BET(brain extraction)工具进行脑组织提取。其次,利用FAST软件对大脑进行组织类型的分割。由此产生灰质部分容积图像,利用FLIRT工具将之配准到MNI152标准空间;然后根据情况选择FNIRT进行非线性配准,配准采用B样条插值法。之后对产生的图像进行平均从而创建研究特异性模板,将原始灰质图再次配准到该模板上。对配准后的部分容积图进行调整、平滑(3 mm高斯核)。全脑分析后,进行感兴趣区(region of interest, ROI)分析。感兴趣区的选择参考了既往的文献报道,具体脑区用哈佛皮层结构概率图集(www.fmrib.ox.ac.uk/fsl/fslview/)。皮层感兴趣区包括:双侧额上、额中、额下回,眶额回,中央前、后回,扣带回前、后部,岛叶、双侧颞上、颞中、颞下回。皮层下感兴趣区参考哈佛皮层下结构概率图集获得,具体包括:双侧尾状核、壳核、苍白球、丘脑、杏仁核、海马和伏核。
CLBP患者和健康对照组之间的灰质差异,采用基于置换的一般线性模型(General Linear Model, GLM;5000次置换)中的协方差分析进行统计学检验,将年龄和全脑体积作为协变量。采用无阈值簇增强(threshold-free cluster enhancement, TFCE)进行多重比较校正。当P < 0.05(TFCE校正后)时认为具有统计学意义。差异明显区域的定位采用MNI坐标系和Talairach图集。最后我们在表格中列出了ROI分析的结果。
1.5 统计学分析统计分析采用SPSS 13.0软件(SPSS公司,美国,芝加哥)。人口统计学资料及量表评分之间的差异则根据数据特点(正态性和方差齐性)采用t检验或MannWhitney秩和检验进行分析。对于SIENAX获得的全脑数据的组间比较,采用协方差分析,将年龄和性别作为协变量。所有非FSL分析,P < 0.05认为是差异具有统计学意义。
2 结果 2.1 人口统计学资料和量表评分结果所有被试的人口统计学资料如表 1所示。组分析显示,慢性腰背痛患者其抑郁评分明显高于正常(P < 0.001),而MMSE和MoCA两项的认知评分明显低于正常组(P < 0.05,P < 0.01)。
| 表 1 所有被试的人口统计学资料及量表评分情况 Table 1 Demographic information and scale scores of all participants |
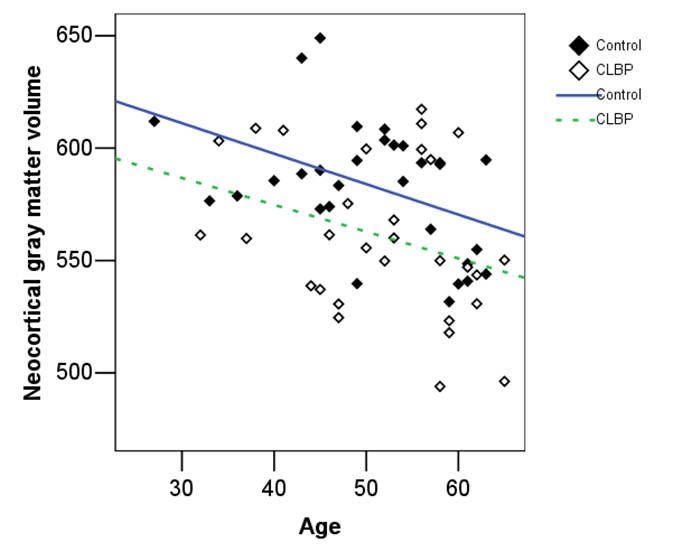
校正年龄、性别后,CLBP患者和健康被试组之间大脑新皮层灰质(不含皮层下灰质)体积差异显著(CLBP:561±35 cm3,对照组为:583±29 cm3,P=0.009)。两组的新皮层灰质体积都随年龄的增加而减小,与年龄呈负相关关系(CLBP,相关系数r=-0.339,P=0.094,健康被试:r=-0.364,P=0.004,图 1)。CLBP与年龄有关的灰质萎缩较对照组稍快。CLBP患者额叶(CLBP:0.39±0.02;健康被试组:0.41±0.02)、颞叶(CLBP:0.47±0.02;健康被试组:0.46±0.02)平均灰质信号强度明显低于健康被试组(分别是:额叶:P < 0.001;颞叶:P=0.005)。
|
图 1 CLBP和健康被试大脑新皮层灰质体积随年龄而下降的散点图 Figure 1 Scatter plot of decreased neocortical brain gray matter volume with age in patients with CLBP and healthy controls. |
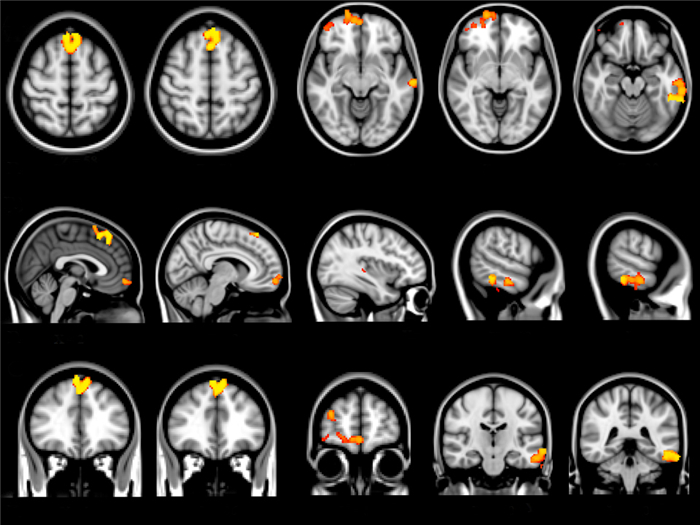
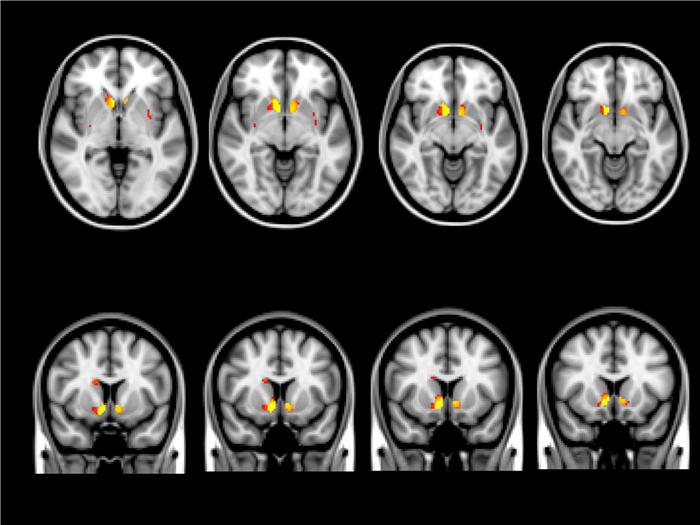
在全脑VBM分析中,CLBP患者和对照组没有明显统计学差异(P < 0.05,TFCE校正后)。ROI分析表明,皮层的灰质减少存在于:双侧额上回、右侧额极,左侧岛叶、左侧颞下回、左侧颞中回(P < 0.05,TFCE校正后,图 2)。皮层下灰质增加存在于:左侧丘脑、双侧壳核、双侧伏隔核、右侧尾状核(P < 0.05,TFCE校正后,图 3)。详细的坐标信息见表 2。
|
图 2 慢性腰背痛组与健康组之间大脑皮层的灰质差异脑区 Figure 2 Cortical brain areas with significant volume differences between patients with CLBP and healthy controls.Compared with healthy controls, patients with CLBP showed decreased GM volumes in several brain cortical areas including the bilateral superior frontal gyrus, right frontal pole, left insular cortex, left middle and inferior temporal gyrus. A: Axial view; B: Sagittal view; C: Coronal view; R: Right. The difference becomes more significant when the yellow color becomes deeper. |
|
图 3 慢性腰背痛组与健康组之间大脑皮层下的灰质差异脑区 Figure 3 Subcortical brain areas with significant volume differences between patients with CLBP and healthy controls. Compared with healthy controls, increased GM volumes were found in the subcortical structures including the left thalamus, bilateral putamen, bilateral nucleus accumben and right caudate nucleus. A: Axial view; B: Saggital view; C: Coronal view; R: Right. The difference becomes more significant when the yellow color becomes deeper. |
| 表 2 健康被试和慢性腰背痛患者之间的脑灰质体积差异脑区 Table 2 Brain areas with significant differences between patients with CLBP and healthy controls |
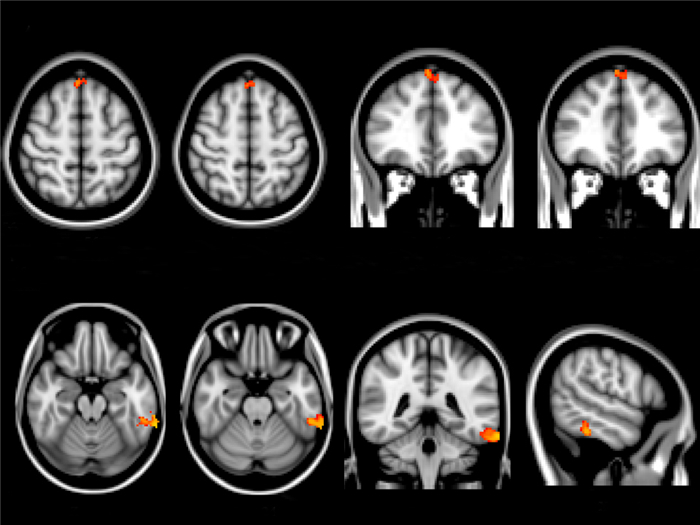
由于疼痛被试组和健康被试组之间的HAMD,MoCA和MMSE评分均有显著差异,我们将3种量表评分连同年龄、全脑体积一起作为协变量重新进行了VBM分析。结果发现两组之间有显著差异的脑区位于双侧额上回(P=0.022,TFCE校正后)、左侧颞叶(P=0.009,TFCE校正后,图 4)。但由于每组被试只有30例,当协变量个数增加时,统计效能就会大大降低,因此在讨论中我们只讨论了校正年龄和全脑体积后的结果,并进行了局限性分析。
|
图 4 慢性腰背痛与健康组大脑灰质差异脑区(校正认知量表评分后) Figure 4 Brain areas with significant differences between patients with CLBP and healthy controls after correcting for cognitive scaling scores. After correcting for HAMD, MoCA and MMSE scores, there were significant differences in the two brain areas including bilateral superior frontal cortex and left temporal lobe (P < 0.05, TFCE corrected). |
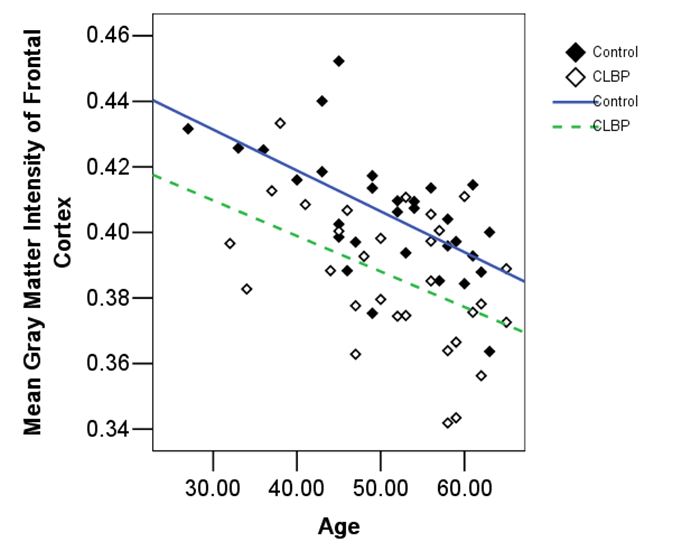
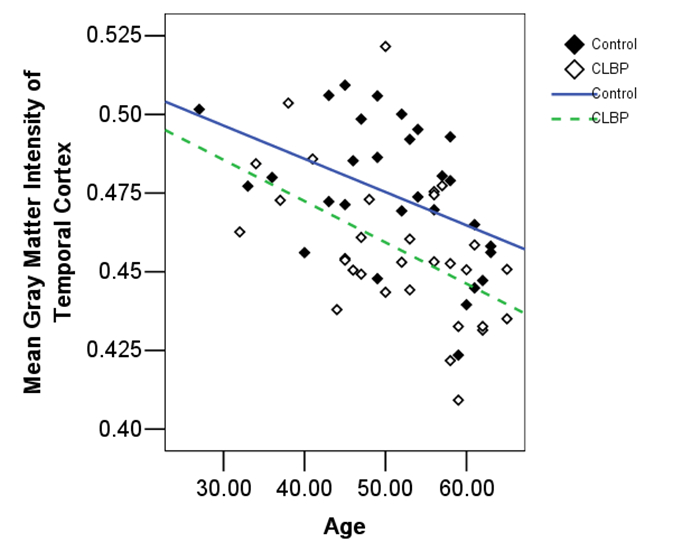
为了探讨大脑灰质异常与疼痛临床特征之间的相关性,我们采用FSL软件中“fslstats”命令对有显著组间差异的额叶、颞叶进行了平均灰质信号强度的提取,选用经FSL-FAST软件分割之后的原始灰质图像。最后采用两独立样本t检验进行了组间分析,还分析了疼痛组额叶、颞叶平均灰质信号强度与临床资料之间的相关性。对健康被试组,额、颞叶灰质信号强度与年龄均呈明显负相关(额叶与年龄:r=-0.629,P=0.012;颞叶与年龄:r=-0.462,P=0.01;图 5、6)。
|
图 5 额叶平均灰质信号强度与年龄之间关系的散点图 Figure 5 Scatter plot of the relationship between age and mean gray matter intensity of the frontal lobe. |
|
图 6 颞叶平均灰质信号强度与年龄之间关系的散点图 Figure 6 Scatter plot of the relationship between age and mean gray matter intensity of the temporal lobe. |
对于CLBP患者,额、颞叶平均灰质信号强度与年龄呈明显负相关(额叶与年龄:r=-0.454,P=0.012;颞叶与年龄:r=-0.537,P=0.002;图 5、6)。CLBP组额颞叶灰质信号强度与疼痛强度、病程、MoCA及抑郁评分之间未发现明显的相关性。
3 讨论我们的研究结果表明,慢性腰背痛患者大脑皮层和皮层下结构存在不同的灰质改变模式,大脑皮层多个脑区存在灰质萎缩(双侧额上回、右侧额极,左侧岛叶、左侧颞下回及左侧颞中回);而皮层下多个核团存在灰质增加(左侧丘脑、双侧壳核、双侧伏隔核、右侧尾状核)。这些脑区包含了内、外侧痛觉系统,参与到疼痛的识别和感觉运动整合。
在各种类型的慢性疼痛中,前额叶灰质萎缩已得到大多数研究证实[5]。前额叶与皮层和皮层下多个结构存在纤维联系。它与前扣带回共同参与了疼痛的预期、情绪及认知任务,但前额叶被认为更多地参与到疼痛刺激在认知方面的信息加工处理。Lorenz等[15]通过PET研究发现,背外侧前额叶激活增加与中脑、丘脑内侧的激活降低呈明显负相关。在本研究中,双侧前额叶灰质体积与灰质平均信号强度均有减少。
以往大部分报道将岛叶皮层作为疼痛识别的关键脑区[16]。岛叶在结构上和功能上可以分为前、后两部分,后岛叶接收来自皮层和丘脑躯体感觉区的输入,前岛叶接收丘脑内侧核、皮层边缘叶、旁边缘叶(如扣带回和杏仁核)及嗅觉区等皮层区域的输入[17]。在纤维肌痛和其他类型的慢性疼痛中[18-20],岛叶灰质增加和减少都曾被报道。岛叶的激活已被证实跟运动整合过程相关。在我们的病人组,发现了左后岛叶灰质减少。长期慢性腰背痛及疼痛较严重的患者常常降低日常运动量,这种生活方式的改变可能对观察到的岛叶体积异常有一定贡献。此外,我们还发现在左侧颞叶灰质体积减小,颞叶的萎缩在既往慢性疼痛的研究中也偶尔被发现[21]。
“外侧痛觉系统”(感觉皮层,下顶叶皮层和后岛叶)主要负责疼痛的感觉辨别,疼痛刺激的位置、强度和性质的识别。“内侧痛觉系统”包括扣带皮层、前岛叶和额叶皮层,主要与疼痛的情感动机成分有关,如不愉快[22]。本文中左后岛叶、左侧颞叶的灰质改变都是外侧痛觉系统的一部分,而右侧前额叶是内侧痛觉系统的成分,因此我们推测内、外侧痛觉系统的损伤可能在慢性腰背痛疼痛识别及调节功能障碍上发挥作用。
基底神经节、丘脑、海马和杏仁核是皮层下结构的主要部分。丘脑-皮层-基底节环路是疼痛影响的主要环路[23]。在我们的研究中,灰质增加主要包括左侧丘脑、双侧壳核、双侧伏隔核、右侧尾状核。丘脑在调节皮层的疼痛信号输入上发挥着重要作用。本研究发现丘脑灰质增加,而有些文献发现丘脑灰质萎缩,样本的疼痛持续时间不同可能与这种分歧有关[5, 10]。尾状核和壳核是基底神经节的主要输入核团,接受几乎所有皮层区域的信息。伏隔核是大脑奖惩机制作用的场所,也被证明与急性疼痛过程有关[24]。伏隔核可能参与疼痛预期和疼痛缓解。慢性疼痛状态下尾状核形态学的异常已有相关的报道[25],我们发现CLBP右侧尾状核和双侧壳核灰质体积增加,推测与慢性疼痛状态下大脑对随意运动的控制缺陷有关。
MRI检测出的慢性疼痛脑灰质改变受到多种因素的影响。有研究表明,慢性疼痛的可逆变化可能与神经炎症,与突触结、树突、胶质细胞和/或神经元数量增加有关[26-27],这些可能导致磁共振检测到的灰质体积增加。微胶质和星形胶质细胞被证实参与疼痛的敏化和慢性化[28]。此外,慢性疼痛可能与学习和记忆密切相关。慢性疼痛是一种疼痛记忆的持续存在,有时无法区分最初的疼痛伤害和最新的疼痛刺激[29]。这些对所观察到的大脑形态学异常都可能有一定贡献。本文中慢性腰背痛大脑皮层灰质萎缩与疼痛强度、病程、认知和抑郁评分之间没有发现明显的相关性。大脑结构的改变是慢性疼痛引起的结果还是产生慢性疼痛的原因,仍存在争议[30]。
我们发现,慢性疼痛大脑新皮层灰质(不含皮层下结构)总体积明显小于健康被试,慢性腰背痛患者大脑皮层多个脑区的灰质体积明显小于健康被试,而皮层下部分核团的灰质体积明显大于健康被试,这种不同的灰质异常模式,可能是大脑不同脑区对慢性疼痛状态的一种适应不良的结果,确切的生物学机制尚不清楚。Kregel等人[31]对慢性腰背痛相关的脑磁共振研究进行了综述,认为慢性腰背痛大脑灰质、白质局部存在异常,而且在静息状态和给予疼痛刺激时大脑的功能连接存在异常,这些改变提示“疼痛矩阵”的活动异常,而慢性疼痛和神经可塑性改变的因果关系,仍需进一步的研究。
本研究的一个局限性是本文是横断面设计,不能研究大脑灰质形态学随时间发生的纵向变化。本文的样本量相对而言无法进行复杂的统计学分析及亚组分析,进一步的研究可以通过扩大样本量、纵向研究的方式观察慢性腰背痛大脑结构与功能的重组,将有助于我们全面了解慢性疼痛的中枢处理机制,进一步探索疼痛治疗的新策略。
我们的研究结果表明,慢性腰背痛大脑皮层和皮层下脑区存在不同的灰质异常模式,大脑皮层灰质体积减少,而皮层下灰质体积增加。多模态成像技术结合纵向研究有助于揭示慢性疼痛和这种神经可塑性变化的因果关系及潜在的生物学机制。
| [1] |
Baliki MN, Chialvo DR, Geha PY, et al. Chronic pain and the emotional brain: specific brain activity associated with spontaneous fluctuations of intensity of chronic back pain[J].
J Neurosci,2006, 26 (47) : 12165-73.
DOI: 10.1523/JNEUROSCI.3576-06.2006. ( 0) 0)
|
| [2] |
Davis KD, Moayedi M. Central mechanisms of pain revealed through functional and structural MRI[J].
J Neuroimmune Pharmacol,2013, 8 (3) : 518-34.
DOI: 10.1007/s11481-012-9386-8. ( 0) 0)
|
| [3] |
Kong J, Spaeth RB, Wey HY, et al. S1 is associated with chronic low back pain: a functional and structural MRI study[J].
Mol Pain,2013, 9 (10) : 43.
( 0) 0)
|
| [4] |
谢洪武, 罗天友, 陈日新, 等. 慢性疼痛患者静息态脑功能磁共振的默认网络研究[J].
生命科学研究,2011, 15 (6) : 502-6.
( 0) 0)
|
| [5] |
Apkarian AV, Sosa Y, Sonty S, et al. Chronic back pain is associated with decreased prefrontal and thalamic gray matter density[J].
J Neurosci,2004, 24 (46) : 10410-5.
DOI: 10.1523/JNEUROSCI.2541-04.2004. ( 0) 0)
|
| [6] |
张珊珊, 吴文, 刘自平, 等. 腰背痛患者静息态fMRI的脑功能局部一致性研究[J].
中华神经医学杂志,2013, 12 (5) : 506-10.
( 0) 0)
|
| [7] |
陈俊, 刘波, 叶泳松, 等. 慢性腰背痛患者的脑静息态功能磁共振成像[J].
中国医学影像技术,2011, 27 (6) : 1116-20.
( 0) 0)
|
| [8] |
张珊珊, 吴文. 慢性疼痛的脑机制及静息态功能性磁共振研究[J].
中国疼痛医学杂志,2013, 19 (2) : 102-5.
( 0) 0)
|
| [9] |
陈俊, 葛缅, 刘波, 等. 慢性疼痛性别差异的静息态脑功能成像研究[J].
中国疼痛医学杂志,2013, 19 (12) : 714-8.
( 0) 0)
|
| [10] |
Schmidt-Wilcke T, Leinisch E, G?nssbauer S, et al. Affective components and intensity of pain correlate with structural differences in gray matter in chronic back pain patients[J].
Pain,2006, 125 (1/2) : 89-97.
( 0) 0)
|
| [11] |
Melzack R. The short-form McGill Pain Questionnaire[J].
Pain,1987, 30 (2) : 191-7.
DOI: 10.1016/0304-3959(87)91074-8. ( 0) 0)
|
| [12] |
Jenkinson M, Beckmann CF, Behrens TE, et al. FSL[J].
Neuroimage,2012, 62 (2) : 782-90.
DOI: 10.1016/j.neuroimage.2011.09.015. ( 0) 0)
|
| [13] |
Smith SM, De Stefano N, Jenkinson M, et al. Normalized accurate measurement of longitudinal brain change[J].
J Comput Assist Tomogr,2001, 25 (3) : 466-75.
DOI: 10.1097/00004728-200105000-00022. ( 0) 0)
|
| [14] |
Ashburner J, Friston KJ. Voxel-Based morphometry—the methods[J].
Neuroimage,2000, 11 (6) : 805-21.
DOI: 10.1006/nimg.2000.0582. ( 0) 0)
|
| [15] |
Lorenz J, Minoshima S, Casey KL. Keeping pain out of mind: the role of the dorsolateral prefrontal cortex in pain modulation[J].
Brain,2003, 126 (Pt 5) : 1079-91.
( 0) 0)
|
| [16] |
Brooks JC, Tracey I. The insula: a multidimensional integration site for pain[J].
Pain,2007, 128 (1/2) : 1-2.
( 0) 0)
|
| [17] |
Bantick SJ, Wise RG, Ploghaus A, et al. Imaging how attention modulates pain in humans using functional MRI[J].
Brain,2002, 125 (Pt 2) : 310-9.
( 0) 0)
|
| [18] |
Gustin SM, Peck CC, Wilcox SL, et al. Different pain, different brain: thalamic anatomy in neuropathic and non-neuropathic chronic pain syndromes[J].
J Neurosci,2011, 31 (16) : 5956-64.
DOI: 10.1523/JNEUROSCI.5980-10.2011. ( 0) 0)
|
| [19] |
Robinson ME, Craggs JG, Price DD, et al. Gray matter volumes of pain-related brain areas are decreased in fibromyalgia syndrome[J].
J Pain,2011, 12 (4) : 436-43.
DOI: 10.1016/j.jpain.2010.10.003. ( 0) 0)
|
| [20] |
Valet M, Gündel H, Sprenger T, et al. Patients with pain disorder show gray-matter loss in pain-processing structures: a voxel-based morphometric study[J].
Psychosom Med,2009, 71 (1) : 49-56.
DOI: 10.1097/PSY.0b013e31818d1e02. ( 0) 0)
|
| [21] |
Schmidt-Wilcke T, Luerding R, Weigand T, et al. Striatal grey matter increase in patients suffering from fibromyalgia--a voxel-based morphometry study[J].
Pain,2007, 132 (Suppl 1) : S109-16.
( 0) 0)
|
| [22] |
Shackman AJ, Salomons TV, Slagter HA, et al. The integration of negative affect, pain and cognitive control in the cingulate cortex[J].
Nat Rev Neurosci,2011, 12 (3) : 154-67.
( 0) 0)
|
| [23] |
Alexander GE, Delong MR, Strick PL. Parallel organization of functionally segregated circuits linking basal ganglia and cortex[J].
Annu Rev Neurosci,1986, 9 (1) : 357-81.
DOI: 10.1146/annurev.ne.09.030186.002041. ( 0) 0)
|
| [24] |
Becerra L, Breiter HC, Wise R, et al. Reward circuitry activation by noxious thermal stimuli[J].
Neuron,2001, 32 (5) : 927-46.
DOI: 10.1016/S0896-6273(01)00533-5. ( 0) 0)
|
| [25] |
Mao CP, Bai ZL, Zhang XN, et al. Abnormal subcortical brain morphology in patients with knee osteoarthritis: a cross-sectional study[J].
Front Aging Neurosci,2016, 8 (10) : 3.
( 0) 0)
|
| [26] |
Deleo JA, Tanga FY, Tawfik VL. Neuroimmune activation and neuroinflammation in chronic pain and opioid tolerance/ hyperalgesia[J].
Neuroscientist,2004, 10 (1) : 40-52.
DOI: 10.1177/1073858403259950. ( 0) 0)
|
| [27] |
Watkins LR, Maier SF, Goehler LE. Immune activation: the role of pro-inflammatory cytokines in inflammation, illness responses and pathological pain states[J].
Pain,1995, 63 (3) : 289-302.
DOI: 10.1016/0304-3959(95)00186-7. ( 0) 0)
|
| [28] |
Chiang CY, Dostrovsky JO, Iwata K, et al. Role of glia in orofacial pain[J].
Neuroscientist,2011, 17 (3) : 303-20.
DOI: 10.1177/1073858410386801. ( 0) 0)
|
| [29] |
Apkarian AV, Baliki MN, Geha PY. Towards a theory of chronic pain[J].
Prog Neurobiol,2009, 87 (2) : 81-97.
DOI: 10.1016/j.pneurobio.2008.09.018. ( 0) 0)
|
| [30] |
Rodriguez-Raecke R, Niemeier A, Ihle K, et al. Brain gray matter decrease in chronic pain is the consequence and not the cause of pain[J].
J Neurosci,2009, 29 (44) : 13746-50.
DOI: 10.1523/JNEUROSCI.3687-09.2009. ( 0) 0)
|
| [31] |
Kregel J, Meeus M, Malfliet A, et al. Structural and functional brain abnormalities in chronic low back pain: A systematic review[J].
Semin Arthritis Rheum,2015, 45 (2) : 229-37.
DOI: 10.1016/j.semarthrit.2015.05.002. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
