心肌梗死是全世界范围内的主要死因[1],既往的冠脉支架置入治疗或搭桥治疗虽然能够挽救濒死的心肌细胞,但是已经坏死的心肌组织由纤维组织替代,大面积的梗死严重影响心脏功能和患者的生存质量,甚至导致患者死亡。干细胞移植被认为可以通过干细胞的多向分化潜能及旁分泌作用改善心梗后心脏功能而被认为是心肌梗死的潜在治疗手段[2]。在多种干细胞中,脂肪来源的间充质干细胞(ADSCs)因为取材方便,免疫原性弱等优势而得到关注[3]。但移植后的间充质干细胞往往因归巢率低等原因限制了治疗效果。SDF-1/CXCR-4信号通路在脂肪来源间充质干细胞归巢作用中扮演重要的角色[4]。受损的心肌细胞和内皮细胞释放SDF-1,间充质干细胞表面的CXCR-4受体与SDF-1结合而介导细胞向受损组织归巢。但是ADSCs表达CXCR-4水平较低,且随着细胞传代,其CXCR-4表达量逐渐减少[5]。如何提高ADSCs的CXCR-4表达水平,进而增强干ADSCs向受损心肌细胞的趋化性迁移能力至关重要。
胰高血糖素样肽1(GLP-1)是一种内源性胃肠肽,具有促进胰岛素分泌,降低血糖的作用,而艾塞那肽作为GLP-1受体激动剂现被应用于糖尿病患者的血糖控制治疗。此外,艾塞那肽还具促进ADSCs粘附及旁分泌等效应[6]。但艾塞那肽对ADSCs迁移的研究较少,而且艾塞那肽对SDF-1/CXCR-4是否有作用仍需进一步研究。
细胞骨架重组参与了间充质干细胞的迁移活动,而活化的Rho GTPase参与细胞骨架的重排和应力纤维的形成[7]。Rho蛋白属于小G蛋白超家族的亚家族成员,该亚家族包括Rho、Rac、Cdc42等成员。他们起到分子开关的作用,当其与GTP结合时发挥生物活性,与GDP结合而失活。Rho GTPase调节细胞骨架重组并广泛参与多种细胞的迁移和肿瘤细胞的转移。考虑到SDF-1/CXCR-4通路和细胞骨架重排在间充质干细胞迁移中的重要作用,我们推测Rho GTPase也参与了ADSCs的迁移过程,是SDF-1/CXCR-4通路的下游效应蛋白。
1 材料和方法 1.1 材料 1.1.1 实验动物健康雄性SPF级SD大鼠,体质量60~80 g,购自北京维通利华实验动物技术有限公司。
1.1.2 主要试剂低糖DMEM液体培养基、胎牛血清购自Hyclone公司;成脂、成骨诱导分化试剂盒购自Gibco公司;Ⅰ型胶原酶、艾塞那肽、重组大鼠SDF-1、AMD3100、CCG-1423、购自Sigma-Aldrich公司;FITC标记的CD90、CD34、CD45、CD29、CXCR-4流式抗体购自Bioss公司,CXCR-4小鼠来源一抗购自Abcam公司;0.25%胰蛋白酶、GAPDH小鼠来源一抗购自碧云天公司;活化的Rho蛋白pull-down检测试剂盒购自Thermo Fisher公司;PVDF膜购自Milipore公司;Transwell小室购自Corning公司;FITC标记的鬼笔环肽购自Alexis公司。
1.2 主要方法 1.2.1 ADSCs分离及培养颈椎脱位法处死SD大鼠,分离腹股沟处脂肪组织,经PBS清洗3遍后剪碎,配制0.05%胰酶和0.1%Ⅰ型胶原酶混合消化酶10 mL,剪碎后的脂肪组织和混合消化酶一同转移至锥形瓶中,加入磁力转子,在恒温磁力搅拌器上37℃搅拌消化,45 min后将10 mL完全培养基(DMEM含10% FBS,1%谷氨酰胺和双抗)加入锥形瓶中终止消化,200目筛网过滤后1000 g离心5 min,弃去上清液,使用完全培养基重悬细胞,接种至细胞培养瓶中。12 h后换液,弃去未贴壁细胞,以后每2 d换液1次,倒置显微镜观察贴壁细胞生长至80%融合后按照1:3比例传代培养。
1.2.2 流式细胞术及成脂成骨诱导分化鉴定培养至第4代的ADSC经胰酶消化后PBS清洗2遍后用300μL PBS重悬细胞。将FITC标记的CD90,CD34、CD45、CD29、CXCR-4抗体按照说明加入细胞悬液,室温避光孵育30 min后经流式细胞术检测细胞表面各个抗原表达水平。按照成脂、成骨诱导分化试剂盒说明诱导ADSCs分化,分别使用油红和茜素红染色观察诱导分化效果。
1.2.3 RTCA xCELLigence系统检测细胞增殖在E-Plate 96孔板中加入50μL完全培养基,然后将其放入RTCA station上,确保所有孔板细胞指数都低于0.063。取出E-Plate 96,每孔加入100μL细胞悬液,使每孔总计5×103个细胞,再次放到RTCA station上。细胞接种24 h后,在处理组加入20 nmol/L艾塞那肽,对照组加入等量PBS,放入RTCA station上继续观察24 h。设定每15 min自动测定1次,观察处理后24 h内细胞增殖情况。
1.2.4 Transwell趋化性迁移实验将细胞分为对照组,5 nmol/L艾塞那肽处理组,10 nmol/L处理组,20 nmol/L处理组,AMD3100阻断剂组及CCG-1423阻断剂组。按照分组加入对应浓度的艾塞那肽预处理12 h,阻断剂组先加20 nmol/L艾塞那肽预处理细胞12 h然后分别在无血清培养基条件下加入AMD3100(10μg/mL)、CCG-1423(100μmol/L)孵育60 min。每组各取100μL浓度为1×105/mL无血清细胞悬液加入Transwell小室的上室,下室均加入600μL无血清培养基和重组大鼠SDF-1(100 ng/mL)。将Transwell小室放入孵箱中迁移6 h,用棉签轻轻刮去上室未迁移细胞,PBS清洗3遍,将小室置入无水甲醇中室温固定15 min,然后使用0.1%结晶紫溶液染色15 min。PBS清洗3遍,洗去浮色。200×显微镜下观察,每组细胞随机选取5个视野计数穿膜细胞数量,该实验重复3次。
1.2.5 划痕实验ADSC接种至6孔板,分组方法和药物预处理方式同Transwell实验。用10μL枪头在细胞单层上轻轻划一条直线,保持划痕宽度一致,PBS清洗后加入无血清培养基和重组大鼠SDF-1(100 ng/mL),在相差倒置显微镜上记录初始划痕宽度。将细胞放入孵箱中培养10 h后再次记录在显微镜上记录划痕宽度。划痕实验重复3次。
1.2.6 Western blot使用Ripa和100:1蛋白酶抑制剂混合液裂解细胞,4℃离心后提取细胞裂解液,应用BCA试剂盒测量蛋白浓度。参照活化的Rho蛋白pull-down检测试剂盒说明书,使用GST-Rhotekin-RBD和谷胱甘肽亲和树脂捕获活化的Rho蛋白。上样50μg总蛋白至12% SDS-PAGE。蛋白被凝胶分离后转移至PVDF膜,在含3% BSA的TBST溶液中室温封闭120 min。TBST洗膜5 min,在含3% BSA的TBST溶液中分别加入CXCR-4抗体(1:250)Rho蛋白抗体(1:1000)及GAPDH抗体(1:1000),PVDF膜在抗体孵育液中4℃摇晃孵育过夜。孵育后的PVDF膜用TBST清洗5遍后在二抗封闭液中室温孵育1 h,再次用TBST洗膜后使用全自动化学发光成像分析系统检测蛋白条带。
1.2.7 共聚焦显微镜观察应力纤维形成将细胞接种至激光共聚焦培养皿中,分为对照组、20 nmol/L艾塞那肽处理组、AMD3100阻断剂组及CCG-1423阻断剂组,预处理方式同Transwell实验。4%多聚甲醛固定15 min,每皿加入150μL FITC标记的鬼笔环肽(5μg/mL),室温染色60 min。PBS清洗细胞3次。吸去多余水分,加入1滴含DAPI的荧光封片液封片,共聚焦显微镜下观察。Image-Pro plus图像处理软件测定平均荧光强度[mean density=(IOD SUM)(/area sum)]。
1.3 数据分析所有数据均以均数±标准差表示,并采用软件SPSS 21.0进行数据分析,GraphPad Prism 6.0做图。多组数据间差异采用单因素方差分析(ANOVA)分析,各组间的两两比较采用SNK-q检验,以P值 < 0.05为差异有统计学意义。
2 结果 2.1 流式细胞仪鉴定及诱导分化鉴定结果ADSC多呈长梭形,少数呈三角形或多边形。成脂诱导和成骨诱导后染色分别可见红色脂滴和钙沉积结节。流式细胞仪鉴定提示:ADSC阳性表达CD90及CD29,阳性表达率分别为98.2%和98.8%,阴性表达CD34,CD45,表达率均小于5%。结果与既往间充质干细胞表达的标志物相符(图 1)。
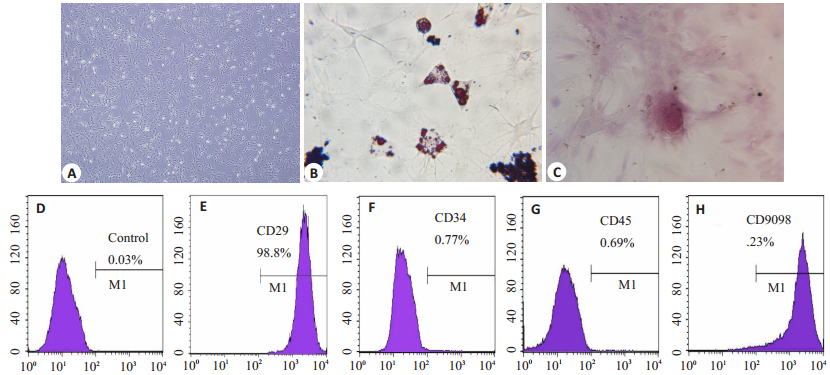
|
图 1 脂肪来源间充质干细胞鉴定 Figure 1 Identification of adipose-derived mesenchymal stem cells. A: Microscopic images of passage 3 ADSCs(Original magnification:×4); B (×20), C(×10): Induced ADSCs for adipogenic and osteoblastic differentiation in vitro; D-H: Flow cytometry for identification of the phenotype of ADSCs. |
xCELLigence通过特殊的96孔板下的微电路感应电阻变化,而电阻变化与贴壁细胞的数量呈正相关,软件将电阻值转化为细胞指数(CI)并自动生成细胞指数-时间曲线,CI值以均数±标准差的形式表示。细胞在3 h内贴壁并进入增殖平台期,8 h后开始快速增殖,在第24 h(图 2箭头示)药物组加入20 nmol/L艾塞那肽,对照组加入等量PBS。ADSCs的增殖能力在艾塞那肽处理前无差异,在艾塞那肽处理后24 h较对照组CI值略高,但仍无显著差异。所以艾塞那肽处理24 h内并不影响ADSC的增殖能力。
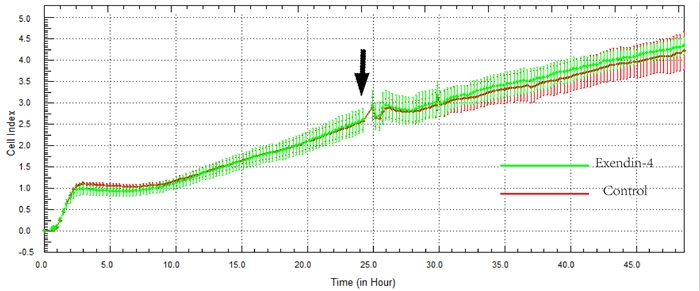
|
图 2 艾塞那肽处理对ADSCs增殖的影响 Figure 2 Effect of exenatide on ADSC proliferation. The arrow indicates the time point of exenatide pretreatment. |
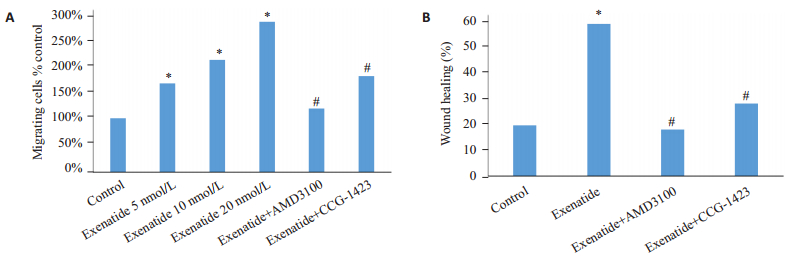
Transwell实验可以观察ADSCs由上室穿过8μm半透膜到达下室的数量,实验结果提示随着艾塞那肽浓度的提高,进入下室的细胞数量逐渐增多。应用CXCR-4特异性阻断剂AMD3100后,在AMD3100处理组观察到迁移到下室的细胞量明显减少。加入Rho GTPase阻断剂CCG-1423后,迁移到下室的ADSCs数量同样明显减少(图 3)。划痕实验结果表明,对照组细胞在划痕10 h仅有19%愈合,而艾塞那肽处理组在划痕10 h以后的愈合程度明显增加,达到57%,而AMD3100及CCG-1423阻断剂组明显降低了划痕的愈合程度,这些结果与Transwell结果相一致(图 4)。各组间穿膜细胞数和愈合程度有统计学差异(图 5)。
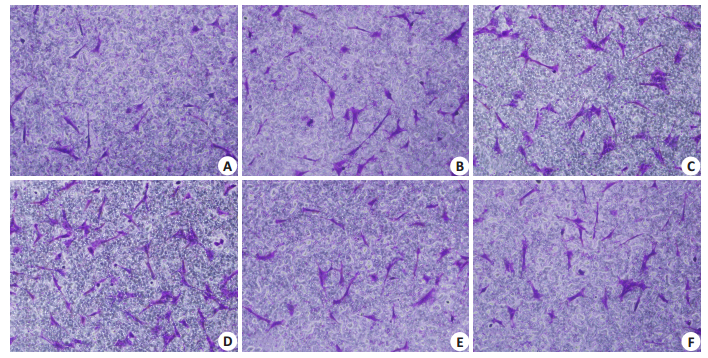
|
图 3 Transwell实验检测艾塞那肽对ADSCs的迁移影响 Figure 3 Transwell assay measures the effect of exenatide on ADSCs migration (Original magnification:×10). A: control group; B-C: Cells treated with exenatide at 5, 10, and 20 nmol/L, respectively; D: Exenatide(20 nmol/L) treatment group; E: AMD3100 treatment group; F: CCG-1423 treatment group. |
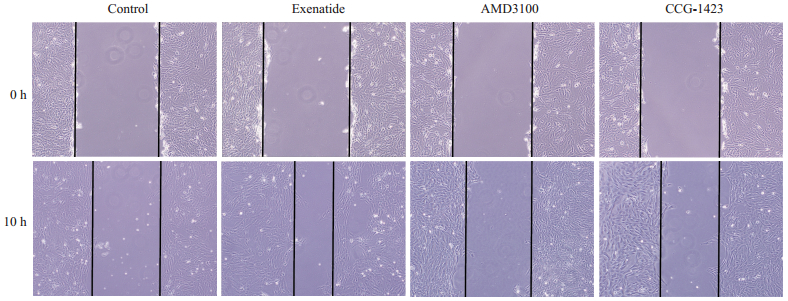
|
图 4 划痕实验检测艾塞那肽对ADSCs的迁移影响 Figure 4 Wound-healing assay measures the effect of exenatide on ADSCs migration (Original magnification:×4). |
|
图 5 Transwell及划痕实验结果分析 Figure 5 The statistic results of Transwell and wound-healing assay. Data are expressed as relative fold change compared with control value and shown as Mean±SD. A: Results of Transwell assay *P < 0.05 vs control. #P < 0.05 vs 20 nmol/L exenatide group; B: Results of wound healing assay. *P < 0.05 vs control. #P < 0.05 vs exenatide group. |
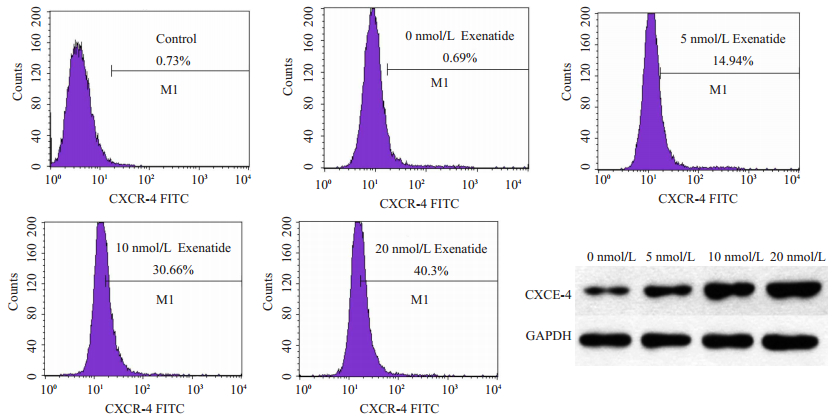
采用流式细胞术和Western blot检测不同浓度艾塞那肽处理后,ADSCs CXCR-4表达情况。流式结果表明,未经处理的第3代ADSCs表达CXCR-4较少。而艾塞那肽处理后,细胞CXCR-4表达量呈浓度依赖式上调(表达量由未处理的6.9%上调至40.3%)。对Western blot条带进行灰度值分析,CXCR-4条带相对灰度值由未经处理的30%上升至90%。所以,Western blot结果同样证实了艾塞那肽可浓度依赖性地增强ADSCs CXCR-4表达水平(图 6)。
|
图 6 流式细胞术和Western blot检测CXCR-4表达 Figure 6 Expression of CXCR-4 detected by flow cytometry and Western blotting. |
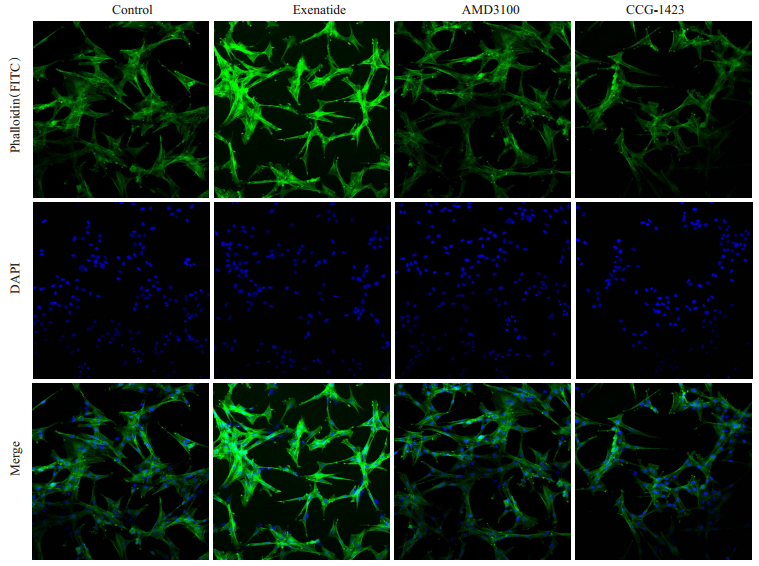
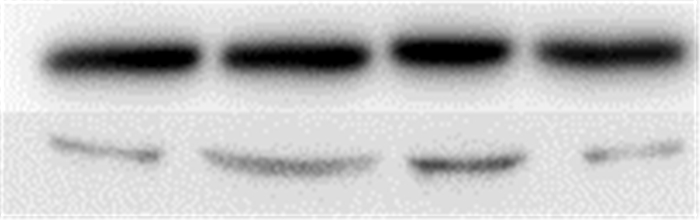
活化的Rho蛋白参与细胞的应力纤维形成,参与多种细胞的迁移运动。应用激光共聚焦显微镜观察并通过Image pro plus软件分析应力纤维平均荧光强度,结果表明未经处理的ADSCs应力纤维平均荧光强度为0.09,经过20 nmol/L艾塞那肽处理后平均荧光强度为0.12。AMD3100和CCG-1423处理后,平均荧光强度又分别降至0.09和0.08(图 7)。这表明艾塞那肽处理后的ADSCs应力纤维形成增多,AMD3100及CCG-1423可抑制应力纤维形成。活化的Rho蛋白pull-down实验联合Western blotting表明,ADSCs经过艾塞那肽处理后Rho GTPase表达增强,并且Rho GTPase的表达可以被AMD3100所抑制(图 8)。这都提示Rho GTPase是SDF-1/CXCR-4通路的下游效应蛋白。
|
图 7 共聚焦显微镜观察细胞应力纤维形成 Figure 7 Formation of stress fiber observed by laser scanning confocal microscopy (Original magnification:×10). |
|
图 8 Western blot检测Rho GTPase与SDF-1/CXCR-4通路的关系 Figure 8 The relation between Rho GTPase and SDF-1/ CXCR-4 pathway was detected by Western blot. |
干细胞移植虽然为心肌梗死和心衰患者提供了潜在的治疗手段,但是有效的干细胞心梗区域归巢肯定是干细胞发挥作用的前提。目前采用的干细胞移植方式包括冠脉内注射,心肌内注射和外周静脉注射,后两种注射方式,尤其经外周静脉注射方式,面临干细胞注射后归巢率低的问题,移植疗效会受到抑制[8],心肌内注射途径虽然能够提高归巢率但患者需承受开胸手术注射干细胞无疑给患者带来了巨大的创伤。研究报道SDF-1/CXCR-4通路在干细胞归巢中发挥了重要作用,针对该通路,转基因技术及药物干预等多种方法被采用以提高受损组织分泌SDF-1或上调干细胞表面CXCR-4的表达[4, 9-10]。
本研究采用艾塞那肽干预ADSCs,并通过Transwell实验证实ADSCs的迁移作用能够被艾塞那肽增强,而且迁移的过程排除了艾塞那肽对ADSCs增殖能力的影响。因为整个迁移过程持续6 h,而RTCA xCELLigence系统证实在24 h内,艾塞那肽干预组同对照组相比,ADSCs的增殖能力并未发生显著差异。RTCA xCELLigence系统测量细胞增殖能力较既往的MTT或BrdU等方法具有更好的准确性和客观性。既往团队报道Exendin-4具有促进ADSCs迁移的作用,其机制是通过PI3K/Akt途径上调CXCR-4的表达,但并未对SDF-1/CXCR-4通路的下游作用机制做进一步探究[11]。本研究也通过Western和流式细胞术证实艾塞那肽具有类似的作用,而且认为Rho GTPase为SDF-1/CXCR-4的下游效应蛋白。Rho GTPase被认为在多种细胞的迁移过程中起到关键作用,例如:Gouёffic等[12]在平滑肌细胞中证实活化的Rho蛋白参与平滑肌细胞的迁移活动;Shen等[13]也猜想SDF-1/CXCR4通路和Rho蛋白在内皮细胞的迁移过程中发挥重要作用。而本研究也首次把Rho GTPase和ADSCs联系起来,并认为SDF-1作用于CXCR-4受体后通过激活Rho蛋白促使细胞应力纤维形成,介导骨架重组而促进ADSCs的迁移。
因为活化的Rho蛋白与应力纤维形成相关,而鬼笔环肽能特异性结合应力纤维[12],所以该研究采用FITC标记的鬼笔环肽将ADSCs中的应力纤维染色,激光共聚焦纤维镜下观察应力纤维的变化情况来推测Rho GTPase是否为CXCR-4的效应蛋白,特异性Rho GTPase抑制剂CCG-1423也被用来反向证实猜想。因为Rho蛋白与GTP结合才发挥生物学作用,与GDP结合就会失活,要捕捉到活化的Rho蛋白形式,需采用Pull-Down实验捕捉Rho蛋白同GTP结合的活化形式,最后通过Western验证其表达[14]。
本研究仅仅在体外环境下证实艾塞那肽具有促进ADSCs向SDF-1趋化性迁移的能力,缺乏动物水平的验证。毕竟在体的归巢机制比体外的迁移机制要复杂的多,受影响的因素也更多,例如ADSCs在心肌梗死部位的驻留不止取决于ADSCs的趋化性迁移,同时与细胞在损伤部位的粘附能力及梗死微环境下存活等能力相关[15-16]。同时,本研究只提出Rho GTPase在ADSCs中是SDF-1/CXCR-4通路的下游,但并未对完整的下游作用机制进行探究。例如在多种细胞迁移过程中,Rho蛋白激酶(ROCK)是Rho GTPase的下游蛋白[17],而本研究并未对ROCK是否参与ADSCs迁移进行探究,而这也为进一步研究ADSCs迁移提供了方向。
总之,艾塞那肽能够增强ADSCs的趋化性迁移能力,Rho GTPase为SDF-1/CXCR-4的下游效应蛋白。Rho GTPase有可能成为一个新的ADSCs移植干预靶点,以提高ADSCs的移植效率。
| [1] |
Reddy K, Khaliq A, Henning RJ. Recent advances in the diagnosis and treatment of acute myocardial infarction[J].
World J Cardiol,2015, 7 (5) : 243-76.
DOI: 10.4330/wjc.v7.i5.243. ( 0) 0)
|
| [2] |
Martin-Rendon E, Brunskill S, Doree C, et al. Stem cell treatment for acute myocardial infarction[J].
Cochrane Database Syst Rev,2008 (4) : CD006536.
( 0) 0)
|
| [3] |
Naderi N, Combellack EJ, Griffin M, et al. The regenerative role of adipose-derived stem cells (ADSC) in plastic and reconstructive surgery[J]. Int Wound J, 2016 Feb 1. doi: 10.1111/iwj.12569.[Epub ahead of print]
( 0) 0)
|
| [4] |
Cai A, Qiu R, Li L, et al. Atorvastatin treatment of rats with ischemia-reperfusion injury improves adipose-derived mesenchymal stem cell migration and survival via the SDF-1α/CXCR-4 axis[J].
PLoS One,2013, 8 (12) : e79100.
DOI: 10.1371/journal.pone.0079100. ( 0) 0)
|
| [5] |
Li Q, Zhang A, Tao C, et al. The role of SDF-1-CXCR4/CXCR7 axis in biological behaviors of adipose tissue-derived mesenchymal stem cells in vitro[J].
Biochem Biophys Res Commun,2013, 441 (3) : 675-80.
DOI: 10.1016/j.bbrc.2013.10.071. ( 0) 0)
|
| [6] |
Liu J, Wang H, Wang Y, et al. Exendin-4 pretreated adipose derived stem cells are resistant to oxidative stress and improve cardiac performance via enhanced adhesion in the infarcted heart[J].
PLoS One,2014, 9 (6) : e99756.
DOI: 10.1371/journal.pone.0099756. ( 0) 0)
|
| [7] |
Ryu JM, Han HJ. Autotaxin-LPA axis regulates hMSC migration by adherent junction disruption and cytoskeletal rearrangement via LPAR1/3-dependent PKC/GSK3β/β-catenin and PKC/Rho GTPase pathways[J].
Stem Cells,2015, 33 (3) : 819-32.
DOI: 10.1002/stem.1882. ( 0) 0)
|
| [8] |
Freyman T, Polin G, Osman H, et al. A quantitative, randomized study evaluating three methods of mesenchymal stem cell delivery following myocardial infarction[J].
Eur Heart J,2006, 27 (9) : 1114-22.
( 0) 0)
|
| [9] |
Guo J, Lin G, Bao C, et al. Insulin-like growth factor 1 improves the efficacy of mesenchymal stem cells transplantation in a rat model of myocardial infarction[J].
J Biomed Sci,2008, 15 (1) : 89-97.
( 0) 0)
|
| [10] |
Segers VF, Tokunou T, Higgins LJ, et al. Local delivery of protease-resistant stromal cell derived factor-1 for stem cell recruitment after myocardial infarction[J].
Circulation,2007, 116 (15) : 1683-92.
DOI: 10.1161/CIRCULATIONAHA.107.718718. ( 0) 0)
|
| [11] |
Zhou H, Yang J, Xin T, et al. Exendin-4 enhances the migration of adipose-derived stem cells to neonatal rat ventricular cardiomyocyte-derived conditioned medium via the phosphoinositide 3-kinase/Akt-stromal cell-derived factor-1α/CXC chemokine receptor 4 pathway[J].
Mol Med Rep,2015, 11 (6) : 4063-72.
( 0) 0)
|
| [12] |
Gou?ffic Y, Guilluy C, Guérin P, et al. Hyaluronan induces vascular smooth muscle cell migration through RHAMM-mediated PI3K-dependent Rac activation[J].
Cardiovasc Res,2006, 72 (2) : 339-48.
DOI: 10.1016/j.cardiores.2006.07.017. ( 0) 0)
|
| [13] |
Shen L, Gao Y, Qian J, et al. A novel mechanism for endothelial progenitor cells homing: The SDF-1/CXCR4-Rac pathway May regulate endothelial progenitor cells homing through cellular polarization[J].
Med Hypotheses,2011, 76 (2) : 256-8.
DOI: 10.1016/j.mehy.2010.10.014. ( 0) 0)
|
| [14] |
Ren XD, Kiosses WB, Schwartz MA. Regulation of the small GTP-binding protein Rho by cell adhesion and the cytoskeleton[J].
EMBO J,1999, 18 (3) : 578-85.
DOI: 10.1093/emboj/18.3.578. ( 0) 0)
|
| [15] |
Shafiq M, Jung Y, Kim SH. Insight on stem cell preconditioning and instructive biomaterials to enhance cell adhesion, retention, and engraftment for tissue repair[J].
Biomaterials,2016, 90 : 85-115.
DOI: 10.1016/j.biomaterials.2016.03.020. ( 0) 0)
|
| [16] |
Zhang Z, Yang M, Wang Y, et al. Autophagy regulates the apoptosis of bone marrow-derived mesenchymal stem cells under hypoxic condition via AMP-activated protein kinase/mammalian target of rapamycin pathway[J].
Cell Biol Int,2016, 40 (6) : 671-85.
DOI: 10.1002/cbin.v40.6. ( 0) 0)
|
| [17] |
Ryan CM, Brown JA, Bourke E, et al. ROCK activity and the Gβγcomplex mediate chemotactic migration of mouse bone marrowderived stromal cells[J].
Stem Cell Res Ther,2015, 6 : 136.
DOI: 10.1186/s13287-015-0125-y. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
