2 南方医科大学南方医院医务处;
3 南方医科大学南方医院耳鼻咽喉头颈外科,广东 广州 510515
2 Nanfang Hospital, Southern Medical University, Medical Service Administration Office;
3 Department of Otolaryngology-Head and Neck Surgery, Nanfang Hospital, Southern Medical University, Guangzhou 510515, China
鼻咽癌是我国南方及东南亚地区一种常见的恶性肿瘤,临床以低分化、高转移为主要特征,临床上75%~90%的鼻咽癌病人初诊时已是局部晚期并发生颈部淋巴结转移[1]。尽管以调强放疗技术为主的放化疗综合治疗使鼻咽癌的局控率有明显提高,但目前临床上仍无法对鼻咽癌转移进行早期预测和有效干预,其远处转移率和总体生存率并没有显著改观,一旦复发或转移则预后较差,平均中位生存期只有5~11个月[2],远处转移仍是病人死亡的主要原因。因此,全面解析鼻咽癌转移的分子机制,积极寻求切实有效且安全可靠的治疗新途径,是有效控制鼻咽癌转移从而提高患者生存率的关键。
内皮素(endothelin,ET)是一种由内皮细胞合成的具有强烈收缩血管作用的生物活性肽,包括3种亚型,即ET-1、ET-2和ET-3,其中以ET-1的生物活性最强[3]。近几年的研究证实ET-1的表达失调参与了多种肿瘤的发病机制,在肿瘤进展、转移和新生血管形成中发挥重要作用[4]。在前期研究中我们发现ET-1在鼻咽癌细胞和组织中高表达,其表达水平与鼻咽癌临床分期呈正相关,临床分期越晚则表达越高,并促进鼻咽癌新生血管形成[5]。然而,ET-1表达失调对鼻咽癌细胞增殖、运动及转移等生物学特性的影响却鲜有报道。本研究通过慢病毒干扰ET-1并探讨ET-1表达失调对鼻咽癌细胞增殖、迁移及侵袭能力的影响。
1 材料和方法 1.1 材料鼻咽癌细胞5-8F和腺病毒转染人胚肾上皮细胞株293T保存于南方医科大学南方医院耳鼻咽喉头颈肿瘤实验室。慢病毒包装系统由南方医科大学肿瘤研究所肖广惠教授惠赠,该系统包括pLVTHM、psPAX2 和pMD2.G三个质粒。MTT购自美国Sigma公司。ET-1、E-cadherin、CK18、vimentin、和N-cadherin 以及内参基因GAPDH抗体均购自美国Cell Signaling Technology(CST)公司。
1.2 方法 1.2.1 细胞培养鼻咽癌细胞株5-8F采用含10%胎牛血清的RPMI 1640培养基,293T细胞采用含10%胎牛血清的DMEM培养基,在37 ℃、5% CO2、饱和湿度的条件下传代培养,细胞生长状态良好时用于实验。
1.2.2 shRNA-ET-1慢病毒包装以及干扰效率检测干扰载体选用pLVTMH慢病毒表达载体,RNAi设计采用Invitrogen公司提供的在线网站设计。根据Invitrogen公司在线RNAi设计系统,设计ET-1基因的shRNA干扰序列如下:
sense: 5'-CACCGCTCGTCCCTGATGGATAAAGCGAACTTTATCCATCAGGGACGAGC-3'
antisense:5'-AAAAGCTCGTCCCTGATGGATAAAGTTCGCTTTATCCATCAGGGACGAGCGTCCC-3'。
序列引物为上海英骏生物技术公司合成。将寡核苷酸退火形成双链,与经内切酶ClaⅠ和MluⅠ双酶切后的pLVTHM载体进行重组,重组产物进行测序鉴定。重组质粒构建成功后,将shRNA-ET-1 与辅助质粒psPAX2和pMD2.G共转染293T细胞,72 h收集病毒上清,感染鼻咽癌5-8F细胞。空载病毒感染的5-8F细胞作为阴性对照,未感染慢病毒的5-8F细胞作为空白对照。将细胞扩大培养后经流式细胞仪分选富集GFP阳性细胞,Western blot检测ET-1干扰效率。
1.2.3 MTT实验以每孔1×103细胞接种于96孔培养板中,每孔体积200 μL,每组设4 个复孔,同时设空白对照。在分别培养24、48、72、96 h后,每孔加入5 mg/mL的MTT 20 μL,37 ℃培养4 h。弃去培养基,发现有紫蓝色结晶物出现后加入150 μL DMSO。室温避光摇床振荡10 min,使结晶物充分溶解。以空白孔为对照,用酶标仪490 nm波长测定各孔吸光度值(A值)。重复3次,绘制生长曲线。
1.2.4 细胞周期检测采用碘化丙锭(propidium iodide,PI)单染法检测细胞周期分布。将细胞固定、Rnase A消化、PI染色后,流式细胞仪检测。
1.2.5 平板克隆形成实验接种200个细胞到6孔板中,保证细胞分散均匀,培养2周。出现肉眼可见的细胞克隆时,终止培养,弃去培养基,甲醇固定后结晶紫染色,显微镜下计数形成的克隆数(≥50个细胞为一个克隆)。平板克隆形成率=形成克隆数/接种细胞数×100%。
1.2.6 裸鼠皮下成瘤实验分别将干扰ET-1 的5-8F/shRNA-ET-1和对照组细胞5-8F/plVTHM随机接种于10只裸鼠后背部皮下,接种细胞数为5×105,每组包括5只。每两天用游标卡尺测量肿瘤的长短径一次,按如下公式计算肿瘤体积:V=(D×d2)/2,其中D代表肿瘤最长径,而d代表肿瘤最短径。待肿瘤体积超过500 mm3,将实验动物处死。
1.2.7 Transwell小室细胞运动实验本实验所用Transwell小室购自美国Corning公司,小室内膜材料为聚碳酸酯(polycarbonate,PC),小室孔径为8.0 μm。将生长状态良好的细胞重悬于无血清的RPMI 1640培养基中,调整密度为5×105/mL,每个内室中加入100 μL(即5×104细胞),下室加入500 μL含10%胎牛血清的完全培养基作为细胞迁移运动的趋化因子。37 ℃培养18 h,取出小室,用棉签小心擦尽未穿过膜的细胞,甲醇固定15 min,结晶紫浸泡染色20 min,蒸馏水冲洗数次,空气中风干。显微镜下随机选取5个高倍视野计数穿过膜的细胞数。重复3次。
1.2.8 体外侵袭实验本实验所用Boyden小室购自美国Chemicon公司,室孔径为8.0 μm。在内室中加300 μL无血清培养基,37 ℃培养箱中孵育1~2 h,使ECMatrix层亲水。细胞经胰酶消化后制成单细胞悬液,调整浓度为1×106/mL,加200 μL细胞悬液于内室,加500 μL完全培养基于下室,37 ℃培养24 h。取出小室,用棉签小心擦尽未穿过膜的细胞,甲醇固定15 min,结晶紫浸泡染色20 min,蒸馏水冲洗数次,空气中风干。显微镜下随机选取5 个高倍视野计数穿过ECMatrix 膜的细胞数,重复3次。
1.2.9 Western blotting分析采用RIPA裂解液抽提细胞总蛋白,BCA法进行蛋白浓度测定。取等量蛋白样品进行SDS-PAGE电泳,恒压将蛋白转至PVDF膜,将膜在含5%脱脂奶粉的TBST溶液中封闭l h,加入稀释后的一抗4 ℃孵育过夜,二抗孵育1 h,ECL试剂盒进行化学发光检测。
1.3 统计学处理采用SPSS 13.0统计软件,数据以均数±标准差表示。单因素方差分析用于三组细胞增殖、迁移和侵袭能力的差异比较,多重比较采用LSD法。P<0.05认为差异具有统计学意义。
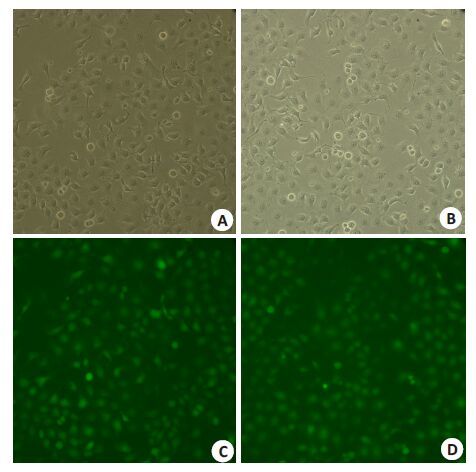
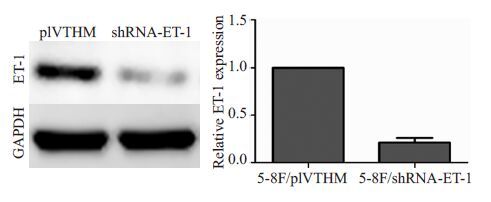
2 结果2.1 慢病毒感染5-8F细胞后ET-1的表达将shRNA-ET-1和空载慢病毒分别转染5-8F细胞,扩大培养后经流式细胞仪分选,其GFP阳性率均达到95%以上(图1)。荧光定量PCR检测发现,干扰效率可达85.4%,同样Western blotting结果也显示,ET-1蛋白在干扰组的表达显著下降(图2)。
|
图1 慢病毒感染后的5-8F细胞 Fig.1 Lentivirus-infected 5-8F cells. A: 5-8F/plVTHM cells under visible light; B: 5-8F/shRNA-ET-1 cells under visible light; C: 5-8F/ plVTHM cells under green fluorescence; D: 5-8F/shRNA-ET-1 cells under green fluorescence. |
|
图2 Western blot检测慢病毒感染5-8F细胞后ET-1蛋白水平表达的改变 Fig.2 Expression of ET-1 in lentivirus-infected 5-8F cells detected with Western blotting. |
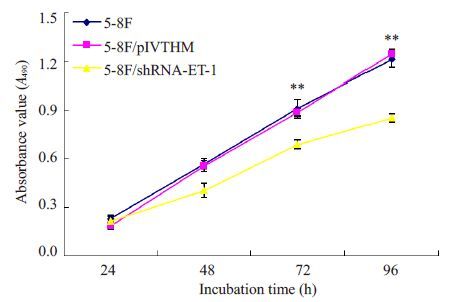
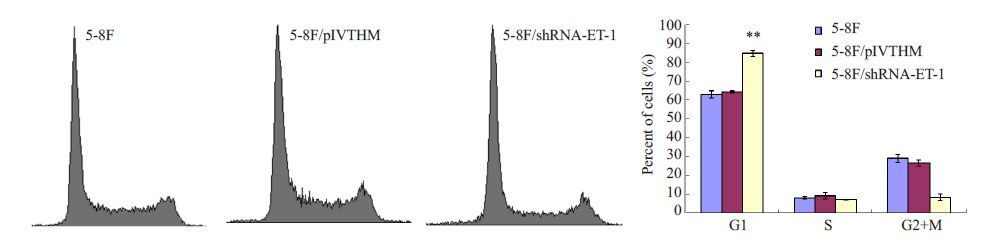
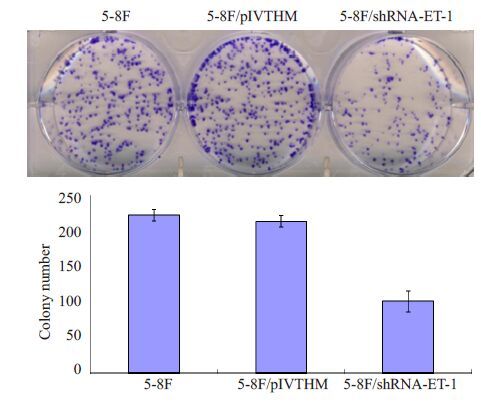
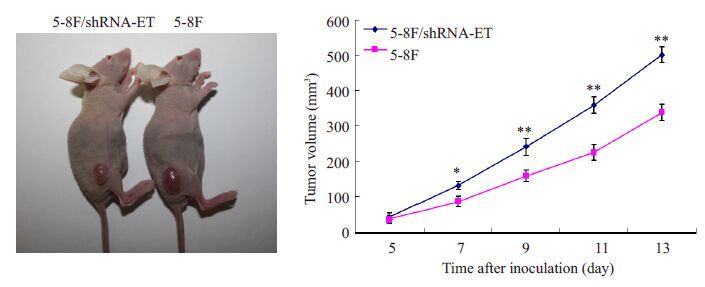
我们利用MTT实验,检测ET-1表达改变对鼻咽癌细胞增殖能力的影响。与对照组pLVTHM细胞和空白组5-8F 细胞相比,在干扰ET-1 表达后,在第72 小时5-8F细胞的增殖能力显著降低,差异具有统计学意义(P<0.01,图3),而对照组与空白组5-8F细胞的增殖能力无显著差异(P>0.05)。流式细胞仪检测细胞周期显示,干扰ET-1表达后G1期细胞数明显增多(P<0.01,图4)。平板克隆形成实验结果显示,ET-1 表达降低后5-8F细胞的克隆形成率降低60%(P<0.01,图5)。此外,我们还将干扰ET-1表达的癌细胞5-8F/shRNA-ET-1接种裸鼠皮下,建立鼻咽癌异位移植瘤模型,进一步研究干扰ET-1对鼻咽癌细胞体内成瘤能力的影响。结果表明,接种后第7 天成瘤能力出现显著性差异,5-8F/shRNA-ET-1 细胞所形成的肿瘤体积显著小于对照细胞(P<0.01,图6)。至第13 天,接种5-8F/shRNA-ET-1细胞形成的肿瘤体积比对照组细胞的肿瘤体积降低33%(P<0.01,图6)。
|
图3 干扰ET-1 表达可显著降低鼻咽癌细胞5-8F的增殖能力 Fig.3 Silencing of ET-1 expression suppresses proliferation of 5-8F cells. **P<0.01 vs 5-8F, 5-8F/pIVTHM. |
|
图4 干扰ET-1表达后G1期细胞明显增多 Fig.4 Silencing of ET-1 suppresses cell growth by inducing G1 cell cycle arrest. **P<0.01 vs 5-8F, 5-8F/pIVTHM. |
|
图5 干扰ET-1表达可显著降低鼻咽癌细胞5-8F的克隆形成能力 Fig.5 Silencing of ET-1 suppressed colony formation ability of 5-8F cells. **P<0.01 vs 5-8F, 5-8F/pIVTHM. |
|
图6 干扰ET-1表达可显著降低鼻咽癌细胞5-8F的体内成瘤能力 Fig.6 Silencing of ET-1 suppresses in vivo tumor formation by 5-8F cells. **P<0.01 vs 5-8F, 5-8F/pIVTHM. |
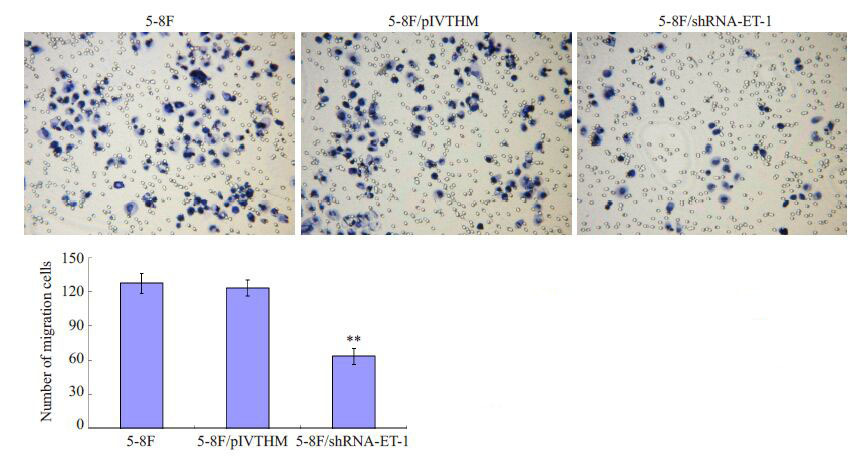
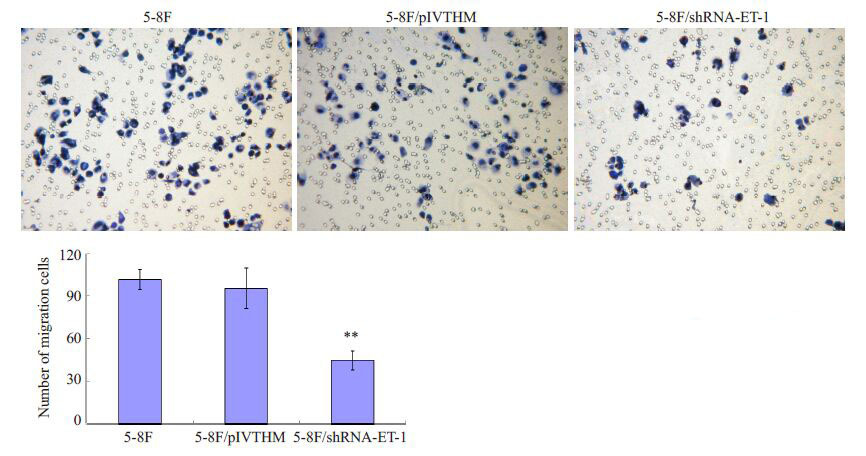
我们利用Transwell 和Boyden 小室分别检测了ET-1 基因对鼻咽癌细胞迁移和侵袭能力的影响。Transwell小室结果显示,与对照组及空白组细胞相比,ET-1表达沉默可显著抑制鼻咽癌细胞的迁移能力,差异具有统计学意义(P<0.01,图7)。Bodyen小室结果同样表明,ET-1表达降低可显著抑制鼻咽癌细胞的侵袭能力,差异具有统计学意义(P<0.01,图8)。
|
图7 干扰ET-1 表达可显著降低鼻咽癌细胞的迁移能力 Fig.7 Silencing of ET-1 suppresses the migratory ability of 5-8F cells. **P<0.01 vs 5-8F, 5-8F/pIVTHM. |
|
图8 干扰ET-1表达可显著降低鼻咽癌细胞的侵袭能力 Fig.8 Silencing of ET-1 suppressed the invasive ability of 5-8F cells. **P<0.01. |
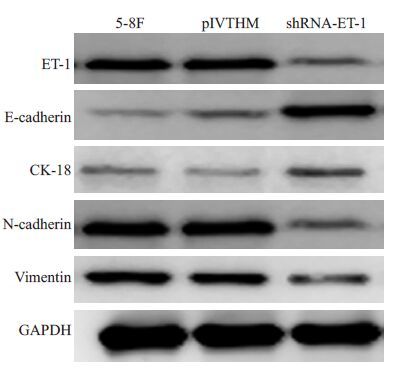
如图9所示,干扰ET-1表达后,与空白组和阴性对照组相比,ET-1干扰后可上调上皮标志物E-cadherin和CK18 的表达,而下调间质标志物N-cadherin 和vimentin的表达。
|
图9 干扰ET-1表达可调控EMT相关蛋白表达改变 Fig.9 Silencing of ET-1 regulates the expressions of EMT-related proteins. |
ET-1是迄今为止发现的活性最强的缩血管活性短肽,不仅具有强大的缩血管、加强心肌和平滑肌收缩以及促进神经内分泌功能,还是一类强大的促分化剂和细胞生长因子,可促进细胞有丝分裂,并参与多种肿瘤的发病机制,包括前列腺癌、乳腺癌、黑色素瘤、卵巢癌等,其表达失调可调控肿瘤细胞的增殖、上皮间充质转化、新生血管形成、化疗耐药及肿瘤浸润转移。在多种肿瘤中,ET-1高表达可作为预后不良的独立指标[6]。尽管在其他多种实体瘤中ET-1的研究已非常深入透彻,然而在鼻咽癌中关于ET-1 的表达、功能及机制仍知之甚少。Mai等的研究报道在晚期鼻咽癌患者治疗前血浆中ET-1浓度要高于正常对照,且血浆中高ET-1浓度可作为预测晚期鼻咽癌预后较差的一个独立指标[7]。该课题组随后报道内皮素1受体(ETAR)基因多态性可作为局部晚期鼻咽癌患者预后预测的独立指标[8]。Luo等[9]研究发现ETAR可通过上调CXCR4表达促进鼻咽癌细胞迁移。然而,迄今为止,尚没有任何相关研究报道ET-1在鼻咽癌的生物学功能及分子机制。
在前期研究中,我们发现ET-1在鼻咽癌细胞和组织中高表达,且其表达水平与临床分期呈正相关,临床分期越晚则组织标本中ET-1表达越高。细胞实验结果表明ET-1可促进鼻咽癌新生血管形成[5]。在本研究中,我们采用慢病毒包装系统干扰ET-1表达,通过MTT实验、细胞周期检测、平板克隆形成实验、裸鼠皮下成瘤实验、细胞运动和侵袭实验,探讨ET-1表达失调对鼻咽癌细胞增殖、迁移和侵袭能力的影响。结果显示干扰ET-1表达可显著抑制鼻咽癌细胞的增殖和迁移侵袭能力,提示ET-1在鼻咽癌发病机制中扮演候选癌基因的角色,与卵巢癌[10]、黑色素瘤[11]、乳腺癌[12]等的研究结果一致。
前期研究报道,ET-1 可通过与β-catenin 信号通路以及HIF1α信号通路相互作用,影响下游MMP2、CCND1、AXIN2以及VEGF的表达,调控肿瘤细胞的侵袭和转移[4]。在乳腺癌中,ET-1过表达可通过激活HGF活化下游Wnt/β-catenin通路促进乳腺癌骨转移[13]。在卵巢癌中,ET-1 通过与其受体ETAR 结合后活化β-arrestin通路促进癌细胞浸润转移[14]。在本研究中,我们发现ET-1干扰后可上调上皮标志物E-cadherin和CK18的表达,而下调间质标志物N-cadherin和vimentin的表达,该结果提示ET-1对鼻咽癌细胞的促侵袭能力与上皮间质转化有关。早在2005年,Rosanò等[15]的研究发现在卵巢癌中,ET-1/ETAR自分泌通路可诱导癌细胞发生EMT,下调E-cadherin 表达,而上调β-catenin、Snail以及其他间质标志物,促进癌细胞浸润转移。此外,在黑色素瘤中也有类似ET-1 诱导EMT促进肿瘤转移的相关报道[16]。在鼻咽癌中我们也有类似发现,但ET-1诱导EMT的具体机制尚不明确,有待进一步深入研究。
综上所述,干扰ET-1可抑制鼻咽癌细胞的增殖、迁移和浸润能力,与调控上皮间质转化相关基因的表达有关,更为详尽的机制有待进一步实验证实。
| [1] |
Razak AR, Siu LL, Liu FF, et al. O'sullivan B,Chan K. nasopharyngeal carcinoma:the next challenges[J]. Eur J Cancer, 2010, 46(11): 1967-78. ( 1) 1)
|
| [2] |
Chan AT, Hsu MM, Goh BC, et al. Phase II study of cetuximab in combination with carboplatin in patients with recurrent or metastatic nasopharyngeal carcinoma[J]. J Clin Oncol, 2005, 23 (15): 3568-76. ( 1) 1)
|
| [3] |
Nelson J, Bagnato A, Battistini B, et al. The endothelin axis: emerging role in cancer[J]. Nat Rev Cancer, 2003, 3(2): 110-6. ( 1) 1)
|
| [4] |
Rosanò L, Spinella F, Bagnato A. Endothelin 1 in cancer: biological implications and therapeutic opportunities[J]. Nat Rev Cancer, 2013, 13(9): 637-51. ( 2) 2)
|
| [5] |
Lu J, Zhao FP, Peng Z, et al. EZH2 promotes angiogenesis through inhibition of miR-1/Endothelin-1 axis in nasopharyngeal carcinoma [J]. Oncotarget, 2014, 5(22): 11319-32. ( 2) 2)
|
| [6] |
Grant K, Loizidou M, Taylor I. Endothelin-1: a multifunctional molecule in cancer[J]. Br J Cancer, 2003, 88(2): 163-6. ( 1) 1)
|
| [7] |
Mai HQ, Zeng ZY, Zhang CQ, et al. Elevated plasma big ET-1 is associated with distant failure in patients with advanced-stage nasopharyngeal carcinoma[J]. Cancer, 2006, 106(7): 1548-53. ( 1) 1)
|
| [8] |
Wen YF, Qi B, Liu H, et al. Polymorphisms in the endothelin-1 and endothelin a receptor genes and survival in patients with locoregionally advanced nasopharyngeal carcinoma[J]. Clin Cancer Res, 2011, 17(8): 2451-8. ( 1) 1)
|
| [9] |
Luo DH, Chen QY, Liu H, et al. The Independent, unfavorable prognostic factors endothelin A receptor and chemokine receptor 4 have a close relationship in promoting the motility of nasopharyngeal carcinoma cells via the activation of AKT and MAPK pathways[J]. J Transl Med, 2013, 11: 203. ( 1) 1)
|
| [10] |
Rosanò L, Spinella F, Di Castro V, et al. Integrin-linked kinase functions as a downstream mediator of endothelin-1 to promote invasive behavior in ovarian carcinoma[J]. Mol Cancer Ther, 2006, 5(4): 833-42. ( 1) 1)
|
| [11] |
Bagnato A, Rosanò L, Spinella F, et al. Endothelin B receptor blockade inhibits dynamics of cell interactions and communications in melanoma cell progression[J]. Cancer Res, 2004, 64(4): 1436-43. ( 1) 1)
|
| [12] |
Ha NH, Nair VS, Reddy DN, et al. Lactoferrin-endothelin-1 axis contributes to the development and invasiveness of triple-negative breast cancer phenotypes[J]. Cancer Res, 2011, 71(23): 7259-69. ( 1) 1)
|
| [13] |
Bendinelli P, Maroni P, Matteucci E, et al. Microenvironmental stimuli affect Endothelin-1 signaling responsible for invasiveness and osteomimicry of bone metastasis from breast cancer[J]. Biochim Biophys Acta, 2014, 1843(4): 815-26. ( 1) 1)
|
| [14] |
Rosanò L, Cianfrocca R, Masi S, et al. Beta-arrestin links endothelin A receptor to beta-catenin signaling to induce ovarian cancer cell invasion and metastasis[J]. Proc Natl Acad Sci USA, 2009, 106(8): 2806-11. ( 1) 1)
|
| [15] |
Rosanò L, Spinella F, Di Castro V, et al. Endothelin-1 promotes epithelial-to-mesenchymal transition in human ovarian cancer cells [J]. Cancer Res, 2005, 65(24): 11649-57. ( 1) 1)
|
| [16] |
Jamal S, Schneider RJ. UV-induction of keratinocyte endothelin-1 downregulates E-cadherin in melanocytes and melanoma cells[J]. J Clin Invest, 2002, 110(4): 443-52. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
