2南方医院神经内科;
3第一临床医学院,广东广州510515
2Department of Neurology, Nanfang Hospital,
3First College of Clinical Medicine, Southern Medical University, Guangzhou 510515, China
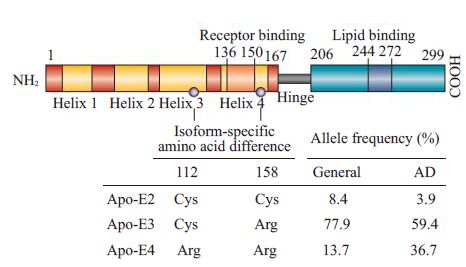
阿尔茨海默病(Alzheimer's disease,AD)是一种渐进性神经退行性病变,目前其病因还不完全明了。其致病因素与多种基因相关[1],其中ApoE4(载脂蛋白E,第4亚型)是较为公认的AD危险因子,与散发型AD(sporadicAD,SAD)相关,而散发型AD约占临床AD总病例的95%[2]。因此,研究ApoE4在AD病症中的作用机制具有重要意义。人类ApoE蛋白有3种亚型,ApoE2、ApoE3和ApoE4,均由299个氨基酸组成[3]。它们之间的差别仅在于第112位和158位氨基酸的不同,且ApoE2与ApoE3及ApoE3与ApoE4之间仅有一个氨基酸的不同(图1)。由上述氨基酸组成的不同就造成了空间构像和功能上的差异[4]。与携带ApoE2和E3基因的个体相比,携带单拷贝或双拷贝ApoE4基因的个体患AD的危险性分别增加4倍和12倍[5]。
|
图1 ApoE不同亚型在112和158位氨基酸的区别 Fig.1 ApoE2, E3, and E4 isoforms differ from one another at amino acid residues 112 and/or 158 (grey circles). |
淀粉样斑块(amyloid plaques,AP)及神经元纤维缠结(neurofibrillary tangles,NFT)是AD的特征性病变。其中,NFT是位于神经元胞内由Tau蛋白超磷酸化后聚集而成[6]。而Tau 蛋白被异常(超)磷酸化后可使胞内微管稳定性降低,使神经元内的运输和通讯功能受损,最终导致细胞死亡[7]。研究证明,糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK-3β)与Tau 的超磷酸化密切相关[8, 9],其异常表达与AD相关。
对ApoE4在AD中作用机制的研究,目前主要分为两类,一是Aβ依赖性病理机制[10, 11],即:ApoE可以亚型依赖形式促进Aβ斑的形成(ApoE4>ApoE3>ApoE2)。同样ApoE的脂质复合体也能以亚型依赖形式清除Aβ来减少Aβ斑(ApoE2>ApoE3>>ApoE4)。另一条途径是Aβ非依赖性病理机制[12, 13],即:ApoE4可在神经元内被蛋白酶切割,产生去除C- 末端的片段[ApoE4(1-272)],该片段具有神经元毒性可通过损害线粒体及突触再生功能而产生AD病症[14]。ApoE4是否可影响Tau的磷酸化,目前还未见报道。
1 材料和方法 1.1 细胞株及主要试剂U87脑星形胶质瘤细胞系购自于南京凯基生物公司。胎牛血清(FBS)、DMEM高糖培养基及0.25%胰蛋白酶均为Gibco 公司产品。pIRES-EGFP 表达质粒(Clonetech 公司),重组质粒ApoE4/pIRES-EGFP 和ApoE3/pIRES-EGFP为本研究组构建,高纯度质粒提取试剂盒(上海生工生物公司),ApoE-siRNA(正向:GCUGGGUGCAGACACUGUCUGAGCA 及反向:UGCUCAGACAGUGUCUGCACCCAGC) 和对照siRNA均由美国Invitrogen公司合成。细胞转染脂质体Lipofectamine 2000(Invitrogen 公司),兔抗人p-Tau 抗体(CST 公司,Cat no. 11834S),兔抗人GSK-3β抗体(Cat no. BA0906-1)及羊抗兔IgG-HRP(二抗)均购自武汉博士德公司。显色剂ECL(Perkin-Elmer公司)。
1.2 ApoE的过表达实验U87细胞混悬于2 mL/孔的DMEM高糖培养基中(含1% P/S(双抗)和10% FBS),在6 孔培养板中,于37 ℃,5% CO2培养至细胞密度达70%~80%时进行质粒转染。
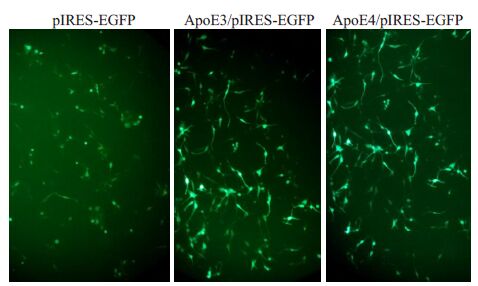
分别将ApoE4/pIRES-EGFP、ApoE3/pIRES-EGFP及空白对照质粒(pIRES-EGFP)与脂质体Lipofectamine2000混合(1 μg∶2 μL)后转染U87细胞。为了建立ApoE过表达的细胞平台,U87神经胶质细胞瘤细胞被分为3个转染组:第1组为对照质粒pIRES- EGFP载体(即空白质粒,图2A),第2组是ApoE3/pIRES- EGFP重组质粒(即ApoE3过表达组,图2B),第3组是ApoE4/pIRES-EGFP 重组质粒(即ApoE4 过表达组,图2C)。然后于荧光显微镜下观察被转染细胞的绿色荧光。最后提取各组总蛋白用于下一步实验。
|
图2 不同EGFP非融合重组质粒转染U87细胞的绿色荧光图像 注解 Fig.2 Expression of non-fused EGFP in U87 cells 24 aftertransfection with ApoE4,ApoE3 and pIRES-EGFP vector plasmidsdetected under the inverted fluorescent microscope (Originalmagnification: ×20). |
于上述细胞转染24 h 后弃培养液,用预冷的PBS洗涤2次,吸净PBS后加入RIPA裂解液,在冰浴上孵育20 min 后充分刮取贴壁细胞后转移至离心管中,于12 000 r/min,4 ℃下离心15 min,取上清总蛋白于新离心管中。应用Bradford法进行蛋白定量,备用。
1.4 Western blotting(蛋白免疫印迹)实验上述蛋白样品经SDS-PAGE电泳后,将胶中蛋白转移至PVDF膜上并在室温下用5%脱脂奶粉封闭液封闭1 h,TBST(20 mmoL Tris·Cl,150 mmoL NaCl,0.1%Tween-20,pH7.4)洗涤2次,然后分别加入适当的一抗于含5%脱脂奶粉的TBST缓冲液中室温孵育1 h:兔抗人GSK-3β抗体按1∶400 稀释;兔抗人p-Tau 抗体按1∶800 稀释。接着用TBST 洗涤3 次,然后用羊抗兔IgG-HRP(二抗,1∶5000)于室温中再孵育1 h,TBST洗涤3 次。最后将吸干水分的PVDF 膜置于BioRad荧光成像仪的托板上,在膜上均匀加上ECL 化学发光液并进行自动曝光拍照。选取曝光适当的照片进行分析。
1.5 ApoE-siRNA干扰实验将U87细胞培养至密度达70%~80%(见1.2.1),用脂质体Lipofectamine 2000 分别与双链ApoE-siRNA及对照siRNA混匀,室温放置15 min。而后加入U87细胞内,使siRNA的终浓度为150 nmol/L继续孵育24 h后提取实验组和对照组的细胞总蛋白。最后用Western blotting法检测相应蛋白的含量(见1.4)并进行统计学对比。
1.6 统计学分析应用SPSS 18.0 软件处理至少3 次独立实验的数据,以平均数±标准差表示。两两比较采用两独立样本t检验;多组间比较采用单因素方差分析(One-way ANOVA)。P<0.05认为差异具有统计学意义。
2 结果 2.1 ApoE4和ApoE3表达质粒转染U87细胞的荧光信号检测在转染24 h后,于倒置荧光显微镜下检测绿色荧光蛋白EGFP的荧光信号,以判明转染质粒在细胞中的过表达情况。结果表明:ApoE4,ApoE3重组质粒及对照质粒均成功转染入宿主细胞并表达出非融合的EGFP指示蛋白。
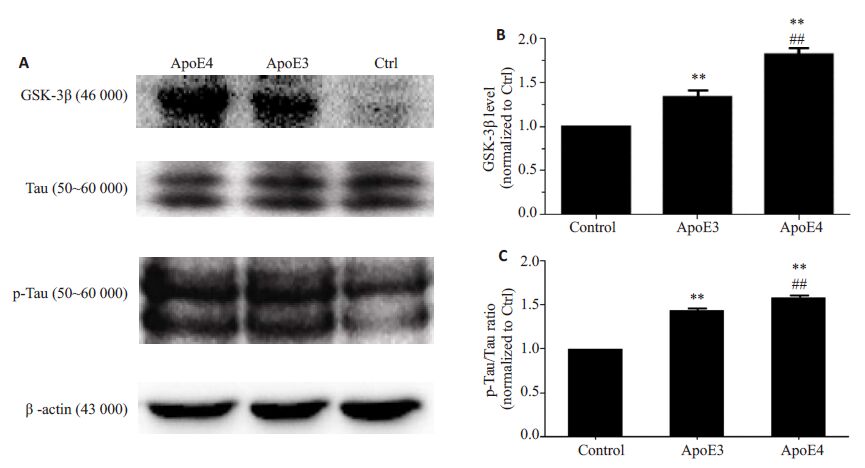
2.2 ApoE4可上调GSK-3β表达及增加Tau的磷酸化从2.1所转染的3组U87细胞中分别提取其总蛋白后利用Western blotting 检测各实验组的GSK-3β、Tau蛋白的磷酸化水平(图3A)并进行统计学处理。结果显示,与对照组相比,GSK-3β蛋白水平的相对变化值分别为:ApoE4 组(1.819±0.130,P<0.01,n=3)和ApoE3 组(1.336±0.130,P<0.01,n=3),差异具有统计学意义;且ApoE4 和ApoE3 组间也有差异(P<0.01,图3B)。这一结果表明,ApoE4具有更强的上调GSK-3β作用。同时,与对照组相比,ApoE4和ApoE3使p-Tau蛋白变化的相对值分别为1.587±0.027(P<0.01,n=3)和1.436±0.026(P<0.01,n=3),差异均具有统计学意义;同样,ApoE4和ApoE3 组间也有差异(P<0.01)。这一结果也表明,ApoE4较ApoE3有更强的增加Tau蛋白磷酸化水平的作用(图3C)。有趣的是为何ApoE3也可使Tau相关的该激酶表达上调及Tau磷酸化水平的增加。
|
图3 ApoE4和ApoE3对GSK-3β水平及Tau磷酸化的影响 Fig.3 Both ApoE4 and ApoE3,especially the former,upregulate the expression of GSK-3β and enhance thephosphorylation levels of Tau. **P<0.01 vs control group,##P<0.01 vs ApoE3 group. |
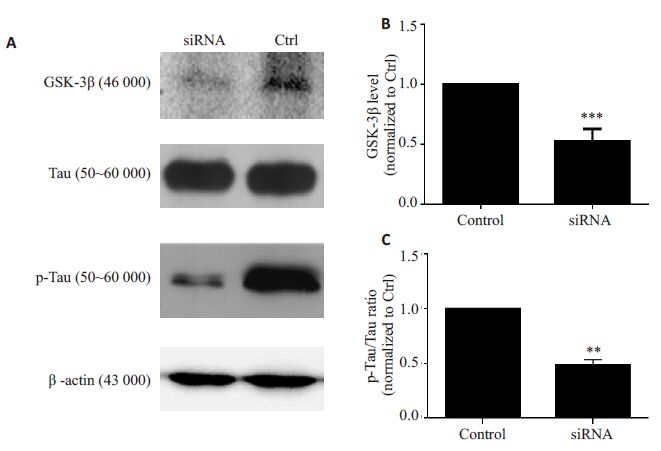
为进一步验证GSK-3β与Tau 蛋白磷酸化水平与ApoE 相关,我们将干扰ApoE 表达的siRNA(ApoEsiRNA)转染至U87 细胞,24 h 后提取总蛋白并利用Western blotting 检测对照组和干扰组的GSK-3β表达和Tau蛋白磷酸化的变化(图4A)。结果表明,干扰组的GSK-3β的表达与对照组相比明显降低(0.544±0.058,P<0.001,n=3,图4B)。同样,siRNA 干扰后磷酸化Tau蛋白的相对变化值与对照组相比也明显降低(0.474±0.060,P<0.01,n=3,图4C)。这些结果进一步表明ApoE过表达可使GSK-3β水平升高且可增加Tau蛋白的磷酸化水平。
|
图4 ApoE-siRNA对GSK-3β及Tau蛋白的磷酸化水平的影响 Fig.4 ApoE-siRNA down-regulates the expression of GSK-3β and decreases the phosphorylationof Tau. ***P<0.001 and **P<0.01 vs control group. |
本研究的结果显示:ApoE4的表达量与GSK-3β的表达及Tau蛋白的磷酸化水平成正相关。提示ApoE4在AD中的作用机制之一可能是通过上调GSK-3β而使Tau蛋白的磷酸化水平上升以导致AD病症。对ApoE4在AD中的作用机制提出了新的解释。
3 讨论AD是一种多因素引起的中枢神经退行性疾病,我国现有AD病患者达350多万,65岁以上老年人总患病率为5.9%,与西方国家资料接近[15]。至今AD的发病机制尚未完全明了,目前主要有:淀粉样多肽(Aβ)致病说[16]、Tau 蛋白超磷酸化致病说[7]和遗传变异致病说[17],等。在ApoE不同亚型的遗传背景因素中,ApoE4亚型被认为是AD病的危险因子[18]而ApoE3 和ApoE2 亚型不是。研究表明,GSK-3β是Tau 磷酸化的主要激酶之一[8, 19],而异常磷酸化的Tau可导致神经元功能的减退甚至死亡。从而认为GSK-3β可通过使Tau超磷酸化促进AD的病程进展。但ApoE4与GSK-3β间的相互关系还未见报道。
在正常情况下ApoE在脑中主要由星形胶质细胞表达,而目前所使用的人神经源性细胞系(如M-17,SH-SY5Y等)在正常情况下ApoE的表达水平很低(只有当受某些应激刺激或受损伤时才表达ApoE)[3, 5]。表明在脑星形胶质细胞中存在特有的ApoE基因调控系统。因此,我们在实验中采用U87人脑星形胶质细胞源性细胞系进行研究。拟通过在U87细胞中表达ApoE4和ApoE3来探讨它们在信号转导和功能上的差异。
本研究发现,在U87细胞中过表达ApoE4 或ApoE3均使得GSK-3β的表达上调及增高Tau蛋白的磷酸化水平。而当用ApoE的抑制性siRNA处理后GSK- 3β的表达及Tau蛋白的磷酸化水平(p-Tau)均显著下降。值得注意的是:ApoE4过表达组与ApoE3过表达组之间存在着显著差异(P<0.01),即如果将ApoE3(组)作为对照则ApoE4(组)仍具有显著上调GSK-3β表达和增高p-Tau水平的作用。这可能是ApoE4作为AD危险因子的作用之一。对于ApoE3 在本实验系统中也可上调GSK-3β表达的现象,我们认为ApoE3的过表达使细胞内质网中未折叠蛋白增多而通过其感应分子IRE1(inositol-requiring enzyme 1,肌醇依赖酶1)产生内质网应激反应(ER stress),即未折叠蛋白反应(unfoldedprotein response,UPR)。从而导致NF-kb 转录因子表达增高[20, 21]继而引起GSK-3β的表达上调。采用转录因子结合序列的分析发现(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3) ,在GSK- 3β基因的启动子[22]中存在NF-kb的转录结合位点。而ApoE4较ApoE3具更为显著的上述作用则是源于它们分子间在空间构象上的差异[3]。基于上述资料和分析,本研究的结果表明ApoE4 可能通过上调GSK-3β的表达而增强Tau的磷酸化并以此促进AD病程的发展,为探索ApoE4在AD中的作用机制提供了新的实验依据。
| [1] | Ballard C, Gauthier S, Corbett A, et al. Alzheimer's disease[J]. Lancet, 2011, 377(9770): 1019-31. ( 1) 1) |
| [2] | Sadigh-Eteghad S, Talebi M, Farhoudi M. Association of apolipoprotein E epsilon 4 allele with sporadic late onset Alzheimer's disease. A meta-analysis[J]. Neurosciences, 2012, 17 (4): 321-6. ( 1) 1) |
| [3] | Liu CC, Liu CC, Kanekiyo T, et al. Apolipoprotein E and alzheimer disease: risk, mechanisms and therapy[J]. Nat Rev Neurol, 2013, 9 (2): 106-18. ( 3) 3) |
| [4] | Zhong N, Weisgraber KH. Understanding the association of apolipoprotein E4 with Alzheimer disease: clues from its structure [J]. J Biol Chem, 2009, 284(10): 6027-31. ( 1) 1) |
| [5] | Kim J. Basak JM, holtzman DM. The role of apolipoprotein E in alzheimer's disease[J]. Neuron, 2009, 63(3): 287-303. ( 2) 2) |
| [6] | Bouras C, Hof PR, Giannakopoulos P, et al. Regional distribution of neurofibrillary tangles and senile plaques in the cerebral cortex of elderly patients: a quantitative evaluation of a one-year autopsy population from a geriatric hospital[J]. Cereb Cortex, 1994, 4(2): 138-50. ( 1) 1) |
| [7] | Khan SS, Bloom GS. Tau: the center of a signaling nexus in alzheimer's disease[J]. Front Neurosci, 2016, 10(1/5): 31. ( 2) 2) |
| [8] | Rankin Ca SQ, Gamblin TC. Tau phosphorylation by GSK-3β promotes tangle-like filament morphology[J]. Mol Neurodegener, 2007, 2: 12. ( 2) 2) |
| [9] | Billingsley ML, Kincaid RL. Regulated phosphorylation and dephosphorylation of tau protein: effects on microtubule interaction, intracellular trafficking and neurodegeneration [J]. Biochem J, 1997, 323(Pt 3): 577-91. ( 1) 1) |
| [10] | Castellano JM, Kim J, Stewart FR, et al. Human apoE isoforms differentially regulate brain amyloid-β peptide clearance[J]. Sci Transl Med, 2011, 3(89): 89ra57 ( 1) 1) |
| [11] | Jungsu Kim JM, David M. Holtzman. The role of apolipoprotein E in alzheimer's disease[J]. Neuron, 2009, 63(3): 287-303. ( 1) 1) |
| [12] | Huang Y. Abeta-independent roles of apolipoprotein E4 in the pathogenesis of Alzheimer's disease[J]. Trends Mol Med, 2010, 16 (6): 287-94. ( 1) 1) |
| [13] | Harris FM, Brecht WJ, Xu Q, et al. Carboxyl-terminal-truncated apolipoprotein E4 causes Alzheimer's disease-like neurodegeneration and behavioral deficits in transgenic mice[J]. Proc Natl Acad Sci USA, 2003, 100(19): 10966-71. ( 1) 1) |
| [14] | Brecht WJ, Harris FM, Chang S, et al. Neuron-specific apolipoprotein e4 proteolysis is associated with increased tau phosphorylation in brains of transgenic mice[J]. J Neurosci, 2004, 24(10): 2527-34. ( 1) 1) |
| [15] | 王华丽, 于欣. 中国阿尔茨海默病的流行病学现状[J]. 中华全科医师杂志, 2006, 5(6): 358-60. ( 1) 1) |
| [16] | Hardy J, Allsop D. Amyloid deposition as the central event in the aetiology of Alzheimer's disease[J]. Trends Pharmacol Sci, 1991, 12 (10): 383-8. ( 1) 1) |
| [17] | Bertram L, Lill CM, Tanzi RE. The genetics of Alzheimer disease: back to the future[J]. Neuron, 2010, 68(2): 270-81. ( 1) 1) |
| [18] | Strittmatter WJ, Saunders AM, Schmechel D, et al. Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease[J]. Proc Natl Acad Sci USA, 1993, 90(5): 1977-81. ( 1) 1) |
| [19] | Llorens-Martín M, Fuster-Matanzo A, Teixeira CM, et al. GSK-3β overexpression causes reversible alterations on postsynaptic densities and dendritic morphology of hippocampal granule neurons in vivo[J]. Mol Psychiatry, 2013, 18(4): 451-60. ( 1) 1) |
| [20] | Gotoh T, Endo M, Oike Y. Endoplasmic reticulum stress-related inflammation and cardiovascular diseases[J]. Int J Inflam, 2011; 2011: 259462. ( 1) 1) |
| [21] | Steinbrecher KA, Wilson W, Cogswell PC, et al. Glycogen synthase kinase 3beta functions to specify gene-specific, NF-kappaBdependent transcription[J]. Mol Cell Biol, 2005, 25(19): 8444-55. ( 1) 1) |
| [22] | Lau KF, Miller CC, Anderton BH, et al. Molecular cloning and characterization of the human glycogen synthase kinase-3beta promoter[J]. Genomics, 1999, 60(2): 121-8.( 1) 1) |


