2国立癌症研究所肿瘤生物与遗传实验室,国立卫生研究院,马里兰州贝塞斯达市美国
2Laboratory ofCancer Biology and Genetics, National Cancer Institute, National Institutes of Health, Bethesda, Maryland, USA
乳腺癌的转移复发是乳腺癌死亡的主要原因,但转移复发的机制仍有待深入研究。自分泌在乳腺癌的发生发展和转移中起重要作用,乳腺癌细胞通过自分泌多种蛋白质,包括生长因子,如神经细胞生长因子[1]、血小板源生长因子[2]、肝细胞生长因子[3]和胰岛素样生长因子2[4]等促进乳腺癌细胞的增殖、迁移、侵袭及癌细胞在异位的生长。最近的研究发现,癌细胞可自分泌神经生长因子(nerve growth factor,NGF)[1]和神经生长因子前体(precursor of nerve growth factor,proNGF)[5]促进乳腺细胞的上皮间质转化及侵袭,乳腺浸润性导管癌和proNGF的表达高度相关;相对于NGF,proNGF只需极低的浓度就可促进乳腺癌细胞侵袭,提示乳腺癌细胞通过自分泌proNGF促进乳腺癌转移的可能性更大,因此研究proNGF 促进乳腺癌转移的机制尤为重要。Demont的研究表明[5],proNGF促进乳腺癌细胞侵袭与Src 的激活相关联,尽管Src[6]的异常激活与肿瘤转移有关,但proNGF促进乳腺癌转移是否依赖于Src的激活,以及Src的激活的是何种下游分子却有待进一步阐明,因为Src有多种底物[7],参与不同的信号途径[8, 9]。
埃兹蛋白(ezrin)是细胞骨架蛋白ERM(ezrinradixin-moesin)家族中的一员,相对分子质量为69 000,通过连接细胞膜和细胞骨架参与许多细胞动力学过程,如丝状伪足的形成和稳定、细胞黏附、迁移等[10, 11, 12]。研究表明,ezrin表达升高与乳腺癌的不良预后有关[13],敲低乳腺癌细胞ezrin可抑制乳腺癌细胞的侵袭能力[13]。不但ezrin 表达高低与乳腺癌转移有关,而且,ezrinThr567的磷酸化与乳腺癌转移有关系,因为ezrin的激活有赖于ezrin Thr567的磷酸化[14]。ezrin Thr567[13]和ezrin Tyr477[15]磷酸化与肿瘤转移有关。Mak等的研究表明[15],Src是磷酸化ezrin Tyr477的激酶。
由于proNGF可使Src激活,而Src可使ezrin Tyr477磷酸化,我们假设proNGF促进乳腺癌细胞的侵袭的机制是通过其激活Src而使ezrin Tyr477磷酸化。我们的研究加深了对proNGF促进乳腺癌转移机制的了解。
1 材料和方法 1.1 细胞株人乳腺癌MDA-MB-231 细胞株购自中科院上海细胞库。人乳腺癌MCF-7细胞株购自美国模式培养物保藏所(American Type Culture Collection,美国)。
1.2 主要试剂L15、DMEM细胞培养液及胰酶购自Hyclone公司(美国);胎牛血清购自Gibco公司(美国);proNGF重组蛋白购自Alomone公司(以色列);SKI-606购自Selleck公司(美国);Transwell小室、Matrigel基质胶、PVDF膜购自BD公司(美国);兔抗人pTrkA、兔抗人TrkA、兔抗人pSrc、兔抗人Src、兔抗人ezrin、兔抗人pezrin Thr567购自Cell Signaling Technology 公司(美国);兔抗人pezrin Tyr477 购自Sigma 公司(美国);鼠抗人β-actin、山羊抗兔IgG、山羊抗鼠IgG购自武汉博士德生物工程有限公司(中国);LipofectamineTM3000转染试剂以及引物合成购自Invitrogen 公司(美国);pEnter-His,pEnter-His-ezrin质粒购自山东维真生物科技有限公司(中国);基因定点突变试剂盒购自碧云天公司(中国)。
1.3 细胞培养人乳腺癌细胞株MDA-MB-231 培养于含10%胎牛血清的L-15培养基中,人乳腺癌细胞株MCF-7培养于含10%胎牛血清的DMEM培养基中,37 ℃,5% CO2培养箱内培养,常规更换生长液,消化传代,取处于对数生长期的细胞用于实验。
1.4 Transwell小室检测细胞的侵袭能力取5 μL Matrigel基质胶溶于95 μL DMEM基础培养基,加入到Transwell小室(孔径8 μm)中,在37 ℃孵箱静置1 h,小心吸除小室中未凝液体备用。取对数生长期细胞,消化离心,用无血清培养基稀释细胞至3×105/mL,每个小室中加入300 μL细胞悬液,下室每孔加入含5%胎牛血清的培养基800 μL,按照实验目的在上室中加入一定浓度的proNGF,培养16 h后取出小室,用棉签擦去小室上层未侵袭的细胞,4%多聚甲醛固定15 min,0.1%结晶紫染色30 min。显微镜下拍摄,在400×视野下取上、下、左、右、中5个视野拍摄,计数。侵袭增长率=(实验组细胞数-对照组细胞数)/对照组细胞数。
1.5 免疫印迹实验检测蛋白表达将细胞消化后接种到12孔板,1×104个细胞每孔。在细胞贴壁之后,用无血清培养基饥饿处理24 h,再加药处理。处理完毕后弃上清,用预冷的PBS洗涤细胞2次,吸净液体。将细胞放置在冰上,加入1 mL预冷的PBS,细胞刮刀刮下细胞,离心收集。向每管细胞中加入100 μLRIPA裂解液,冰上裂解30 min,12 000 g,4 ℃离心10 min,取上清,BCA法测定总蛋白浓度。蛋白样品上样前加入上样缓冲液,100 ℃金属浴加热5 min,12 000 g离心3 min,可直接用于蛋白免疫印迹,每孔上样等量总蛋白。SDS-PAGE分离蛋白,转膜至PVDF膜,5%脱脂牛奶摇床上室温封闭1 h,加入相关蛋白的一抗4 ℃孵育过夜(一抗均以1∶1000比例稀释于5%BSA中);二抗室温孵育1 h(羊抗鼠、羊抗兔二抗均以1∶3000比例稀释于5%脱脂牛奶中),ECL显影。
1.6 质粒转染转染前1 d,4×104细胞接种于24孔板,在24 h内细胞汇合达到70%~90%。分别将1 μg质粒,2 μL lipo3000和2 μL p3000溶于50 μL Optimem无血清培养基中,混匀室温静置5min,再将质粒和lipo3000、p3000混合,室温下静置20 min。将100 μL 混合好的复合物加到培养板中,来回轻柔摇晃细胞培养板,在CO2培养箱中37 ℃温育24~48 h后,进行转染后的后续实验。
1.7 基因定点突变根据基因定点突变试剂盒上说明,设计并合成引入ezrin Tyr477突变位点的一对互补PCR引物,将编码野生型ezrin 第477位酪氨酸(ezrin Y477)的密码子TAC改为TTC,使ezrin第477位酪氨酸转变苯丙氨酸,成为ezrin Y477F突变体,使连接后的PCR产物成为ezrin显性负突变质粒pEnter-His-ezrinY477F。这一对引物的序列为:5'-CCACCACCCCCCGTGTTCGAGCCGGTGAGCTAC-3';5'-GTAGCTCACCGGCTCGAACACGGGGGGTGGTGG-3'。黑体碱基为引入的突变,使ezrin 第477位酪氨酸转变苯丙氨酸(ezrinY477F)。以pEnter-His-ezrin质粒作为模板,按照说明书加入上述引物以及PCR反应试剂,PCR反应进行基因点突变。反应完成后加入DpnⅠ酶消化1 h,降解掉模板质粒。DpnⅠ酶消化完毕后直接取10 μL产物加入到100 μL感受态细菌中转化,涂布在卡那抗性平板上,培养过夜,次日挑取单个克隆扩增鉴定。
1.8 统计学分析实验数据均以均数±标准差表示,采用SPSS13.0软件对数据进行单因素方差分析,两两比较用SNK法。当P<0.05时认为差异有统计学意义。
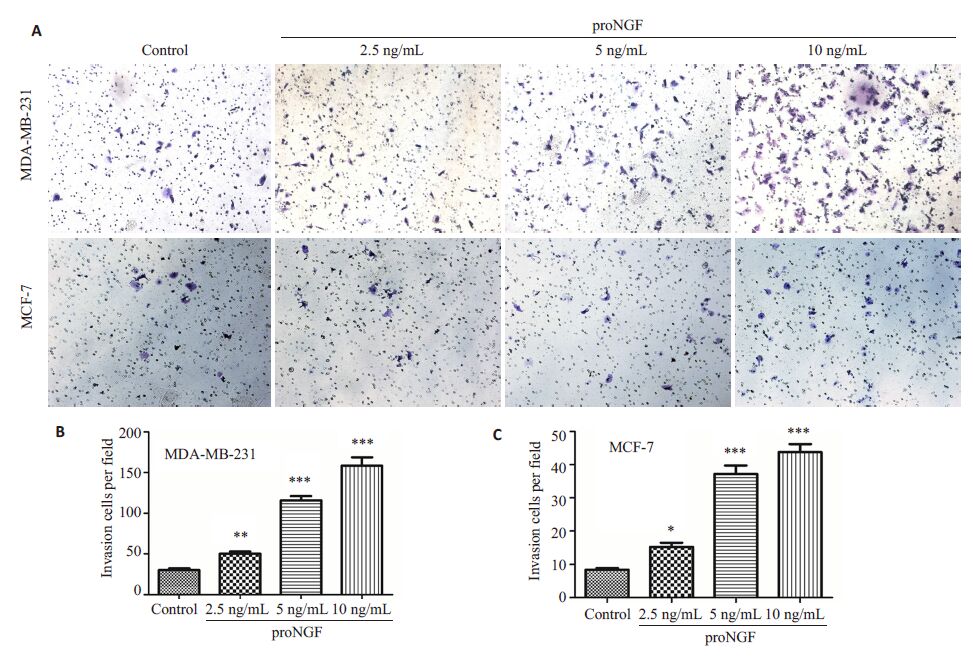
2 结果 2.1 proNGF促进乳腺癌细胞MDA-MB-231和MCF-7的侵袭能力Transwell侵袭实验显示,对MDA-MB-231细胞和MCF-7 细胞分别用2.5、5、10 ng/mL 这3 个浓度的proNGF处理16 h后,随着proNGF浓度的增加,MDAMB-231细胞和MCF-7细胞穿过基质胶的数量逐步增加,说明两种乳腺癌细胞的侵袭能力随着proNGF浓度升高而逐渐增强(图1A)。与对照组相对比,MDAMB-231 细胞在10 ng/mL 的proNGF处理下侵袭增长率为686%(图1B),MCF-7为388.9%(图1C)。
|
图1 proNGF促进乳腺癌细胞系MDA-MB-231和MCF-7的侵袭 Fig.1 proNGF promotes the invasion of breast cancer cell line MDA-MB-231 and MCF-7. A: Transwell assay (Originalmagnification: ×400); B,C: Quantitative analysis of cell invasion. *P<0.05; **P<0.01; ***P<0.005. |
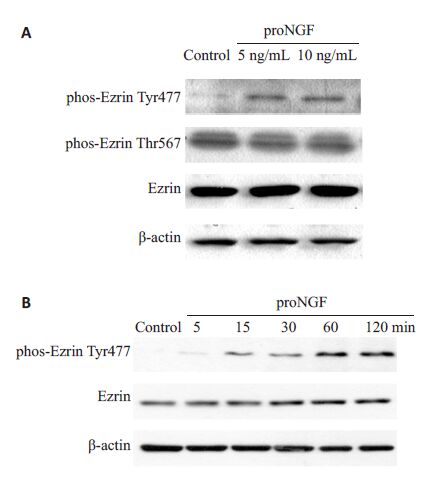
用proNGF 处理MDA-MB-231 细胞60 min,与对照组相比,5、10 ng/mL proNGF处理MDA-MB-231 细胞,ezrin的表达和ezrin Thr567位点的磷酸化均未产生变化,而ezrin Tyr477 位点的磷酸化随着proNGF刺激显著性提高,并且具有浓度依赖效应(图2A)。如图2B所示,ezrin Tyr477位点的磷酸化随着proNGF(10 ng/mL)处理时间增长而递增,表现出时间依赖效应。
|
图2 proNGF促进MDA-MB-231 细胞ezrin Tyr477的磷酸化 Fig.2 proNGF increases the phosphorylation of ezrinTyr477 in MDA-MB-231 cells in a concentrationdependent(A) and time-dependent (B) manner. |
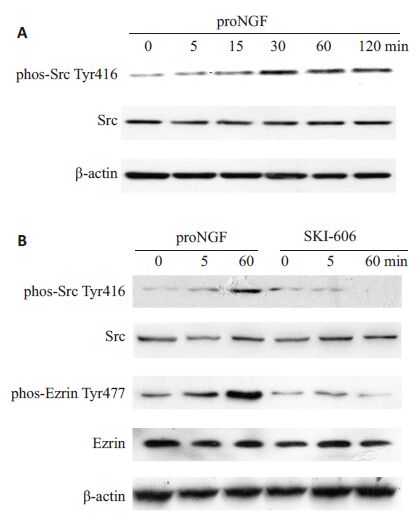
proNGF促进乳腺癌细胞转移,并且和Src激酶激活相关联[5]。考虑到有报道ezrin Tyr477位点磷酸化是由Src 激酶激活所致,我们研究了proNGF 促进ezrinTyr477的磷酸化是否是由Src激酶激活引起。如图3A所示,随着proNGF处理MDA-MB-231 细胞时间的延长,Src Tyr416水平逐渐升高,直至120 min处于最高,表明proNGF处理激活了Src激酶。当用Src激酶特异抑制剂SKI-606(10 μmol/L)处理乳腺癌细胞MDAMB-231 后(图3B),不仅抑制了proNGF对Src 激酶的激活,而且ezrin Tyr477位点磷酸化也相应的降低。
|
图3 proNGF通过激活乳腺癌细胞MDA-MB-231Src激酶使得ezrin Tyr477磷酸化 Fig.3 proNGF increases the phosphorylation of ezrinTyr477 by activating Src in MDA-MB-231 cells. A:proNGF activates Src by increasing thephosphorylation of Src Tyr416 in a time-dependentmanner; B: Src-specific inhibitor SKI-606 inhibits Srcactivation and the phosphorylation of ezrin Tyr477induced by proNGF. |
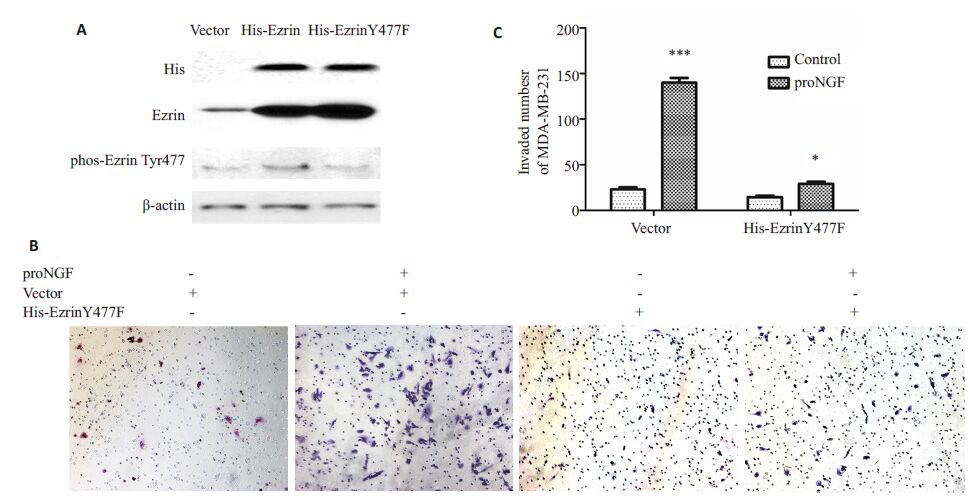
用基因定点突变技术,将pEnter-His-ezrin 质粒中ezrin 基因477 位点的酪氨酸突变成苯丙氨酸,从而使ezrin失去在477位点磷酸化的能力。这种pEnter-HisezrinY477F质粒对野生型ezrin Tyr477 的磷酸化起抑制作用,pEnter-His-ezrinY477F是显性负突变质粒。因此,在细胞中过表达pEnter-His-ezrinY477F,可以研究ezrin Tyr477的磷酸化在proNGF促进乳腺癌细胞侵袭中的作用。在MDA-MB-231细胞中,瞬时转染pEnter-His 空质粒载体、pEnter-His-ezrin 质粒、pEnter-HisezrinY477F质粒,免疫印迹检测ezrin、phos-ezrin Tyr477水平。转染了pEnter-His-ezrin 质粒和pEnter-HisezrinY477F质粒的细胞ezrin表达水平显著性升高,前者phos-ezrin Tyr477 水平也相应地升高,而后者phosezrinTyr477未发生改变(图4A)。用10 ng/mL proNGF处理转染了pEnter-His 空载体质粒和pEnter-HisezrinY477F质粒的MDA-MB-231 细胞,再在体外做Transwell小室实验,16 h后检测各组MDA-MB-231细胞的侵袭能力。转染空载体的一组,proNGF处理之后MDA-MB-231细胞侵袭数提高了508%;而转染pEnter-His-ezrinY477F 质粒的一组,proNGF 刺激处理之后MDA-MB-231 细胞侵袭数只提升了84%(图4B、C)。说明ezrinY477F 突变,抑制了proNGF 促进MDAMB-231 细胞侵袭的作用,即ezrin Tyr477 的磷酸化在proNGF促进乳腺癌细胞侵袭中起关键作用。
|
图4 pEnter-His-ezrinY477F显性负突变质粒抑制proNGF促进的MDA-MB-231乳腺癌细胞ezrin Tyr477磷酸化和侵袭 Fig.4 Dominent negative plasmid pEnter-His-ezrinY477F inhibits phosphorylation of ezrin Tyr477 and invasion induced byproNGF in MDA-MB-231 cells. A: pEnter-His-ezrinY477F inhibits phosphorylation of ezrin Tyr477 induced by proNGF inMDA-MB-231 cells; B Transwell assay (Original magnification: × 400),C: pEnter-His-ezrinY477F inhibited invasion of MDAMB-231 cells induced by proNGF. *P<0.05,***P<0.005. |
我们的研究表明:ezrin Tyr477的磷酸化在proNGF促进乳腺癌细胞侵袭中起关键作用,proNGF促进乳腺癌细胞的转移依赖于ezrin Tyr477的磷酸化。乳腺癌细胞能通过自分泌NGF[16]和proNGF[5]。NGF 能抑制乳腺癌细胞的凋亡[17],促进乳腺癌细胞增殖[18],NGF也与促进乳腺癌转移有关[1, 19, 20],但体外实验表明,proNGF 促进乳腺癌细胞的侵袭所需浓度比proNGF高十多倍,乳腺癌细胞对proNGF的应答更为敏感[5],这是本研究选择proNGF而没有选择NGF作为研究对象的原因之一。NGF和proNGF结合的受体及信号转导途径的差异,可能是其促进乳腺癌细胞侵袭差异性的基础。NGF通过结合p75NTR和TrkA 异二聚体受体[21]激活NF-κB和MAPK信号通路,proNGF是通过和异二聚体受体TrkA和sortlin结合,激活下游Src激酶[5, 21]。本研究结果也显示,proNGF也可激活Src激酶,proNGF能大幅增强乳腺癌细胞系MDA-MB-231和MCF-7的侵袭能力,且其对MDA-MB-231的效应要强于MCF-7。
由于proNGF促进乳腺癌侵袭过程中激活了Src激酶[5],且有文献报道表明,ezrin Tyr477位点的磷酸化是由Src激酶的激活所致[15],于是我们进一步研究proNGF促进乳腺癌细胞的侵袭是否与ezrin Tyr477的磷酸化有关。实验结果表明,proNGF刺激的乳腺癌细胞,ezrin的表达和ezrin Thr567 的磷酸化均没发生改变,但是ezrin Tyr477的磷酸化水平显著升高,且这种磷酸化水平的升高是由Src激酶的激活所致,因为Src激酶特异性抑制剂SKI-606能抑制proNGF对癌细胞Src激酶的激活,同时降低ezrin Tyr477磷酸化水平。为了进一步研究proNGF 促进乳腺癌细胞侵袭是否依赖于ezrinTyr477 的磷酸化,我们构建了显性负突变质粒pEnter-His-ezrinY477F转染MDA-MB-231 细胞,实验结果表明,显性负突变质粒抑制proNGF对乳腺癌细胞侵袭的促进作用,说明proNGF促进乳腺癌细胞侵袭依赖于ezrin Tyr477 的磷酸化,ezrin Tyr477 的磷酸化在proNGF促进乳腺癌细胞的侵袭中起关键作用。值得进一步研究的是,为什么ezrin Tyr477磷酸化能促进侵袭乳腺癌细胞的迁移。
综上所述,ezrin Tyr477 磷酸化在proNGF促进乳腺癌细胞侵袭中扮演非常关键的角色,这提示ezrin是proNGF促进乳腺癌侵袭信号途径中重要的信号分子,抑制ezrin Tyr477磷酸化及可能的下游信号分子,可能成为防治疗肿瘤的转移的新策略。
| [1] | Tomellini E, Touil Y, Lagadec C, et al. Nerve growth factor and proNGF simultaneously promote symmetric self-renewal, quiescence, and epithelial to mesenchymal transition to enlarge the breast cancer stem cell compartment[J]. Stem Cells, 2015, 33(2): 342-53. ( 3) 3) |
| [2] | Hurst NJ, Najy AJ, Ustach CV, et al. Platelet-derived growth factor-C (PDGF-C) activation by serine proteases: implications for breast cancer progression[J]. Biochem J, 2012, 441(3): 909-18. ( 1) 1) |
| [3] | Previdi S, Maroni P, Matteucci E, et al. Interaction between human-breast cancer metastasis and bone microenvironment through activated hepatocyte growth factor/Met and beta-catenin/ Wnt pathways[J]. Eur J Cancer, 2010, 46(9): 1679-91. ( 1) 1) |
| [4] | Wang JS, Wang FB, Zhang QG, et al. Enhanced expression of Rab27A gene by breast cancer cells promoting invasiveness and the metastasis potential by secretion of insulin-like growth factor-II[J]. Mol Cancer Res, 2008, 6(3): 372-82. ( 1) 1) |
| [5] | Demont Y, Corbet C, Page A, et al. Pro-nerve growth factor induces autocrine stimulation of breast cancer cell invasion through tropomyosin-related kinase A (TrkA) and sortilin protein[J]. J Biol Chem, 2012, 287(3): 1923-31. ( 7) 7) |
| [6] | Kim LC, Song LX, Haura EB. Src kinases as therapeutic targets for cancer[J]. Nat Rev Clin Oncol, 2009, 6(10): 587-95. ( 1) 1) |
| [7] | Varkaris A, Katsiampoura AD, Araujo JC, et al. Src signaling pathways in prostate cancer[J]. Cancer Meta Rev, 2014, 33(2/3, SI): 595-606. ( 1) 1) |
| [8] | Guarino M. Src signaling in cancer invasion[J]. J Cell Physiol, 2010, 223(1): 14-26. ( 1) 1) |
| [9] | Elsberger B. Translational evidence on the role of Src kinase and activated Src kinase in invasive breast cancer[J]. Crit Rev Oncol Hematol, 2014, 89(3): 343-51. ( 1) 1) |
| [10] | Fiévet B, Louvard D, Arpin M. ERM proteins in epithelial cell organization and functions[J]. Biochim Biophys Acta, 2007, 1773 (5): 653-60. ( 1) 1) |
| [11] | Bretscher A, Edwards K, Fehon RG. ERM proteins and Merlin: integrators at the cell cortex[J]. Nat Rev Mol Cell Biol, 2002, 3(8): 586-99. ( 1) 1) |
| [12] | Furutani Y, Matsuno H, Kawasaki M, et al. Interaction between telencephalin and ERM family proteins mediates dendritic filopodia formation[J]. J Neurosci, 2007, 27(33): 8866-76. ( 1) 1) |
| [13] | Hoskin V, Szeto A, Ghaffari A, et al. Ezrin regulates focal adhesion and invadopodia dynamics by altering calpain activity to promote breast cancer cell invasion[J]. Mol Biol Cell, 2015, 2(12):616-27. ( 2) 2) |
| [14] | Adada MM, Canals D, Jeong N, et al. Intracellular sphingosine kinase 2-derived sphingosine-1-phosphate mediates epidermal growth factor-induced ezrin-radixin-moesin phosphorylation and cancer cell invasion[J]. FASEB J, 2015, 29(11): 4654-69. ( 2) 2) |
| [15] | Mak H, Naba A, Varma S, et al. Ezrin phosphorylation on tyrosine 477 regulates invasion and metastasis of breast cancer cells[J]. BMC Cancer, 2012, 12: 82. ( 1) 1) |
| [16] | Dollé L, El Yazidi-Belkoura I, Adriaenssens E, et al. Nerve growth factor overexpression and autocrine loop in breast cancer cells[J]. Oncogene, 2003, 22(36): 5592-601. ( 1) 1) |
| [17] | Yazidi-Belkoura YI, Adriaenssens E, Dolle L, et al. Tumor necrosis factor receptor-associated death domain protein is involved in the neurotrophin receptor-mediated antiapoptotic activity of nerve growth factor in breast cancer cells[J]. J Biol Chem, 2003, 278(19): 16952-6. ( 1) 1) |
| [18] | Descamps S, Toillon RA, Adriaenssens E, et al. Nerve growth factor stimulates proliferation and survival of human breast cancer cells through two distinct signaling pathways[J]. J Biol Chem, 2001, 276 (21): 17864-70. ( 1) 1) |
| [19] | Dollé L, Oliveira MJ, Bruyneel E, et al. Nerve Growth Factor mediates its pro-invasive effect in parallel with the release of a soluble E-cadherin fragment from breast cancer MCF-7/AZ cells [J]. J Dairy Res, 2005, 72(1): 20-6. ( 1) 1) |
| [20] | Romon R, Adriaenssens E, Lagadec C, et al. Nerve growth factor promotes breast cancer angiogenesis by activating multiple pathways[J]. Mol Cancer, 2010, 9: 157. ( 1) 1) |
| [21] | Bradshaw RA, Pundavela J, Biarc J, et al. NGF and ProNGF: regulation of neuronal and neoplastic responses through receptor signaling[J]. Adv Biol Regul, 2015, 58: 16-27.( 1) 1) |


