2理工学院材料科学与工程系, 广东 广州 510632
2Department of Materials Science and Engineering, Jinan University, Guangzhou 510632, China
口腔粘膜溃疡是口腔临床较常见的疾病之一。目前,治疗口腔粘膜溃疡的局部药物剂型主要有液体制剂、半固体制剂和固体制剂,突出特点是药效快。但由于在口内停留较短,因而持效性差;另外受唾液影响也大,导致局部有效药物浓度低,起不到很好的治疗效果。膜剂是近年来发展的一种将药物溶解、均匀分散在成膜材料中制成的薄膜状新剂型[1, 2]。它可贴敷在皮肤或粘膜创伤表面或溃疡表面,载药膜中的药物可以直接经粘膜吸收,提高了药物的有效吸收,达到良好的治疗效果。
壳聚糖(CS)因其无毒、可降解,具有良好的载药相容性和成膜性[3]、良好的消炎止血[4]和抗菌杀菌[5]、促进组织愈合等药理作用[6, 7],广泛应用在医疗领域。壳聚糖缓释膜是将药物均匀分散在壳聚糖溶液中,再制成厚约几毫米的薄膜,主要用于皮肤和黏膜创伤或溃疡表面,促进创面愈合,从而即提高了膜的相关性能又改善的药物的释放[8]。然而,壳聚糖缓释膜的药效时间短限制其在医药领域的应用。
苦参碱(Mat)广泛存在于豆科植物苦参、苦豆子及广豆根中,为四环喹诺里西啶类载药碱[9, 10]。Mat具有广泛的药理作用,如抗炎[11]、抗肝纤维化[12]、镇痛[13]和抗心律失常[14],广泛应用于临床[15, 16]。张艳华等[17]制备了Mat/CS微球,结果表明微球对Mat具有特异靶向性和缓释作用,但由于半衰期较短和不稳定影响其药效。
本研究以制备口腔载药膜,延长药物释放时间为研究目标,选择壳聚糖为膜载体,加入甘油和苦参碱制备口腔载药膜,通过在载药膜底面涂覆羧甲基壳聚糖(CMC)溶液以控制Mat的释放速率,考察载药膜的力学性能、溶胀度、药物微观形态、体外药物释放速率。
1 材料和方法 1.1 主要试剂及仪器试剂:壳聚糖(CS),脱乙酰度>85%,济南海的贝载药技术有限公司;苦参碱(Mat),98%,西安中鑫载药技术有限公司;羧甲基壳聚糖(CMC),平均相对分子质量为6.1×104,羧甲基取代度为66%,济南海得贝海洋载药工程有限公司;乙酸,分析纯,广州市化学试剂厂;甘油,分析纯,广州市化学试剂厂。
仪器:HW-YD-10g 臭氧发生器,广州环伟环保科技有限公司;日本Shimadzu AG2I型系列拉伸试验机;紫外可见分光光度计754PC,上海菁华科技仪器有限公司;扫描电镜JSM-T300型,德国JEOL公司。
1.2 壳聚糖的降解测定将壳聚糖溶解于1%醋酸溶液中,配成2% CS溶液。将臭氧通入CS溶液进行降解实验。采用黏度法测定不同降解时间(15、30、45、60、75、90、120 min)CS的粘均相对分子质量。测定不同降解时间下,CS相对分子质量分别为:65、58、48、31、22、10、7.5、5.6万。
1.3 CS膜、Mat/CS膜和Mat/CS/CMC膜的制备分别取10 g 上述不同CS相对分子质量的CS溶液,各5份,并分别加入0.2、0.24、0.28、0.32、0.36 g甘油,配成CS/甘油质量比分别为1∶1、1∶1.2、1∶1.4、1∶1.6、1∶1.8的溶液。完全溶解后,在室温下干燥成膜,即可获得不同相对分子质量和甘油含量的CS膜,共40张。
选择相对分子质量为31、48、65万的CS,固定CS/甘油的质量比为1∶1.4,加入适量甘油和Mat,配制Mat含量分别为6%、8%、10%、12%和14%的Mat/CS溶液。完全溶解后,在室温下干燥成膜,即可获得不同相对分子质量和不同Mat含量的Mat/CS膜,共15张。
选择相对分子质量为65万的CS,CS/甘油质量比为1∶1.4、Mat含量12%的膜3张,在膜的底面涂覆一层浓度分别为0.5%和1%的CMC溶液,记为1#膜和2#膜;在膜的正面和底部均涂覆一层浓度为0.5%的CMC溶液,记为3#膜。室温晾干,即得Mat/CS/CMC载药膜。
1.4 CS膜的物理性能表征CS膜的宏观形态观察:浇注成膜后,肉眼直接观察膜的表面形态。CS膜力学性能测试:将降解0、30、 45 min的CS制备成膜。在1 mm/min拉伸速率下进行测试。每个样品重复测试3 次,计算模量和断裂伸长率。CS膜溶胀度测定:将0、30、45 min的CS制备成膜,质量记为m0;膜在生理盐水中浸泡3 d后,用滤纸吸干表面水分,相对质子质量记为mL。根据下式计算CS膜的溶胀度Q。
1.5 Mat/CS膜的宏观以及微观形态表征Mat/CS膜的宏观形态观察:浇注成膜后,肉眼直接观察膜的表面形态。Mat/CS膜的微观形态表征:选择相对分子质量分别为48和65万的CS和质量百分数含量分别为10%和12%的Mat,制备Mat/CS载药膜样品,喷金后SEM观察其正面和底面的表面形貌。
1.6 Mat/CS膜及Mat/CS/CMC膜体外释药行为的测定将相对分子质量分别为31、48、65 万的CS,制备Mat含量为0%和12%的CS空白膜、载药膜(分别记作1#膜、2#膜、3#膜)。称量后分别泡入100 mL生理盐水中。浸泡0.5 、1、2、3、5、9、13、23、37、61、85、109、133、157 h后分别取出100 μL溶液。置于分液漏斗中,先后加入10.00 mL,2×10-4 mol/L溴麝香草酚蓝缓冲液(pH为7.6)和10.00 mL氯仿,摇匀,静置约2 h,待水和氯仿完全分层后,滤出氯仿。测定溶液在415 nm波长的吸收度。将测得的吸收度代入标准曲线中,计算不同时刻Mat药物的浓度。
2 结果 2.1 壳聚糖相对分子质量对CS膜力学性能的影响随着壳聚糖相对分子质量的降低,CS膜的模量不断减小,断裂伸长率不断增加。当壳聚糖的相对分子质量为65万时,CS膜的模量最大(0.7875 MPa),而断裂伸长率最小(17.3%),其应力-应变曲线表现出明显的硬而强的特征。当壳聚糖的相对分子质量为31万时,CS膜的模量最小(0.1471 MPa),而断裂伸长率最大(43.3%),其应力-应变曲线表现出软而韧的特征。
2.2 CS膜及Mat/CS/CMC膜的溶胀度壳聚糖载药膜的药物释放速率与溶胀度密切有关,因此测试了不同相对分子质量CS制备的CS膜和Mat/CS/CMC载药膜在生理食盐水中的溶胀度。由分子量为65、48、31 万CS 制备的CS 膜的溶胀度分别为0.0743、0.2133 和0.3051,可以看出,随着CS分子量的增加,CS膜的溶胀度逐渐减小;Mat/CS/CMC载药膜的1 号膜、2 号膜和3 号膜样品的溶胀度分别是0.8142、0.9314和1.1654,随着CMC浓度的增加,载药膜的溶胀度增加,而且上表面和下表面都涂覆CMC的载药膜的溶胀度要明显高于单一面涂覆的载药膜。
2.3 Mat/CS膜的宏观形态CS相对分子质量为65 000的Mat/CS膜外观较白,而相对分子质量为31万的Mat/CS膜的颜色较深,表明臭氧降解会加深壳聚糖溶液的颜色。
由不同相对分子质量CS(31、48、65万)制备的不同Mat含量的CS膜的外观形态可知,相对分子质量为65万的Mat/CS膜均为白色,而相对分子质量为48、31万的Mat/CS 膜均为浅黄色。当Mat 的含量在14%以上时,在干燥后Mat/CS膜易析出油状物,因此,可以判断Mat药物在膜中的最高含量为12%。
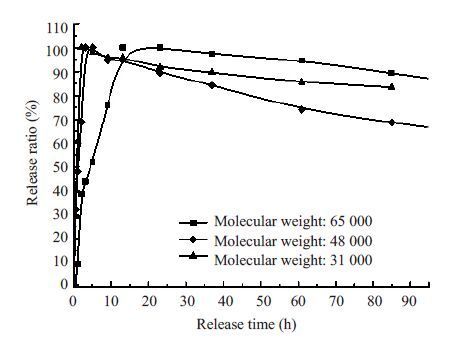
2.4 Mat/CS膜和Mat/CS/CMC载药膜的体外释放行为通过紫外分光光度计,测得Mat的标准工作曲线,拟合曲线为C=-23.056+42.901A,r=0.9995。根据标准曲线,分别对相对分子质量为31、48、65 万CS制备的Mat/CS膜(Mat质量含量为12%)进行体外释放行为研究,结果如图1所示。
|
图1 Mat的含量为12%的Mat/CS膜的体外释放情况 Fig.1 Drug release behavior in vitro of Mat/CS films (Mat content: 12%). |
由图1可知,相对分子质量为65万的Mat/CS膜在23 h药物完全释放,相对分子质量为48万的Mat/CS膜在13 h药物完全释放,相对分子质量为31万的Mat/CS膜在9 h药物完全释放。表明壳聚糖相对分子质量对Mat/CS膜的体外释放有较大的影响,壳聚糖相对分子质量越小,载药膜的药物释放速度越快。
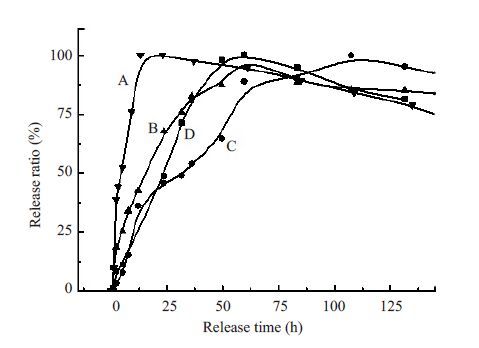
根据Mat/CS/CMC载药膜体外释放行为(图2)可知,Mat/CS膜在涂覆CMC溶液后,可以显著地延缓药物的释放速率。未涂CMC溶液的Mat/CS膜在23 h药物即完全释放,而在底面涂覆一层浓度为0.5% CMC溶液的1#膜则在60 h药物才完全释放完毕,延缓释放的效果非常明显。另外,在底面涂覆一层浓度为1%CMC溶液的2#膜在108 h药物才完全释放。可以推断,CMC溶液的浓度对药物释放速度影响较大,CMC浓度越大,药物释放越缓慢。
|
图2 Mat/CS/CMC载药膜体外释放速率 Fig.2 Release behavior in vitro of Mat/CS/CMC films.A: Blank film; B: No.1 film; C: No.2 film; D: No.3 film. |
如果在正面和底面均涂覆一层浓度0.5% CMC溶液的3#膜,药物完全释放的时间也在60 h左右,与1#膜基本一致,表明在膜两面涂覆CMC溶液和只在底面涂覆CMC溶液对药物释放的延缓作用基本一致。这可能与SEM观察到的药物沉积在底面的现象有关。在成膜过程中由于药物沉积在载药膜的底面,所以在底面涂覆CMC溶液可以有效延缓药物释放,而在正面涂覆CMC溶液则基本起不到释放的作用。
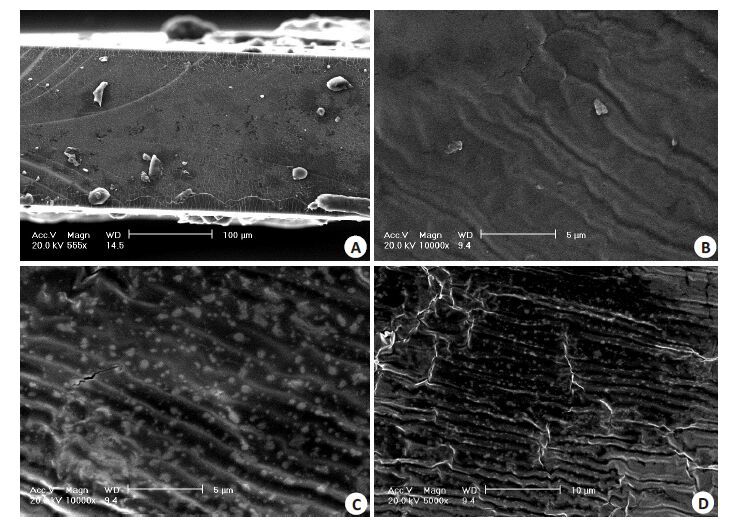
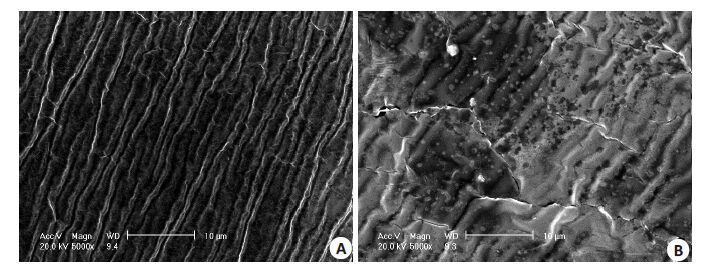
2.5 载药膜的微观形态用SEM 观察了Mat/CS 膜的微观形态结构来考察药物在CS膜中的分散情况。图3~5分别为不同CS相对分子质量和不同Mat 含量制备的Mat/CS 膜的SEM图。
|
图3 Mat/CS膜的SEM图 Fig.3 SEM of Mat/CS films (CS molecular weight: 650 000, Mat content: 12%).A: Fracture surface;B: Front surface; C and D: Undersurface. |
|
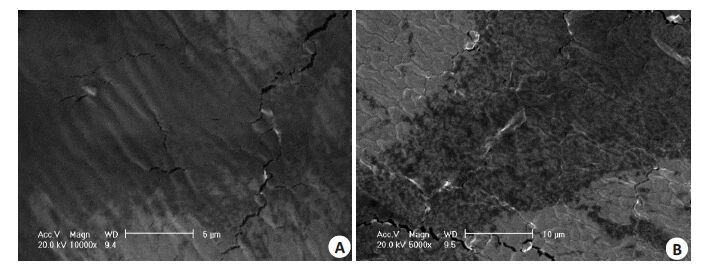
图4 Mat/CS膜的SEM图 Fig.4 SEM of Mat/CS films (CS molecular weight: 650 000, Mat content: 10%).A: Front surface;B: Undersurface. |
|
图5 Mat/CS膜的SEM图 Fig.5 SEM of Mat/CS films (CS molecular weight: 480 000, Mat content: 12%).A: Front surface;B: Undersurface. |
从图3可看出,CS膜面向空气的表面未出现药物颗粒,而面向底物的一侧则出现较多的药物颗粒,表明随水分的挥发,Mat逐渐从水中结晶沉淀出来,由于重力的原因,药物会向膜的底部沉积,因此底部会出现较多的结晶颗粒。另外,Mat的结晶颗粒粒径在微米、亚微米或纳米尺寸范围。
由不同相对分子质量CS制备的不同Mat含量的载药膜都呈现了药物在膜底面聚集的现象(图4,5)。这表明,Mat/CS膜中药物分散属于不对称分布。这种不对称分布对于医疗外用是有益处的,比如在作为消炎辅料的使用过程中,载药膜将含药量多的一面面向患处,则可以更集中用药,发挥更好的疗效。
3 讨论以天然可降解的CS及其衍载药为基质材料,以苦参碱为植物源药物,以载药物质甘油作为增塑剂,通过溶液浇铸法首次系统地制备了Mat/CS和Mat/CS/CMC载药膜。考察了CS分子量、力学性能、溶胀度、微观形态等对载药膜性能的影响。(1)通过正交实验法获得最佳的制备条件:当CS与甘油质量比为1∶1.4,CS分子量为31~65万,苦参碱含量为5%时,制备的载药膜具有良好的物理性能;(2)SEM观察到Mat药物聚集在载药膜的底面,呈现不对称分布;(3)制备的载药膜的基质材料天然、绿色、无毒、可降解,制备方法简单易行,避免了大量有机溶剂的使用,有望可以作为口腔溃疡膜剂的载体载药膜材料。
进一步探讨了负载植物源药物的Mat/CS载药膜和Mat/CS/CMC载药膜的体外释放行为,研究结果表明:(1)CS分子量影响载药膜的药物释放,分子量越小药物释放越快,释放时间可以达到23 h;(2)在Mat/CS 载药膜表面涂CMC可以延缓药物的释放,比如,在底面涂一层1% CMC溶液可以将释放时间从23 h 延缓至108 h。制备的Mat/CS载药膜和Mat/CS/CMC载药膜的缓释药效时间明显要高于一些文献报道的壳聚糖衍生物载药膜的释放时间[18, 19]。
| [1] |
杨雪霞, 步国建. 一种用于治疗口腔溃疡的贴膜及其制备方法[P]. 中国: 201510053409, 2015-02-02. ( 1) 1)
|
| [2] |
曾虹, 窦厚松, 郜宁. 壳聚糖口腔药膜的制备[J]. 华西口腔医学杂志, 2004, 22(3): 260-4. ( 1) 1)
|
| [3] |
Caetano GF, Cipriani MA, Moretti TA, et al. Chitosan-alginate membranes accelerate wound healing[J]. J Biomed Mater Res B Appl Biomater, 2015, 103(5): 1013-22. ( 1) 1)
|
| [4] |
Dowling MB, Kumar R, Keibler MA, et al. A self-assembling hydrophobically modified chitosan capable of reversible hemostatic action[J]. Biomaterials, 2011, 32(13): 3351-7. ( 1) 1)
|
| [5] |
Barata JF, Pinto RJ, Vaz Serra, et al. Fluorescent bioactive corrole grafted-chitosan films [J]. Biomacromolecules, 2016, 17(4): 1395-403. ( 1) 1)
|
| [6] |
Huang Y, Zhong ZB, Duan B, et al. Novel fibers fabricated directly from chitin solution and their application as wound dressing[J]. J Mater Chem B, 2014, 2(22): 3427-32. ( 1) 1)
|
| [7] |
Xu C, Lei C, Meng LY, et al. Chitosan as a barrier membrane material in periodontal tissue regeneration[J]. J Biomed Mater Res B Appl Biomater, 2012, 100B(5): 1435-43. ( 1) 1)
|
| [8] |
施晓文, 邓红兵, 杜予民. 甲壳素/壳聚糖材料及其应用[M]. 北京: 化学工业出版社, 2015: 265-8. ( 1) 1)
|
| [9] |
Pan QM, Li YH, Hua J, et al. Antiviral Matrine-Type alkaloids from the rhizomes of sophora tonkinensis[J]. J Nat Prod, 2015, 78(7): 1683-8. ( 1) 1)
|
| [10] |
何雄, 韦星船, 田裕昌. 苦参碱及其衍载药合成及载药活性研究进展[J]. 中国现代应用药学, 2011, 28(9): 816-23. ( 1) 1)
|
| [11] |
Zhang B, Liu ZY, Li YY, et al. Antiinflammatory effects of matrine in LPS-induced acute lung injury in mice[J]. Eur J Pharmacol, 2011, 44(5): 573-9. ( 1) 1)
|
| [12] |
Zhao J, Wan XY, Luo M, et al. Antifibrotic effects of glycyrrhizin and matrine in vitro and in vivo[J]. Biomed Prevent Nutr, 2012, 2(2): 132-6. ( 1) 1)
|
| [13] |
Wang YY, Yuan J, Yuan XP, et al. Observation of antinociceptive effects of oxymatrine and its effect on delayed rectifier K+ currents (Ik) in PC12 cells[J]. Neurochem Res, 2012, 37(10): 2143-9. ( 1) 1)
|
| [14] |
Li XE, Chu WM, Liu JL, et al. Antiarrhythmic properties of Long-Term treatment with matrine in arrhythmic rat induced by coronary ligation[J]. Biol Pharm Bull, 2009, 32(9): 1521-6. ( 1) 1)
|
| [15] |
吴智慧, 黄绳武, 胡锡波. 苦参载药碱的药理研究进展[J]. 中南药学,2006, 4(5): 380-2. ( 1) 1)
|
| [16] |
郭林丰, 童姗姗, 余江南, 等. 苦参碱抗肿瘤作用机制研究进展[J]. 中国中药杂志, 2013, 38(20): 3409-12. ( 1) 1)
|
| [17] |
张艳华, 魏玉辉, 刘志红, 等. 苦参碱壳聚糖微球的制备及体外释药[J]. 中国医院药学杂志, 2006, 26(3): 307-10. ( 1) 1)
|
| [18] |
刘硕, 仵文英. 乳糖化羧甲基壳聚糖包覆的苦参碱脂质体的研制及其肝靶向研究[D]. 西安: 西安交通大学, 2007. ( 1) 1)
|
| [19] |
Zhang LL, Li P, Li YM, et al. Preparation and characterization of magnetic alginate-chitosan hydrogel beads loaded matrine[J]. Drug Dev Ind Pharm, 2012, 38(7): 872-82. ( 1) 1)
|
 2016, Vol. 36
2016, Vol. 36
