广东省人民医院//广东省 医学科学院2医学研究中心,
3心血管内科,
4广东省老年医学研究所,广东广州510080;
5华南理工大学医学院, 广东 广州 510006;
6广东药学院附属第一医院心内科,广东 广州 510080
2Medical Research Center,
3Department of Cardiology,
4Institute of Geriatric Medicine, Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080, China;
5School of Medicine of South China University of Technology, Guangzhou 510006, China;
6Department of Cardiology, First Affiliated Hospital of Guangdong Pharmaceutical University, Guangzhou 510080, China
组织工程血管(tissue engineered blood vessels,TEBV)是将正常血管壁细胞与可降解生物聚合材料组合,于适宜微环境中制备、重建和再生的血管替代物[1, 2]。理想的组织工程血管应具备良好的生物特性及力学性能,能运用于临床,部分或完全取代病变血管[3, 4]。组织工程血管的培养需要良好的微环境,包括生物化学微环境和生物力学微环境,生物力学微环境为细胞维持良好的形态功能、生长增值或凋亡等所不可或缺的因素[5]。组织工程血管的形成建立在优良的细胞功能之上,理想的组织工程血管需具备类似生理血管的形态结构及力学性能,因此,适宜的生物力学微环境对构建理想的组织工程血管至关重要。
本课题组前期研究中,利用自主研发的生物反应器与罗叶泵及驱动装置进行组合,辅以储液顺应腔,以弹性硅胶管为液流管路,组建组织工程血管三维培养体系,使用平滑肌细胞初步培养出具备一定形态和功能的血管样组织[6, 7, 8]。但是根据压力监测的数据显示,生物反应器内的力学波形与人体动脉系统的压力波形有明显的差别,因此,从仿生的角度考虑系统应力刺激应该还有进一步改进的空间。本研究于三维培养体系生物反应器出口外侧添加阻力气泵装置,收集数据分析改进后的应力变化情况,并进一步通过平滑肌细胞三维培养的结果来验证改进的效果。
1 材料和方法 1.1 基于罗叶泵的脉动式组织工程血管三维培养体系的组建以罗叶泵(广东省心血管病研究所研发,东莞科威医疗器械有限公司制作)及驱动(东莞科威医疗器械公司)为动力源,气泵(ACO-5505 广东海利集团有限公司)为阻力源,参考前期研究方法完成组织工程血管三维培养体系的组建[8](图1)。
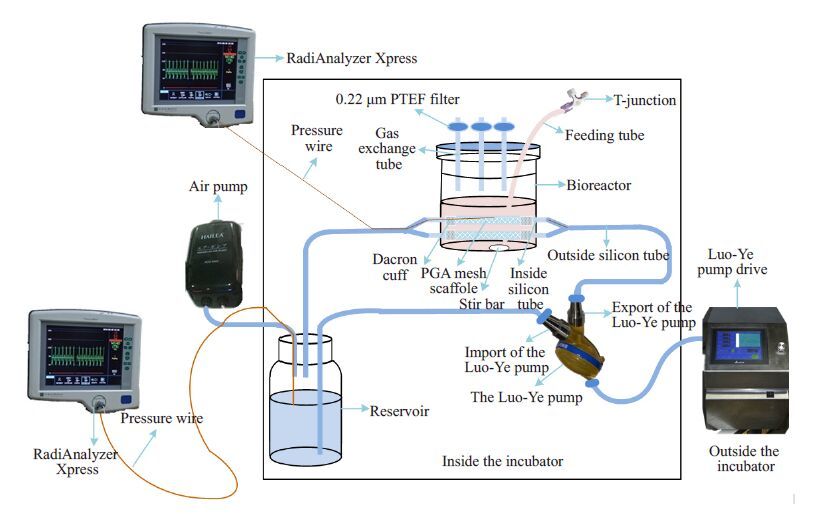
|
图1 组织工程血管三维培养体系完整示意图 Fig.1 Diagrammatic illustration of the pulsatile tissue-engineering culture system. |
此系统主要由储液顺应腔与气泵组成,储液顺应腔包括体部的瓶身及三孔顶盖,顶盖的三孔分别连接循环体系中的流入端硅胶管、流出端硅胶管和介导阻力施加的通气硅胶管。通气硅胶管远端连接气泵,通过旋转气泵上旋钮调控阻力的输出值。
1.3 生物反应器硅胶管内应力的检测预设罗叶泵输出压力为120 mmHg,输出频率为60 bpm,借助动脉生理检测仪及压力导丝,检测随机设定阻力分别为0、40 mmHg时生物反应器硅胶管内入口端、中端和出口端的应力变化,观察应力波形,记录数据,采用Origin8.0 软件对所采集数据作Sina拟合获得拟合函数及应力-时间变化曲线,并计算曲线下面积,比较硅胶管内单位面积上应力作用的时间累积效应。
1.4 不同应力作用时间下组织工程血管的构建 1.4.1 种子细胞的获取及增殖获取健康足月剖腹产脐带,在超净工作台中“袖套状”钝性分离脐动脉,采用组织贴块法进行VSMC的原代培养,以第2代VSMC作为构建TEBV的种子细胞。参照前期研究方法配置VSMC培养所需培养基[7],并在此基础上添加20 μg/mL L-丙氨酸,50 μg/mL L-脯氨酸,50 μg/mL甘氨酸,3 ng/mL铜离子。F12-K基础培养基、0.25%胰酶购自杭州吉诺公司,人血小板源性生长因子(PDGF-BB)、碱性成纤维细胞生长因子(bFGF)购自Prospec 公司,胎牛血清购自Corning公司,L-丙氨酸、L-脯氨酸、甘氨酸、L-抗坏血酸购自Sigma公司,五水硫酸铜购自上海阿拉丁集团有限公司。
1.4.2 组织工程血管三维培养的构建参照前期研究方法[7],以聚乙醇酸(polyglycolic acid,PGA,英国Equl公司)无纺布为培养支架,构建VSMC-PGA复合物的三维培养。初期各组三维培养均于37 ℃、5% CO2培养箱中静态培养1周,之后按分组条件完成后期培养,以1次/周的频率、1/2的比例更换反应器内培养基。
1.4.3 实验分组根据VSMC三维培养过程中是否施加搏动性张应力及有无添加阻力气泵分成改进组、对照组及静态组3组,每组重复培养4次,总培养时间四周。其中改进组生物反应器出口外侧添加的阻力为40 mmHg;改进组和对照组罗叶泵驱动输出压力固定为120/-10 mmHg、输出频率为60 b/min;静态组不施加应力。
1.5 TEBV标本的获取与组织学检测第4周末终止三维培养,并获取各组新生组织,沿横断面分段截取,行HE染色、Masson三色染色、免疫组化α-SMA表达量、扫描及透射电子显微镜等组织学检测。
1.6 图像分析及统计学处理采用Image-pro plus 6.0图像分析系统,对3组新生组织病理学染色图片进行管壁成分半定量分析。每个标本随机选取4张切片,在倒置相差显微镜200倍放大倍数下随机选取7个测定域,并按统一标准测定管壁中胶原纤维含量(目标面积/统计场面积)及α-SMA表达量(IOD/Area),采用SPSS20.0软件、进行多组间比较的单因素方差分析,方差齐的组间两两比较采用LSD-t法,方差不齐的组间两两比较采用Dunnett's T3法,P<0.05差异具有统计学意义。
2 结果 2.1 生物反应器硅胶管内力学微环境检测与分析 2.1.1 生物反应器硅胶管内应力波形图未施加反应器输出端阻力时,反应器内硅胶管应力波呈单峰脉动曲线,波峰形成后迅速衰减至低于0 mmHg的基线值,在每个波形周期中存在一定的无应力作用期(图2A)。施加阻力后,应力波呈双峰脉动曲线,波峰与波谷值显著升高,且呈渐变过程,波谷值远高于0 mmHg基线值,可为TEBV的三维培养提供持续的脉动应力作用(图2B)。
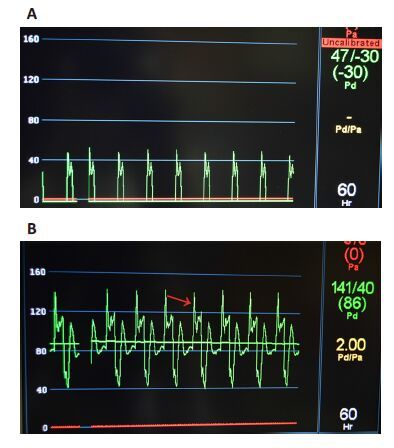
|
图2 生物反应器硅胶管内应力波形图 Fig.2 Stress waveform of the bioreactor generated either under the condition with a preset resistance of 0 mmHg (A) and 40mmHg (B) when the Luo-Ye pump operated at 60 beats per minute (bpm) to generate exerting systolic/ diastolic pressures of 120/-10 mmHg. Red arrow indicates the stress waveform. |
通过origin8.0软件sina拟合得出应力-时间变化曲线如图3所示,当固定罗叶泵输出功率时,施加阻力后反应器硅胶管内持续受应力刺激,且应力值远高于无阻力状态;无阻力状态下,硅胶管内存在一定无应力作用期。求得拟合函数$y={{y}_{0}}+A\sin \left[ \frac{\pi \left( x-{{x}_{c}} \right)}{w} \right]$,根据数据进一步计算出施加阻力与否时,应力-时间变化曲线下面积分别为:15.098 kPa·s、4.332 kPa·s,曲线下面积代表单位面积上的压力冲量大小,即在罗叶泵和气泵协同作用下产生的应力作用于生物反应器内硅胶管单位面积上的时间累积效应。
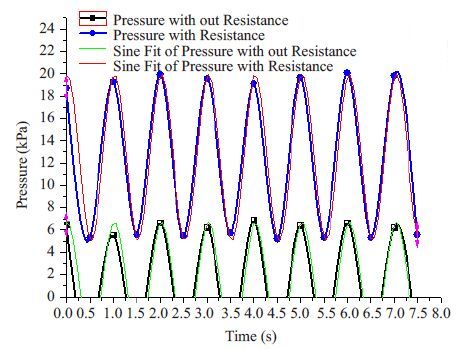
|
图3 Sina拟合的应力-时间变化曲线 Fig.3 Fit sine for the stress change curve over time with (red) or without resistance (green). The stress stimuli from Luo-Ye pmup were strengthened by adding an air pump to the output of the bioreactor. |
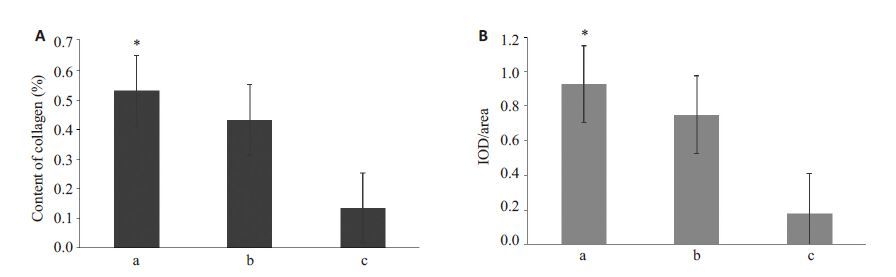
VSMC-PGA复合物于生物反应器中共培养4周后获取新生组织,由组织学检测可见,改进组血管样结构中VSMC、胶原纤维密布于管壁全层,细胞取向与管壁纵轴方向一致,外层密度大于内中层,胶原纤维呈束状排列规整,部分相互融合,穿插于PGA碎片间隙中(图4A、D)。对照组TEBV管壁较为疏松,细胞密度及胶原纤维含量低于改进组(图4B、E、5A)。静态组管壁极为疏松,残留大量PGA结构,细胞及胶原纤维分布稀疏,散乱(图4C、F)。TEBV管壁α-SMA的表达如图4(G~I)所示,改进组及对照组TEBV 管壁全层均高表达α-SMA,改进组α-SMA表达强度高于对照组及静态组(图5B)。
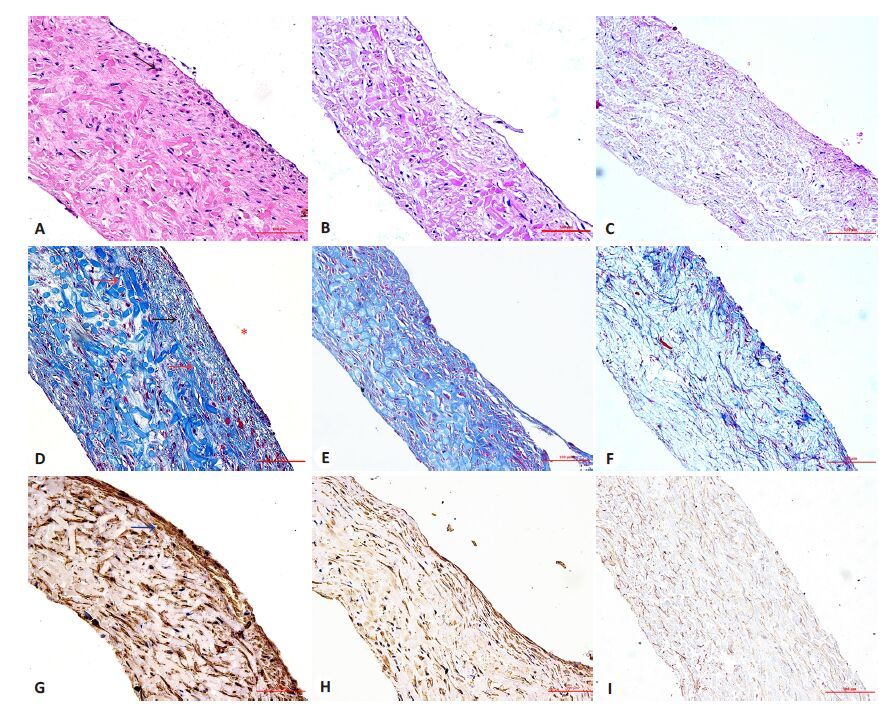
|
图4 各组新生组织管壁横断面H&E染色(A~C)、masson染色(D~F)、α-SMA免疫组化染色(G~I) Fig.4 Histological appearance of TEBV grown under dynamic conditions with 40 mmHg-resistence (A, D, G), dynamic conditions without resistence (B, E, H) or static conditions (C, F, I). A-C: HE staining; D-F: Masson Tricrome staining; G-I: α-SMA immunohistochemical staining; Red arrow: Collagen; Black arrow: VSMC: Purple arrow: PGA; Blue arrow: Positive expression of α-SMA; Scale bars: 100 μm. *: Outside edge of TEBV. |
|
图5 各组新生组织病理染色图片分析:胶原纤维含量(A)和α-SMA的表达量(B)的半定量比较 Fig.5 Content of collagen fibers (A) and expression of α-SMA (B) in TEBV grown under dynamic condition with 40 mmHg resistance (a, the improved group), dynamic condition without resistance (b) and static condition (c). Results are presented as Mean±SE. *P <0.01 vs control and static group. |
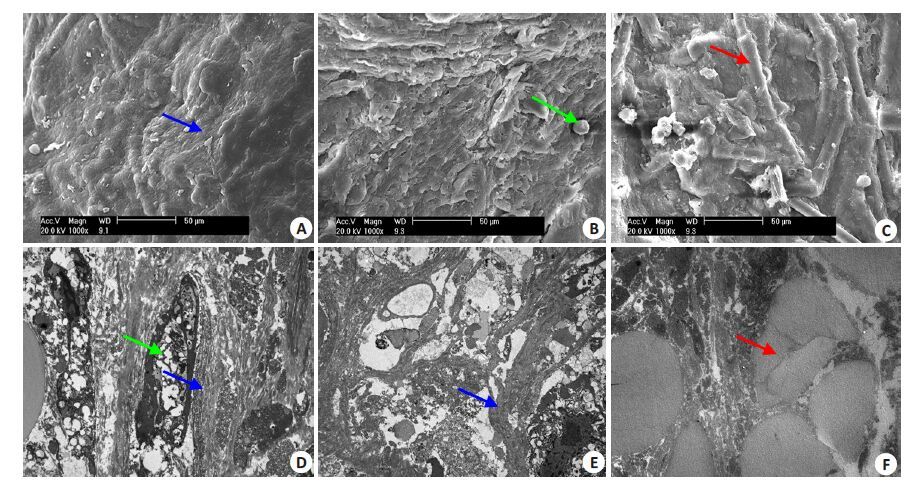
扫描电镜下可见改进组新生组织管壁表面光整,富含细胞外基质(ECM),ECM包绕并取代PGA成为管壁的主要成分(图6A);对照组ECM相对丰富但局部分布不均(图6B);静态组ECM含量少,散在分布于PGA周围,可见大量断裂的PGA结构(图6C)。透射电镜下可见改进组血管样结构管壁VSMC呈长梭形,细胞取向一致,分布规则,富含细胞器,环绕细胞分布着大量排列规整的胶原纤维(图6D);对照组TEBV管壁胶原纤维含量相对丰富,但排列紊乱,可见残存的PGA碎片(图6E);静态组未见细胞结构,散在排列紊乱的胶原纤维,可见分布致密的PGA横断面结构(图6F)。
|
图6 各组新生组织管壁扫描(A~C)和透射电镜(D~F)检测 Fig.6 SEM (A-C, original magnification: × 1000) and TEM (D-F, × 3000) analyses of the TEBV grown under dynamic condition with resistance (A, D), dynamic condition without resistance (B, E) or under static condition (C, F). Green arrow: VSMC; Red arrow: PGA fragments; Blue arrow: Collagen. |
心脏作为心血管系统的“动力源”,其周期性收缩形成射血力,推动血液在人体体内循环流动。心搏周期心室肌肉收缩所释放的能量,一部分成为推动血液迅速流动的动能,另一部分通过大动脉血管壁扩张吸收转化为位能,表现为动脉血压,成为心室舒张时继续推动血液流动的动力。富含各种组分的粘稠血液在血管内流动,对动脉脉管主要产生两种力学作用:径向剪切力和周向张应力。平滑肌细胞构成动脉中层的主要细胞成分,所接受的是周向张应力。
VSMC作为血管生成及发挥功能的主要细胞成分,持续承受血管搏动性变化引起的张应力作用,维持细胞增殖、迁移、表型转化及合成分泌等功能[10, 11, 12]。Niklason 等[13, 14]以VSMC为种子细胞,PGA为培养支架成功构建出爆破张力超过3000 mmHg 的TEBV,首先证明应力刺激可促进TEBV 构建及成熟。然而该三维培养体系以蠕动泵为动力源,应力环境依赖于蠕动泵165、245 b/min 的高频工作及较高的静压力来维持[15, 16],与生理应力环境存在较大差异。基于Niklason 研究的基础,本研究团队改用具有相关知识产权的罗叶泵及动力驱动装置作为主动力源,初步培养出一定形态功能的类血管组织。由于压力监测图形显示反应器内硅胶应力波呈单峰脉动曲线,波峰形成后迅速衰减,每个波形周期中存在一定的无力学作用期,这一力学变化似乎与机体体内压力变化不同。本研究在生物反应器输出口外侧增加气泵来施加阻力,从压力监测的波形就发现应力波改变为双峰脉动曲线,波峰与波谷值显著升高,波谷远高于0 mmHg基线值。实际上就是可以把动力源产生的能量转变为反应器内硅胶管的位能,持续存在脉动应力作用。通过origin8.0软件sina拟合得出反应器硅胶管内的应力-时间变化曲线,求得曲线下面积,可见施加阻力后硅胶管内应力-时间变化曲线下面积显著高于无阻力状态,即作用于硅胶管单位面积上的时间累积效应显著高于单纯动力源作用下的效应,提示气泵作用下产生的阻力与动力源作用下产生的脉动张应力形成协同效应,并有助于脉动张应力在三维培养体系中的维持。
本研究以VSMC为种子细胞完成4周的三维培养,进行改良前后的效果验证,经过4 周培养后获得具有一定形态结构及性能的血管样组织。结果显示改进后构建的血管样结构具有较好的弹性及韧性,其形态及特性均优于未改进的动态及静态条件下的培养组织相应性能。组织学分析显示施加阻力的脉动应力环境下培养的血管样结构管壁细胞分布及密度、胶原纤维含量及排列、α-SMA 表达量均优于无阻力动态培养组及静态培养组。从而证实施加阻力的脉动应力环境可提高TEBV生物反应器内硅胶管单位面积的应力时间累积效应,并提高VSMC的合成及分泌功能,促进TEBV的构建。
| [1] |
Mitchell SL, Niklason LE. Requirements for growing tissueengineeredvascular grafts[J]. Cardiovasc Pathol, 2003, 12(2):59-64. ( 1) 1)
|
| [2] |
Peck M, Gebhart D, Dusserre N, et al. The evolution of vasculartissue engineering and current state of the art[J]. Cells TissuesOrgans, 2012, 195(1/2): 144-58. ( 1) 1)
|
| [3] |
Huang AH, Niklason LE. Engineering of arteries in vitro[J]. Cellularand Mol Life Sci, 2014, 71(11): 2103-18. ( 1) 1)
|
| [4] |
Dahl SL, Blum JL, Niklason LE. Bioengineered vascular grafts: canwe make them off-the-shelf[J]? Trends Cardiovasc Med, 2011, 21(3): 83-9. ( 1) 1)
|
| [5] |
Solan A, Dahl SL, Niklason LE. Effects of mechanical stretch oncollagen and cross-linking in engineered blood vessels[J]. CellTransplant, 2009, 18(8): 915-21. ( 1) 1)
|
| [6] |
周嘉辉, 吴岳恒, 李东风, 等. 新型生物反应器用于构建组织工程血管的初步探索[J]. 广东医学, 2013, 34(13): 1971-3. ( 1) 1)
|
| [7] |
周嘉辉, 吴岳恒, 李东风, 等. 脉动式张应力环境下培养组织工程血管的初步实验[C]//第15 届中国南方国际心血管病学术会议论文集.03, 广州, 2013: 187-91. ( 3) 3)
|
| [8] |
吴岳恒, 黄焕雷, 周嘉辉, 等. 基于罗叶泵的搏动式组织工程培养体系的构建[J]. 中国医学装备, 2013, 10(8): 1-5. ( 2) 2)
|
| [9] |
Gao J, Niklason L, Langer R. Surface hydrolysis of poly(glycolicacid) meshes increases the seeding density of vascular smoothmuscle cells[J]. J Biomed Mater Res, 1998, 42(3): 417-24. ( 1) 1)
|
| [10] |
Beamish JA, He P, Kottke-Marchant K, et al. Molecular regulationof contractile smooth muscle cell phenotype: implications forvascular tissue engineering[J]. Tissue Eng Part B Rev, 2010, 16(5):467-91. ( 1) 1)
|
| [11] |
Stegemann JP, Hong H, Nerem RM. Mechanical, biochemical, andextracellular matrix effects on vascular smooth muscle cellphenotype[J]. J Appl Physiol (1985), 2005, 98(6): 2321-7. ( 1) 1)
|
| [12] |
Gupta V, Grande-Allen KJ. Effects of static and cyclic loading inregulating extracellular matrix synthesis by cardiovascular cells[J].Cardiovasc Res, 2006, 72(3): 375-83. ( 1) 1)
|
| [13] |
Niklason LE, Gao J, Abbott WM, et al. Functional arteries grown invitro[J]. Science, 1999, 284(5413): 489-93. ( 1) 1)
|
| [14] |
Dahl SL, Kypson AP, Lawson JH, et al. Readily available tissueengineeredvascular grafts[J]. Sci Transl Med, 2011, 3(68): 68ra9. ( 1) 1)
|
| [15] |
Huang AH, Niklason LE. Engineering biological-based vasculargrafts using a pulsatile bioreactor[J]. J Vis Exp, 2011(52): 1-6. ( 1) 1)
|
| [16] |
Huang AH, Lee YU, Calle EA, et al. Design and use of a novelbioreactor for regeneration of biaxially stretched Tissue-Engineeredvessels[J]. Tissue Eng Part C Methods, 2015, 21(8): 841-51. ( 1) 1)
|
 2016, Vol. 36 Issue (7): 1008-1013 DOI:
2016, Vol. 36 Issue (7): 1008-1013 DOI: 
