肾癌是泌尿系统最常见的恶性肿瘤之一,男女发病率约为2∶1,在美国成人泌尿生殖系肿瘤中发病率仅次于膀胱癌,约占成人肿瘤3%[1]。在我国约占成人肿瘤的2~3%,且由于环境因素的改变、腹部放射线检查增多等因素,其发病率有逐年增高趋势[2]。与其它恶性肿瘤相比,肾癌对放、化疗均不敏感,报道的有效率不及10%。石蒜碱(Lycorine)是从我国广泛分布的多年生草本植物石蒜鳞茎中分离出的一种化学单体,属于异喹啉类(Isoquinoline)生物碱。据文献报道,石蒜碱及其衍生物对白血病[3-5]、多发性骨髓瘤[6]、脑胶质瘤[7]、黑色素瘤[8]、卵巢癌[9]、前列腺癌[10]等肿瘤细胞具有抑制增殖及促凋亡作用。目前,石蒜碱对肾癌细胞的作用及其可能机制未见相关报道。本研究探索了石蒜碱对转移性肾癌细胞ACHN的细胞功能学影响,并在基因及蛋白水平对其作用机制进行了进一步探索,在肾癌的新药研究及新治疗靶点寻找方面具有重要意义。
1.1 材料和方法 1.1 材料人肾癌ACHN细胞株购自上海中国科学院细胞库。石蒜碱(Lycorine,纯度≥98%)购自上海源叶生物科技有限公司。RPMI 1640 培养基(Gibco)、0.25%胰酶(Gibco)、胎牛血清(Gibco)、MTS(Promega)、Transwell小室及基质胶、反转录试剂盒、RT-PCR试剂盒(Takara,日本)均购自广州永津生物科技有限公司。qRT-PCR引物由上海生工公司合成,抗体购自CST公司、Abcam公司。
1.2 实验方法 1.2.1 细胞培养ACHN细胞以RPMI 1640培养基(含50×103 U/L青霉素、50 mg、L链霉素)+10%FBS,于5%CO2培养箱中培养,每3~4 d换液传代1次。
1.2.2 石蒜碱溶液配制石蒜碱用二甲基亚砜(DMSO) 配成l00 μmol/L的母液,-80 ℃储存备用。使用前用含l0%胎牛清的RPMI 1640培养液配成不同浓度的工作液。加药前用0.22 μm滤膜过滤除菌,DMSO与培养基的体积比不超过0.1%。
1.2.3 IC50测定取对数生长期的细胞,调整细胞密度为5×104个/mL,按每孔100 μL 接种于96 孔板,放置于37 ℃、5%CO2的培养箱中过夜培养。待细胞贴壁生长后,加入不同浓度(0、0.05、0.125、0.25、0.625、1.25、2.5、5、10、20、50、100 μmol/L)的石蒜碱。培养48 h后,每孔加入MTS 20 μL,放置于37 ℃、5% CO2培养箱中孵育1 h,用酶标仪在490 nm处测定A值,每组设5个复孔。抑制率=[1-(加药组平均A值—空白组平均值)/(正常对照组平均A值—空白组平均A值)]×100%。
1.2.4 流式细胞仪测细胞凋亡及周期取对数生长期的细胞,制成单细胞悬液,调整细胞密度为3×105 mL,接种细胞到6 孔板内,放入37 ℃,5% CO2培养箱培养过夜,待其长至50%汇合度时取出6孔板,吸尽培养液,依次加入预先配制好的浓度分别为0、1、5、25 μmol/L的石蒜碱溶液2 mL于准备处理的细胞中,培养24 h后,收集细胞及其上清液,用凋亡试剂盒进行处理,并进行流式检测。
1.2.5 增殖实验取对数生长期的细胞,调整细胞密度并接种到96孔板,使达到2×103个/孔。设空白组和石蒜碱处理组,每组5个复孔。放人37 ℃、5% CO2的培养箱培养,贴壁后换液并对石蒜碱组加药处理。分别于加药后0、24、48、72 h 各时间点加入20 μL MTS,37 ℃孵育1 h后酶标仪测490 nm 处A值。
1.2.6 迁移及侵袭实验用记号笔在6孔板底做记号,用中枪头在长满细胞的6 孔板中划痕,并于划痕后换液(处理组加药)。分别在划痕后12、24、36 h 拍照,用Image-Pro Plus 6.0计算不同时间点划痕宽度。实验设3个复孔。
取对数生长期细胞,设空白组和石蒜碱组(5 μmol/L),无血清培养基培养12 h 后(石蒜碱组加0.5 μmol/L预处理)胰酶消化制成单细胞悬液,调整细胞数为1.5×105/mL。将4 ℃过夜融化的基质胶稀释后加入Transwell小室,37 ℃温育30 min,取200μL细胞悬液加入小室,并避免产生气泡(迁移实验则不加基质胶)。24孔板相应孔加入600 μL 含15%FBS的RPMI 1640,培养48 h后终止。PBS洗小室2遍,棉签拭去残留基质胶。先将小室置4%多聚甲醛溶液固定15 min,再放入0.1%结晶紫染色液染色20 min,最后以PBS清洗小室内和底部残留染色液,晾干后于倒置显微镜下观察拍照,并采用人工计数法,取4个随机视野统计细胞数。
1.2.7 平板克隆实验取对数生长期细胞,以200/孔的密度接种到6孔板中。待细胞贴壁后换液并按正常对照组、5 μmol/L石蒜碱组加药处理,静置生长10 d后终止培养。用PBS缓慢清洗2遍后加入4%多聚甲醛固定10 min,加入0.1%结晶紫染色15 min,吸去染色液,风干并拍照。人工计数法计数细胞数大于50个的集落。
1.2.8 qRT-PCR用TRIzol裂解实验组及对照组细胞,提取总RNA。按照Takara逆转录试剂盒说明配制反应液,先去除原有基因组,反应参数:42 ℃,2 min→4 ℃;再合成cDNA,反应参数:37 ℃,15 min→85 ℃,5 s→4 ℃。在EcoTM illumina Real-Time PCR System(美国Eco 公司)反应仪进行反应,引物见表 1。循环参数:95 ℃ 10 min激活相关酶;再按95 ℃ 15s,60 ℃ 60 s进行40 个循环;最后按95 ℃ 15 s,55 ℃ 40 s,最后95 ℃15 s结束反应。GAPDH为内对照,用2-ΔΔCt法分析实验结果。
| 表1 实时荧光定量PCR引物序列 Tab. 1 Primer sequences for qRT-PCR |
将6孔板各孔用PBS清洗2遍,每孔加入150 μL裂解液(RIPA:蛋白酶抑制剂=4∶1),冰上水平放置30 min,用刮匙刮取收集各孔裂解后混合液,4 ℃,12 000 r/min 离心30 min,取上清,用BCA蛋白定量法测定各标本蛋白含量,加5×上样缓冲液,95 ℃ 5 min,置-80 ℃保存备用。每泳道取上述各标本
50 μg进行常规8%~12%聚丙烯酰胺凝胶电泳,转膜,BSA封闭,然后依次进行一抗和二抗反应,免疫化学发光显色。β-actin作为内对照。
1.2.10 统计方法计量资料用均数±标准差表示,统计方法选用t检验或χ2检验。计数资料比较采用χ2检验。相关性检验采用Pearson 法。数据采用GraphPad Prism 6软件处理,所有检验均为双侧检验,P<0.05被认为差异有统计学意义。
2 结果 2.1 石蒜碱对ACHN形态及生长的影响石蒜碱对ACHN 细胞的半数抑制浓度为24.34μmol/L。培养24 h即发现5 μmol/L的石蒜碱即能改变细胞正常形态,抑制肾癌细胞ACHN生长。
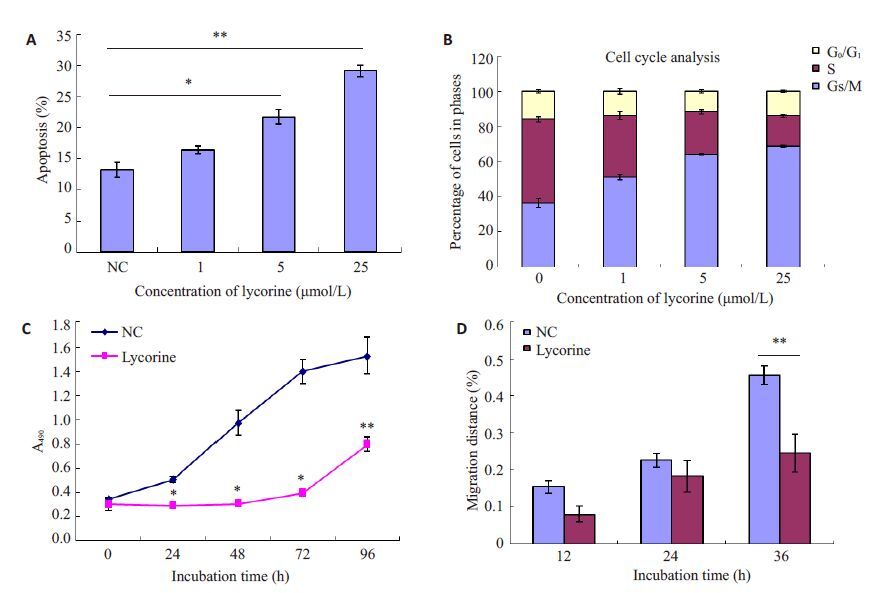
2.2 石蒜碱能阻滞ACHN细胞周期、诱导ACHN细胞凋亡3个浓度石蒜碱均能诱导ACHN细胞凋亡,1 μmol/L石蒜碱处理组与正常对照组比较,无统计学意义(P>0.05);5 μmol/L、25 μmol/L石蒜碱处理组与正常对照组相比均有统计学意义(5 μmol/L vs NC,P<0.05;25 μmol/Lvs NC,P<0.01,图 1A)。诱导凋亡细胞比例与石蒜碱浓度呈剂量依赖关系(r=0.988,P<0.05)。各浓度石蒜碱处理后ACHN细胞G1/G0期和S期比例均发生改变(P<0.01,图 1B)。
|
图1 石蒜碱对ACHN细胞凋亡、周期、增殖和迁移能力能力的影响 Fig.1 Effect of lycorine on apoptosis (A), cell cycle distribution (B), proliferation (C), and migration (D) of ACHN cells. *P<0.05, **P<0.01. |
酶标仪分别检测第0、24、48、72 h实验组和对照组490 nm处吸光度(A值),减去空白对照组平均A值后绘制各时间点细胞增殖直方图。实验组加药处理后24 h开始出现统计学差异,5 μmol/L石蒜碱即能明显抑制肾癌细胞增殖(*P<0.05,**P<0.01;图 1C)。
2.4 石蒜碱能抑制ACHN细胞迁移、侵袭在划痕愈合实验中,经不同处理后36 h,正常对照组的平均迁移距离为划痕宽度的(45.56±2.6)%,5 μmol/L 石蒜碱处理组平均迁移距离为划痕宽度的(24.49± 5.1)% ;石蒜碱处理组细胞迁移距离明显小于正常对照组(P<0.01;图 1D)。
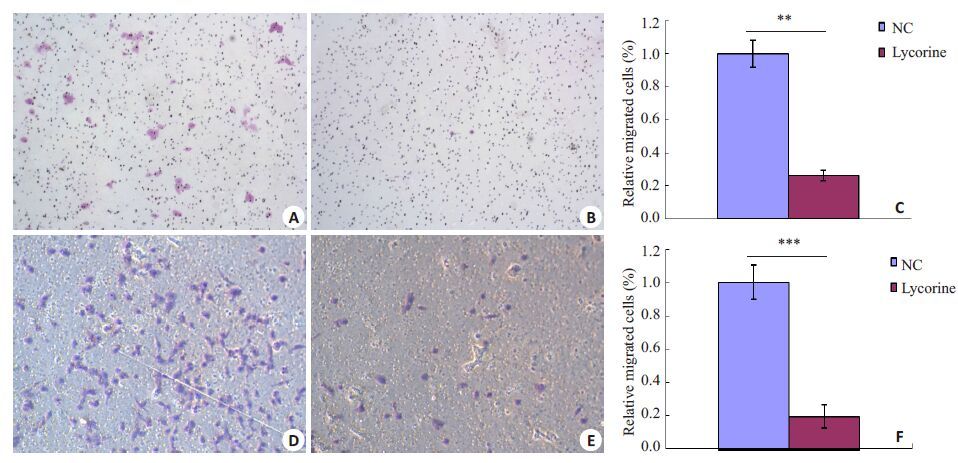
在侵袭实验中,正常对照组穿过小室底膜的细胞数均值为32.5±3.1/视野,石蒜碱处理组穿过底膜细胞数均值为6.25±2.2/视野;实验组细胞数明显少于正常对照组(P<0.01,图 2A~C)。
|
图2 石蒜碱对ACHN细胞迁移、侵袭能力的影响 Fig.2 Lycorine suppressed invasion (A-C) and migration (D-F) of ACHN cells (Original magnification: ×100). **P<0.01, ***P<0.001. |
在迁移实验中,正常对照组穿过小室底膜的细胞数均值为149.5 ±11.9/视野,石蒜碱处理组穿过底膜细胞数均值为39.5±5.7/视野;处理组细胞数明显少于正常对照组(P<0.001,图 2D~F)。
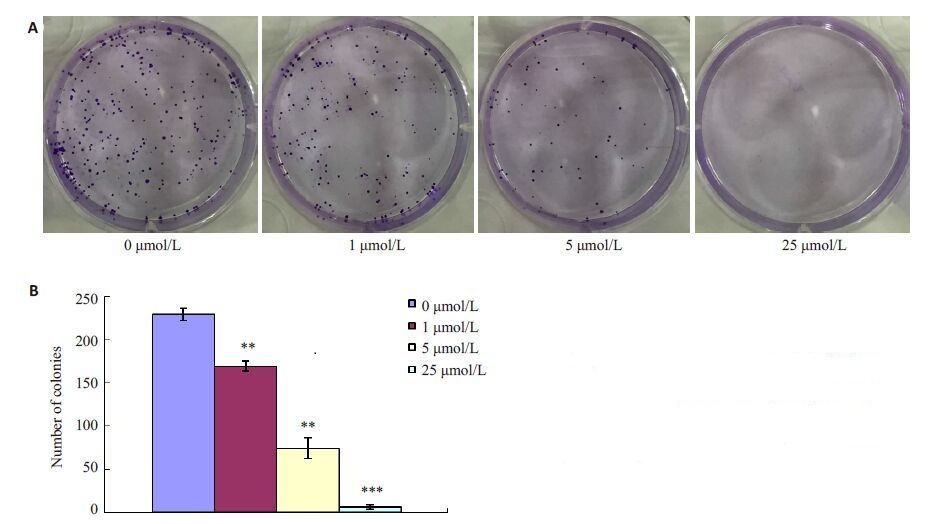
2.5 克隆形成实验如图 3A所示,正常对照组及1 μmol/L石蒜碱处理组可见明显细胞集落形成,5 μmol/L石蒜碱处理组可见较少细胞集落形成,石蒜碱浓度达到25 μmol/L时基本没有细胞集落形成(0 μmol/L vs 1 μmol/L,P<0.01;0 μmol/L vs 5 μmol/L,P<0.001;0 μmol/L vs 25 μmol/L,P<0.001,图 3)。
|
图3 不同浓度石蒜碱对ACHN细胞克隆形成能力的影响 Fig.3 Effect of lycorine on colony formation ability of ACHN cells. **P<0.01; ***P< 0.001 vs 0 μmol/L group. |
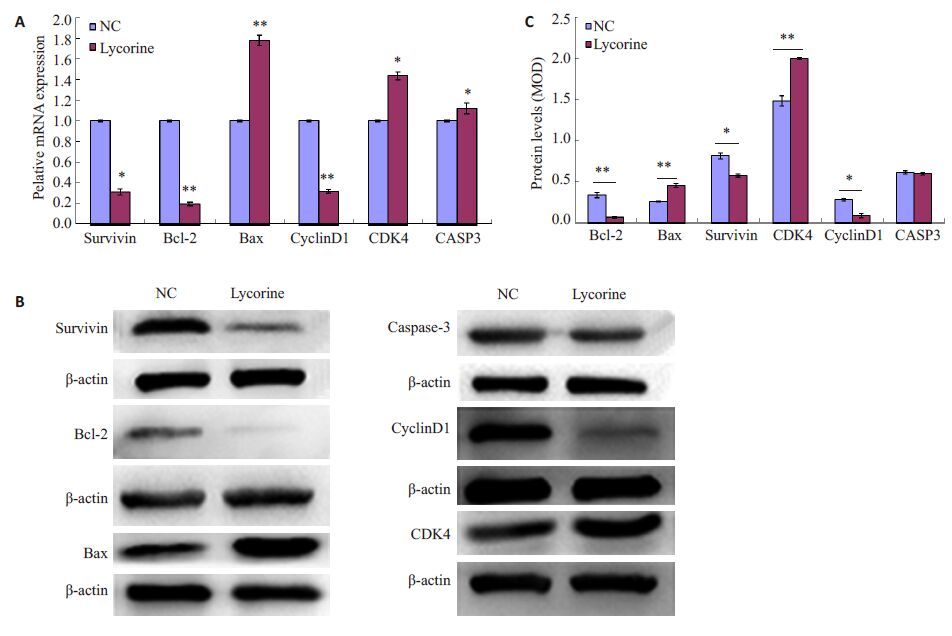
与正常对照组相比,实验组Survivin、Bcl-2 和CylinD1基因表达下调,Bax、CDK4及CASP3表达上调(*P<0.05,**P<0.01,图 4A)。
|
图4 石蒜碱对凋亡及细胞周期相关基因及蛋白表达的影响 Fig.4 Changes of mRNA expressions (A, C) and protein levels (B) in ACHN cells following lycorine treatment. *P<0.05,**P<0.01. |
与正常对照组相比,实验组Survivin,Bcl-2,CyclinD1等蛋白水平降低,Bax 和CDK4 蛋白表达增加,caspase-3变化不显著(*P<0.05,**P<0.01,图 4B~D)。
3 讨论目前,25%~40%的肾癌为偶发肾癌,25%~30%的病人在初次诊断时就已经发生了明显的转移,部分病人发生了亚临床转移。手术是治疗肾癌的主要方法,对于进展期肾癌,以白介素-2为基础的细胞因子治疗及近年开展的靶向治疗有一定的疗效[2]。由于肾癌对放、化疗均不敏感,促进肾癌细胞凋亡及寻找新的药物一直是研究热点。石蒜碱是石蒜科生物碱中含量最丰富的生物碱,具有广泛的生物学作用。已有的研究表明,石蒜碱具有抗炎、干扰脊髓灰质炎病毒、天花病毒、SARS病毒以及抗真菌、抗疟疾等作用[11]。近年来,体外研究已证实该药能诱导多种肿瘤细胞凋亡[3, 5-6, 11-14]。ACHN细胞株来源于已广泛转移的肾癌病人的胸腔积液,是肾癌体外研究常用细胞。
本实验通过流式细胞仪检测发现低浓度石蒜碱即能诱导ACHN细胞凋亡,且凋亡率与石蒜碱浓度呈剂量依赖性(图 1A)。且qRT-PCR及Western blotting结果均发现,与正常对照组相比,5 μmol/L石蒜碱处理组Bcl-2表达量明显降低、Bax表达量增加,Bax/Bcl-2比率增高。Bcl-2和Bax分别是Bcl-2蛋白家族中抑制和促进凋亡的代表分子。李燕等[12]发现Bax/Bcl-2是石蒜碱诱导肿瘤细胞凋亡的重要作用靶点,提高Bax/Bc1-2的比例可增强caspase-8、caspase-9和caspase-3的活性,从而使细胞凋亡。本实验与此相符,石蒜碱可能通过调节Bax/Bcl-2比例及下游caspases促进ACHN细胞凋亡。
此外,本实验还发现凋亡抑制蛋白Survivin在基因及蛋白水平均明显降低,caspase-3 基因转录增加,而caspase-3表达量无显著变化。Survivin是近年来十分受关注的凋亡抑制因子,而caspase-3是凋亡过程中最主要的终末剪切酶,是凋亡的主要“执行者”[15]。胞质中的caspase-3在正常情况下以失活的酶原形式存在,细胞凋亡信号的出现使caspase-3 在多种蛋白水解酶的作用下,发生裂解而活化。Survivin可竞争CDK4,进而使细胞从G1期向S转化,以克服凋亡。另外,Survivin亦可通过抑制线粒体细胞色素C的释放以达到直接或间接抑制凋亡下游效应分子caspase-3和caspase-7,并以周期调节方式和对纺锤体微管作用,促使细胞异常有丝分裂,促进肿瘤进展。qRT-PCR 结果显示caspase-3mRNA表达增加,而caspase-3蛋白水平变化不明显,该现象可能是由于过表达的caspase-3在凋亡过程中迅速裂解活化所致。此外,有研究发现Survivin与X连锁凋亡抑制蛋白(XIAP)的复合物能使NF-κB激活增强,从
而上调纤连蛋白基因(Fibronectin)表达,并通过β1-整合素(β1-integrins)信号激活细胞运动相关激酶如黏着斑激酶(FAK)和FBXL20蛋白,从而促进肿瘤细胞运动和转移[16]。石蒜碱可能通过抑制Survivin蛋白的表达而间接抑制ACHN细胞的附着、迁移、侵袭能力。
另外,本实验发现石蒜碱能将ACHN细胞阻滞于G0/G1期,并抑制ACHN增殖。与Luo等[6]研究发现石蒜碱能增加ARH-77细胞G0/G1期细胞比例,能诱导多发性骨髓瘤细胞KM3[12]和慢性髓性白血病细胞K562[17]在G0/G1期阻滞相一致。而刘静等[3]发现石蒜碱可以将人急性早幼粒白血病细胞(HL-60)阻断在G2/M期,这可能是由于石蒜碱对不同细胞系在周期调节中机制并不相同。qRT-PCR及Western blotting结果均显示细胞周期素D1(CyclinD1)表达水平降低,而细胞周期蛋白依赖性激酶4(CDK4)表达增加。细胞周期素D1(CyclinDl)能控制细胞增殖周期G-S进度,CDK4也与G1期发展相关。G1期阻滞导致ACHN细胞不能进入S期合成DNA,从而抑制了细胞增殖。石蒜碱可能通过改变CyclinDl/CDK4 比例阻滞细胞周期,进而抑制ACHN细胞增殖[12]。
综上所述,我们首次发现石蒜碱能阻滞ACHN细胞于G0/G1期,且抑制其增殖、迁移、侵袭能力,并诱导其凋亡。此外,最新研究发现石蒜碱亦具有抑制骨质破坏的作用[18]。
| [1] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015, 65(1): 5-29.( 1) 1) |
| [2] | Tan X, Liu Y, Hou J, et al. Targeted therapies for renal cell carcinoma in Chinese patients: focus on everolimus[J]. Onco Targets Ther, 2015, 8: 313-21.( 2) 2) |
| [3] | Liu J, Hu JL, Shi BW, et al. Up-regulation of p21 and TNF-alpha is mediated in lycorine-induced death of HL-60 cells[J]. Cancer Cell Int, 2010, 10: 25.( 3) 3) |
| [4] | Mcnulty J, Nair JJ, Bastida J, et al. Structure-activity studies on the lycorine pharmacophore: A potent inducer of apoptosis in human leukemia cells[J]. Phytochemistry, 2009, 70(7): 913-9. |
| [5] | Liu XS, Jiang J, Jiao XY, et al. Lycorine induces apoptosis and down-regulation of Mcl-1 in human leukemia cells[J]. Cancer Lett, 2009, 274(1): 16-24.( 2) 2) |
| [6] | Luo Y, Roy M, Xiao X, et al. Lycorine induces programmed necrosis in the multiple myeloma cell line ARH-77[J]. Tumour Biol, 2015, 36(4): 2937-45.( 3) 3) |
| [7] | Luchetti G, Johnston R, Mathieu V, et al. Bulbispermine: a crinine-type Amaryllidaceae alkaloid exhibiting cytostatic activity toward apoptosis-resistant glioma cells[J]. Chem Med Chem, 2012, 7(5): 815-22.( 1) 1) |
| [8] | Liu R, Cao Z, Tu J, et al. Lycorine hydrochloride inhibits metastatic melanoma cell-dominant vasculogenic mimicry[J]. Pigment Cell Melanoma Res, 2012, 25(5): 630-8.( 1) 1) |
| [9] | Cao Z, Yu D, Fu S, et al. Lycorine hydrochloride selectively inhibits human ovarian cancer cell proliferation and tumor neovascularization with very low toxicity[J]. Toxicol Lett, 2013, 218(2): 174-85.( 1) 1) |
| [10] | Hu M, Peng S, He Y, et al. Lycorine is a novel inhibitor of the growth and metastasis of hormone-refractory prostate cancer[J]. Oncotarget, 2015, 6(17): 15348-61.( 1) 1) |
| [11] | Hayden RE, Pratt G, Drayson MT, et al. Lycorine sensitizes CD40 ligand-protected chronic lymphocytic leukemia cells to bezafibrateand medroxyprogesterone acetate-induced apoptosis but dasatanib does not overcome reported CD40-mediated drug resistance[J]. Haematologica, 2010, 95(11): 1889-96.( 2) 2) |
| [12] | Li Y, Liu J, Tang LJ, et al. Apoptosis induced by lycorine in KM3 cells is associated with the G0/G1 cell cycle arrest[J]. Oncol Rep, 2007, 17(2): 377-84.( 3) 3) |
| [13] | Liu J, Hu WX, He LF, et al. Effects of lycorine on HL-60 cells via arresting cell cycle and inducing apoptosis[J]. FEBS Lett, 2004, 578 (3): 245-50. |
| [14] | Yui S, Mikami M, Kitahara M, et al. The inhibitory effect of lycorine on tumor cell apoptosis induced by polymorphonuclear leukocyte-derived calprotectin[J]. Immunopharmacology, 1998, 40 (2): 151-62.( 1) 1) |
| [15] | Huang Q, Li F, Liu X, et al. Caspase 3-mediated stimulation of tumor cell repopulation during cancer radiotherapy[J]. Nat Med, 2011, 17(7): 860-6.( 1) 1) |
| [16] | Mehrotra S, Languino LR, Raskett CM, et al. IAP regulation of metastasis[J]. Cancer Cell, 2010, 17(1): 53-64.( 1) 1) |
| [17] | Li L, Dai HJ, Ye M, et al. Lycorine induces cell-cycle arrest in the G0/G1 phase in K562 cells via HDAC inhibition[J]. Cancer Cell Int, 2012, 12(1): 49.( 1) 1) |
| [18] | Chen S, Jin G, Huang KM, et al. Lycorine suppresses RANKLinduced osteoclastogenesis in vitro and prevents ovariectomyinduced osteoporosis and Titanium particle-induced osteolysis in vivo[J]. Sci Rep, 2015, 5: 12853.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
