2广州市花都区人民医院, 广东 广州 510800
2 Department ofObstetrics and Gynecology, Huadu District People's Hospital, Guangzhou 510800, China
宫颈癌是女性最常见的生殖系统恶性肿瘤,其发病率逐年升高,并且有年轻化趋势[1]。因此,为宫颈癌患者寻找有效的治疗模式显得尤为重要。当前宫颈癌的治疗模式主要为手术为主,放化疗为辅,而很大部分癌症患者因自身免疫系统及身体耐受情况较差,对手术及放化疗的耐受能力较弱,因此营养支持可成为肿瘤综合治疗中一个重要的组成部分。近年来,美国肠外内营养学会(ASPEN)发布的肿瘤病人相关支持治疗新指南中列举了关于肿瘤患者与摄入ω-3多不饱和脂肪酸的相关性研究,并指出免疫营养物质多不饱和脂肪酸(Polyunsaturated fatty acid,DHA)可以维持肿瘤患者体重,增强免疫力等,在肿瘤患者的治疗开僻了新方向[2]。二十二碳六烯酸(Docosahexaenoic acid,DHA)作为ω-3PUFAs中最重要的一种营养成份,可以抗炎、抗动脉粥样硬化、促进胎儿神经系统发育作用[3],而且越来越多的证据表明其可以抑制多种肿瘤细胞的增殖,但其药理作用复杂,抗肿瘤作用的机制尚不明确,国内有研究表明DHA可能通过mTORC1/2信号通路抑制子宫内膜癌生长[4],而对于其它妇科肿瘤则鲜有报道[5]。本研究就ω-3PUFAs中的DHA对宫颈癌细胞凋亡、侵袭转移的影响做出初步探讨。
1 材料和方法 1.1 材料 1.1.1 细胞来源HeLa细胞、Siha细胞由南方医科大学肿瘤研究所赠送。
1.1.2 主要试剂及耗材胎牛血清、高糖DMEM(Gibco,美国);DHA(Sigma,美国);四甲基偶氮唑盐(MTT,Sigma,美国);兔抗人Bax、Bcl-2、MMP9、VEGF、Cleaved-caspase 3 抗体(CST,美国);羊抗兔二抗(Proteintech,美国);BCA试剂盒(凯基生物,中国);流式细胞凋亡试剂盒(贝博生物);Transwell小室(8.0 μm,Corning,美国)。
1.2 DHA的处理 1.2.1 DHA溶液的配制按照参考文献[6],采用蛋白吸附法对DHA溶液进行溶解:将25 mg DHA按比例溶于0.1 mol/L的NaOH溶液中,55 ℃水浴助溶,5 min左右完成皂化反应;再向皂化液中加入10% BSA溶液,同样在55 ℃水浴中助溶5 min,得到DHA母液,-20 ℃冻存备用。
1.2.2 不同浓度的DHA溶液的配制根据实验需求,将母液予含1%青霉素-链霉素及1% BSA无血清DMEM稀释成所需浓度。DHA溶液刺激前,细胞必须用含1%BSA的DMEM无血清培养基培养6~12 h,以洗脱细胞正常培养时血清中的脂肪酸,降低其对细胞的影响。
1.3 主要方法 1.3.1 细胞培养HeLa细胞、Siha细胞用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM培养基,常规置于37 ℃、5% CO2培养箱中培养,1~2 d换培养液,细胞生长至80%~90%融合时传代。
1.3.2 MTT法测定DHA对宫颈癌HeLa细胞、Siha细胞的抑制作用取对数生长期的HeLa细胞、Siha细胞以1×104/孔的细胞密度接种于96孔板中,每孔加培养基至200 μL,设立5 个复孔。培养24 h 后,给予含1% BSA的无血清DMEM培养基培养6 h后,实验组分别加入不同浓度的DHA(20、40、60、80、100 μmol/L)溶液,对照组加入不含DHA的1% BSA无血清DMEM培养基。分别培养24、48、72 h后,每孔加入5 mg/mL的MTT液体10 μL,放回细胞培养箱中孵育4 h,再每孔加入200 μL DMSO,于振荡器上振荡约10 min,M5 全自动酶标仪(美国MDS公司,型号SpectraMax M5)490 nm波长检测吸光度(A值),以对照组细胞活力为100%,按(公式1):细胞抑制率(%)=(1-药物组A 值/对照组A 值)×100%,计算各组细胞抑制率。
1.3.3 MTT法检测DHA刺激宫颈癌细胞48 h 后IC25、IC50和IC75的浓度取对数生长期的HeLa细胞、Siha细胞以1×104/孔的细胞密度接种于96孔板中,每孔加培养基至200 μL,设立5个复孔。培养24 h后,给予含1%BSA的无血清DMEM培养基培养6 h,HeLa细胞换成DHA终浓度为0、20、40、60、80、100、120、140、160 μmol/L的含1%BSA 的无血清DMEM 培养基,Siha 细胞换成DHA 终浓度为0、25、50、75、100、125、150、175、200、225 μmol/L 的1% BSA的无血清DMEM培养基培养基,分别继续培养48 h后每孔加入5 mg/mL的MTT液体10 μL,放回细胞培养箱中孵育4 h,再每孔加入200 μLDMSO,于振荡器上振荡约10 min,酶标仪(美国MDS公司,型号SpectraMax M5)490 nm波长检测吸光度(A值),计算各组细胞抑制率(公式1)。
1.3.4 Hoechst33258染色液染色检测细胞凋亡取对数生长期的HeLa细胞、Siha细胞以适当密度种植于96孔板内,贴壁生长24 h后,予不同浓度DHA作用48 h,吸尽培养液,加入4%多聚甲醛固定15 min后弃掉,用PBS清洗细胞2 遍并吸干,加入30 μL Hoechst33258 染色液,避光染色10 min,再用PBS清洗2遍后于荧光显微镜下观察拍照。
1.3.5 流式细胞术检测不同浓度DHA刺激宫颈癌细胞48 h的凋亡率采用Annexin V/PI 双染法。取对数生长期HeLa、Siha细胞,按每皿1×106个细胞种植于直径为6 cm的培养皿中,培养24 h待细胞贴壁后,分别加入不同浓度的DHA溶液,对照组加以含1% BSA-DMEM无血清培养基。各组继续培养48 h后,用不含EDTA胰酶消化细胞并收集,PBS 洗2次(1000 r/min 离心5 min)按照贝博凋亡试剂盒方法染色,使用流式细胞仪(LSRFortessa,美国BD)检测细胞凋亡率。
1.3.6 细胞划痕实验检测不同浓度DHA对宫颈癌细胞侧向迁移能力的影响于6孔板背后用mark笔划一横线,取对数生长期的HeLa细胞、Siha细胞经胰酶消化、收集并分别以1×106个细胞种植于6孔板内,常规培养24 h后见各组细胞达到90%以上融合,弃去培养基,用10 μL 移液器枪头在培养板中垂直背后mark 线间隔0.5~1 cm划3~5条平行直线,再以PBS清洗脱落细胞2次,加入不同浓度的DHA含1% BSA的无血清DMEM培养基培养,在0、48 h镜下观察划痕处的细胞迁移情况并拍照,每组至少选取5个视野,并于不同时间点均选取同一视野。运用Image J图像分析软件测得细胞的迁移面积后比较各组间的差异性。实验重复3次。
1.3.7 Transwell迁移实验检测不同浓度DHA对宫颈癌细胞纵向迁移能力的影响取对数生长期的HeLa 细胞、Siha细胞种植于细胞培养皿中,贴壁生长24 h后,分别加入不同浓度的DHA溶液,对照组加入含1% BSADMEM无血清培养基,继续培养48 h。用PBS清洗细胞,经胰酶消化后离心,用1% BSA的DMEM无血清培养基进行重悬,制成单个细胞悬液,并将细胞悬液调整浓度为105个/mL。将transwell小室置于24孔板内,上室加入200 μL细胞悬液,下室加入500 μL含10% FBS的DMEM培养液。将有transwell小室的培养板放入培养箱中继续培养24 h后取出,医用棉签轻轻擦拭掉上室内未穿过膜的细胞,PBS清洗2~3次后,用甲醇固定约15 min后取出风干。将结晶紫配成0.1%的工作液,对小室进行染色约20 min,再用PBS清洗,直至PBS不再有颜色为止,待自然风干后即可将小室倒扣于正置显微镜下进行拍照,进行细胞计数。
1.3.8 Western Blotting检测Bax、Bcl-2、cleaved-caspase3、MMP9、VEGF蛋白的表达取对数生长期的HeLa 细胞、Siha细胞,以2×106/mL的密度接种于直径10 cm的培养皿中,待细胞贴壁后,对照组加入1% BSA-DMEM无血清培养基,实验组加入含不同浓度(IC25、IC50、IC75)的DHA溶液继续培养48 h后,收集各组细胞,用RIPA及PMSF裂解提取总蛋白,用BCA法测量蛋白浓度。用10%~12%SDS-PAGE凝胶电泳分离,将蛋白质转移至PVDF膜上,5%BSA封闭1h后,在摇床上孵育一抗,4 ℃过夜,TBST洗膜3~5次,加入二抗置于室温中孵育1 h,再予TBST 溶液洗脱3~5 次,显色发光。运用Image J图像分析软件测得条带灰度值后比较各组间的差异性。
1.3.8 统计学分析采用SPSS 20.0软件进行统计分析,所有数据均以均数±标准差表示,多组间采用OnewayANOVA进行统计,两两比较使用LSD 检验,P<0.05表示差异有统计学意义。
2 结果 2.1 MTT测定DHA对宫颈癌HeLa细胞、Siha细胞的抑制作用MTT结果显示,HeLa细胞、Siha 细胞随着培养液中DHA浓度的增加和刺激时间延长,抑制作用也逐渐增强,呈现时间与浓度依赖性,不同浓度下各时间点的细胞抑制率有统计学意义(P<0.05,图 1)。
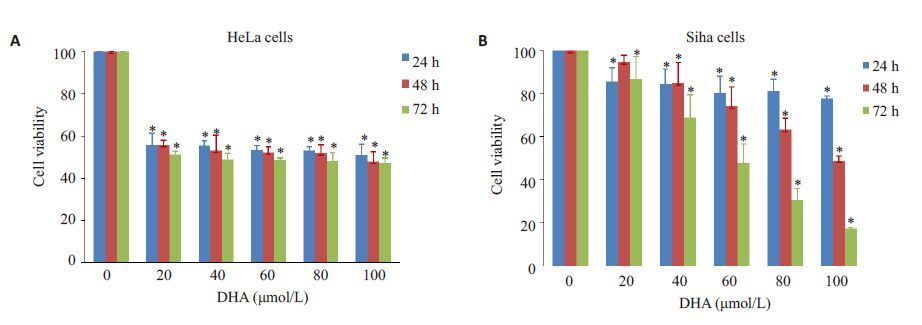
|
图1 不同浓度的DHA溶液对HeLa细胞及Siha细胞的抑制作用 Fig.1 Changes in the viability of HeL cells (A) and Siha cells (B) after DHA treatment with different protocols. *P < 0.05 vs control group. |
根据DHA药物浓度分为多个实验组,分别作用宫颈癌细胞48 h,在490 nm波长下测得A值,依据公式1(见1.3.2)计算得到不同药物浓度的抑制率(表 1)。
| 表1 不同浓度DHA刺激宫颈癌细胞48 h后不同抑制率的浓度 Tab. 1 Inhibition rate of cervical cells after treatment with different concentration of DHAfor 48 h (μmol/L) |
在倒置显微镜下,与空白对照组(0 μmol/L DHA)(图 2A、3A)相比,HeLa细胞、Siha细胞经过加入不同浓度DHA溶液刺激48 h 后,细胞形态发生明显的改变。正常组中,Siha 细胞呈长条梭形、单个细胞生长;而HeLa细胞则呈不规则梭形并呈癌巢状聚团生长。在IC25浓度组(图 2B、3B),细胞间连接较正常组疏松,细胞形态开始出现变化,细胞变圆,大部分细胞胞浆变得透亮,在培养孔内可见极少量细胞碎片。而在IC50浓度刺激下(图 2C、3C),培养基上清中可见漂浮着透亮的死细胞,细胞间隙进一步增宽,细胞皱缩,细胞浆内及细胞核周围出现较多的透亮的颗粒,部分细胞已成细胞碎片。IC75浓度时(图 2D、3D),细胞折光性进一步增强,细胞密度较前面实验组更稀疏,视野下较少见到正常细胞,多为细胞碎片或细胞浆内出现如脂质般的颗粒。
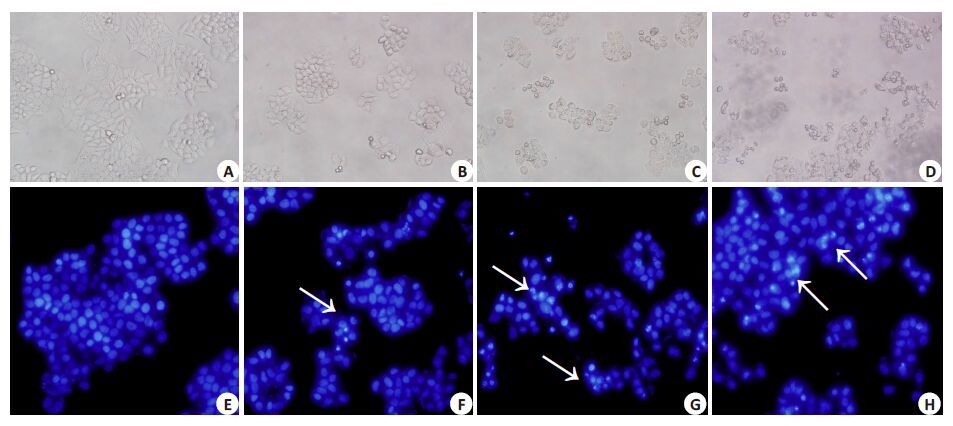
|
图2 光镜下和Hoechst33258染色观察不同浓度DHA作用48 h后对HeLa细胞形态的影响 Fig.2 Fluorescence microscopy of HeLa cells after exposure to different concentration of DHA (Original magnification: × 200). A, E: Control (0 μmol/L); B, F: IC25 (30 μmol/L); C, G: IC50 (60 μmol/L); D, H: IC75 (120 μmol/L). Arrows indicate apoptotic bodies. |
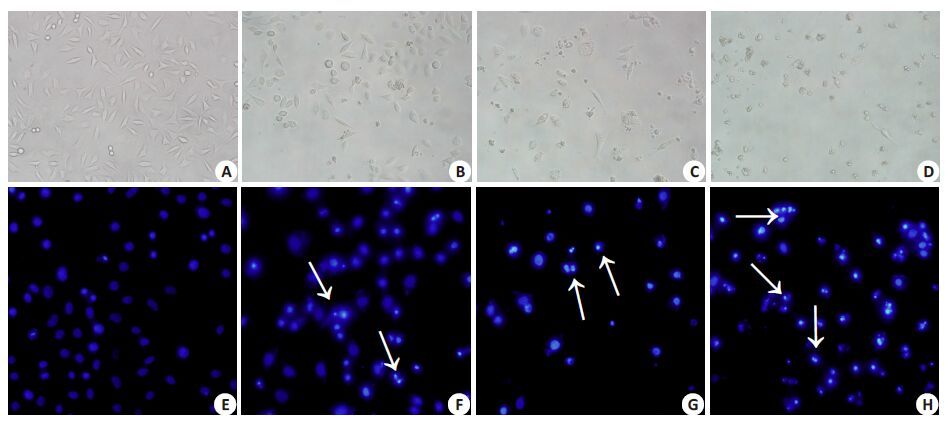
|
图3 光镜下和Hoechst33258染色观察不同浓度DHA作用48 h后对Siha细胞形态的影响 Fig.3 Fluorescence microscopy of Siha cells after exposure to different concentrations of DHA (Original magnification: × 200). A, E: Control (0 μmol/L); B, F: IC25 (43 μmol/L); C, G: IC50 (86 μmol/L); D, H: IC75 (130 μmol/L). Arrows indicate apoptotic bodies. |
Hoechst33258 染色后于荧光显微镜下观察可见,空白对照组(图 2E、3E)的细胞核形态呈圆形,染色均匀一致,边缘清晰,HeLa细胞呈聚团样生长,而Siha细胞则单个细胞生长。在IC25浓度组中(图 2F、3F),可见两细胞的细胞核均开始出现皱缩变小,有少量细胞核边界开始变得模糊,细胞核形态变得不规则;在IC50浓度刺激下(图 2G、3G),染色后细胞密度明显较少,较少见有正常细胞核,核或皱缩或变形,核染色质进一步聚集,出现断裂,为月牙状或明亮颗粒状蓝色荧光,可明显见到凋亡小体。而在IC75浓度刺激下(图 2H、3H),细胞密度进一步减少,视野内遍布明亮的蓝色荧光下的凋亡小体,可见较多细胞碎片,偶可见单个正常细胞核(图 2、3)。
2.3 流式细胞仪检测细胞凋亡率分别给予HeLa细胞、Siha细胞0 μmol/L、IC25、IC50、IC75浓度的DHA刺激48 h后收集细胞,Annexin V/PI双染流式细胞术检测DHA对细胞凋亡影响,结果显示DHA可诱导宫颈癌细胞凋亡,且在同一作用时间下,随着药物浓度的增加,细胞凋亡比例逐渐升高。(图 4A为HeLa细胞;图 4B为Siha细胞)。
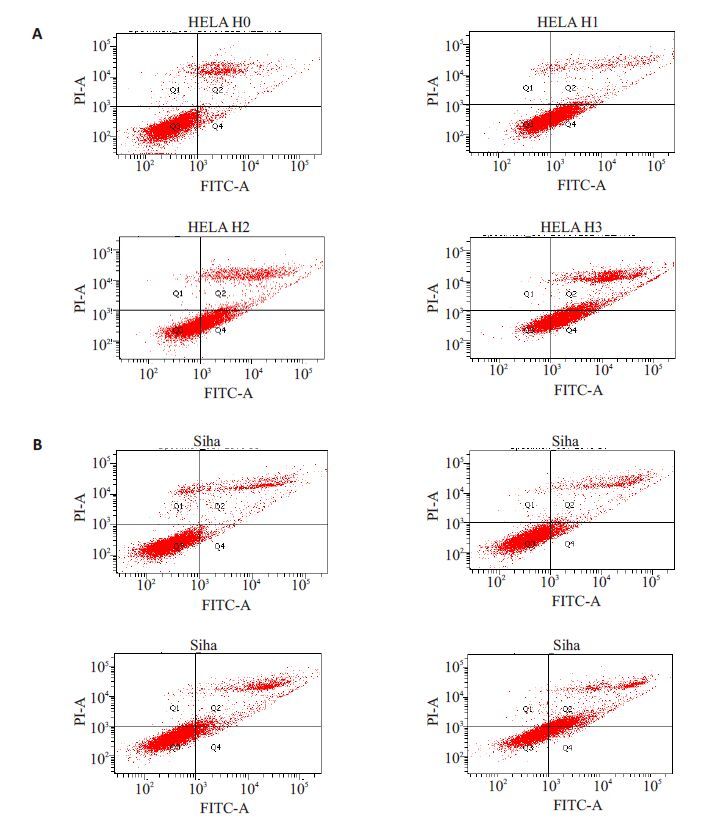
|
图4 HeLa细胞、Siha细胞分别予不同浓度DHA刺激48 h后的流式细胞学凋亡情况 Fig.4 Flow cytometry with Annexin V- FITC/PI staining for detecting apoptosis of cell lines treated with different concentrations of DHA for 48 h. A: HeLa cells; B: Siha cells. H0, H1, H2, H3: 0, 30, 60, 120 μmol/L,respectively. S0, S1, S2, S3: 0; 43; 86; 130 μmol/L, respectively. |
两细胞株均设立对照组(0 μmol/L)及DHA 的IC25、IC50组,在0、48 h时在光学显微镜下观察并拍照,用ImageJ软件分析两时间点下细胞的迁移面积。划痕实验结果显示:HeLa细胞对照组的划痕明显变窄,而Siha细胞对照组的划痕区域可见细胞融合生长。各组细胞的侧向迁移速度和面积与空白对照组相比均有显著性差异(P<0.05)(图 5A:HeLa 细胞;图 5B:Siha细胞)。

|
图5 不同浓度DHA对宫颈癌细胞侧向迁移能力的影响 Fig.5 Effect of different concentrations of DHA on cervical cell line migration evaluated by wound healing assay (Original magnification: ×200). A: HeLa cells; B: Siha cells. |
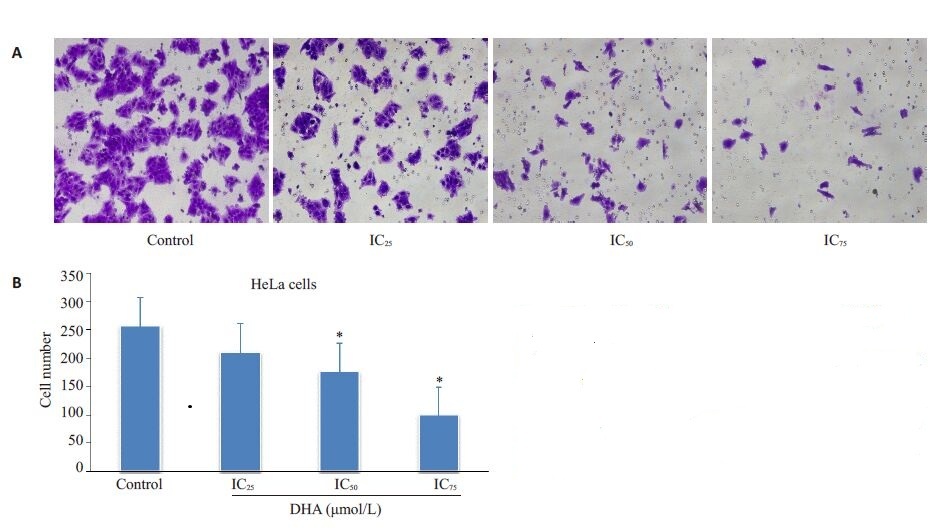
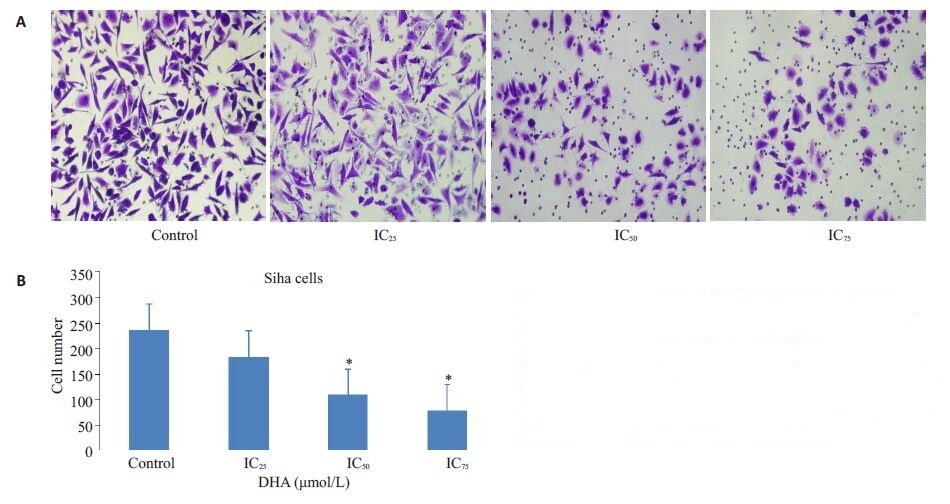
细胞加入transwell 小室后,小室的下室加入含10% FBS的培养基,由于营养物质的趋化作用,能够使细胞由上室往下室迁移。从结果可看出,经过不同浓度的DHA溶液刺激后,HeLa细胞和Siha细胞的体外迁移能力均发现改变。与对照组相比,随着DHA浓度的升高,HeLa细胞迁移至下室的细胞数逐渐减少,表明体外迁移的能力越弱(图 6)。同样的,在Siha细胞的研究中,亦体现出DHA对其体外迁移能力具有抑制作用(图 7)。Transwell小室检测宫颈癌细胞经过不同浓度DHA作用后迁移能力的改变与细胞划痕实验的结果是相一致的。
|
图6 不同浓度DHA对HeLa细胞纵向迁移能力的影响 Fig.6 Effect of different concentrations of DHA for 48 h on longitudinal migration of HeLa cells. A: HeLa cells that passed through the polycarbonate membrane were stained with crystal violet (inverted phase-contrast microscopy, × 200); B: Quantitative analysis of HeLa cells passing through Transwell migration chambers. *P<0.05 vs control group. |
|
图7 不同浓度DHA对Siha细胞纵向迁移能力的影响 Fig.7 Effect of different concentrations of DHA for 48 h on longitudinal migration of Siha cells. A: Siha cells that passed through the polycarbonate membrane were stained with crystal violet (inverted phase-contrast microscopy, × 200); B: Quantitative analysis of Siha cells passing through Transwell migration chambers. *P<0.05 vs control group. |
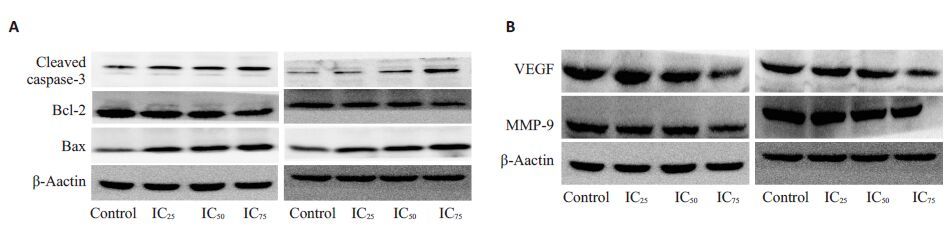
与对照组相比,两种细胞加入不同浓度DHA后,Bax、cleaved-caspase 3 表达升高(P<0.05),Bcl-2 蛋白表达较对照组明显降低,且Bcl-2/Bax比值较对照组明显降低(P<0.05);而实验组的VEGF、MMP9 表达均较对照组降低,差异有统计学意义(P<0.05,图 8)。
|
图8 不同浓度DHA作用于宫颈癌细胞48 h后Bax、Bcl-2、Cleaved-caspase3、MMP9及VEGF的表达 Fig.8 Expression of Bax, Bcl-2, cleaved caspase3 (A) and MMP9 and VEGF proteins (B) after in the two cancer cell lines treated with different concentrations of DHAfor 48 h. |
宫颈癌是最常见的妇科恶性肿瘤,发病率居女性恶性肿瘤第2 位。我国每年子宫颈癌新病例数为13.15万,约占全球总数的1/3,每年有2 万~3万妇女死于子宫颈癌[7]。为使肿瘤患者有较好的预后,降低复发率,减少放化疗的副反应,提高患者生活质量,人们不断更新宫颈癌的治疗模式,更加关注患者自身内环境的影响,为此逐渐提出肿瘤营养学治疗[8-9]。近期许多流行病学实验以及体内外实验研究显示膳食补充ω-3PUFA能够预防和改善多种炎症和肿瘤疾病[3]。
多不饱和脂肪酸(PUFAs)是一类含有两个或两个以上双键且碳原子数为16~22的直链脂肪酸,它们普遍存在于生物界中,是人体重要的营养物质[10]。PUFA是细胞膜的重要成分,对机体的激素代谢和许多酶的活性起调控作用[11-12]。PUFA主要由ω-3、ω-6、ω-9 这3 类脂肪酸所组成,但目前有重要生物学意义的以ω-3、ω-6PUFA为主。而近年来,ω-3PUFAs的抗肿瘤作用也逐渐被发现,其能抑制多种肿瘤的生长、侵袭及转移,能增强放化疗的治疗效果。DHA属于ω-3PUFAs,是人体的必需脂肪酸之一。Fasano等[13]研究发现DHA可以通过氧化应激ERK/GRP78 途径抑制多个结直肠癌细胞株的增殖,促进其凋亡。Song等[14]通过体内外研究得出DHA及EPA可以抑制胰腺癌细胞增殖,促进癌细胞凋亡,且证实DHA可以通过Wnt/β-catenin 途径对胰腺癌细胞的生物学行为进行干涉。而Abdi[15]研究团队在多发性骨髓瘤研究中发现ω-3PUFA可以促进骨髓瘤细胞的凋亡,却不影响外周血淋巴细胞的存活率。除从体外研究DHA的抗肿瘤作用外,国内外研究学者亦通过动物实验及临床实验体现DHA的各种有益的生物学功能。Parada团队[16]在使用亚硝酸胺进行大鼠膀胱癌造模时,得到结果是亚硝酸胺联合PUFA组的肿瘤组织形成与单纯亚硝酸胺组相比,联合组的肿瘤组织未见浸润且所形成的肿瘤体积较单纯亚硝酸胺组明显缩小,提出ω-3PUFA在大鼠膀胱癌模型中可能通过抗炎、抗氧化、抗血管形成等途径抑制癌前病变及恶性肿瘤的进展。Bougnoux等[17]还提出了饮食中加入ω-3PUFA干预后,可以明显延长乳腺癌转移患者的生存时间。
ω-3PUFA对于不同种类的恶性肿瘤细胞生物学的影响机制既有相同之处,亦有不同之处,总而言之,影响机制尚不明确[18]。本研究探讨了DHA对宫颈癌细胞凋亡的影响,通过给予细胞不同浓度的DHA刺激后,显微镜下可见细胞形态明显改变,且DHA浓度越高,细胞密度越低,可见癌细胞溶解成细胞碎片,而空白对照组细胞形态正常。Hoechst33258 染色后,能清楚看到随着DHA浓度的增加,细胞密度降低,细胞核浓缩越明显,细胞的凋亡小体也增加。MTT法检测细胞活性结果提示,随着DHA浓度的提高及时间的延长,宫颈癌细胞的凋亡增加,且Siha细胞则较HeLa细胞显示出更明显的浓度-时间依赖性。再进一步使用流式细胞学证实同一时间不同浓度DHA对宫颈癌细胞株的影响,结果同样显示DHA浓度越高,宫颈癌细胞的凋亡越明显。3种检测方法的实验结果是一致的。
经典的细胞凋亡途径主要包括3条:第1条为外在途径,由细胞表面的死亡受体如Fas和肿瘤坏死因子受体家族引发;第2条称内在途径或线粒体途径,由许多应激条件、化学治疗试剂和药物引起;而第3条途径则为由内质网氧化应激所导致的凋亡[19]。药物诱导的线粒体凋亡途径在各种凋亡过程中起着重要作用,此通路介导的凋亡过程主要表现为Bcl家族蛋白的变化、线粒体膜电位的改变及细胞色素C(cyt-c)的释放。Bcl-2家族在细胞凋亡中起最关键作用,此家族又分为Bcl-2和Bax两大亚族,而其抗凋亡蛋白以Bcl-2家族最为重要,主要在线粒体膜外起作用,而促凋亡蛋白则以Bax为主,主要在线粒体膜内起作用。Bcl-2和Bax蛋白的表达水平与凋亡直接相关[20]。定位于线粒体膜上的Bcl-2为公认的Bcl-2 家族蛋白成员中主要抗凋亡分子。Bcl-2通过干扰细胞色素C及钙离子的释放,降低核酸内切酶活性,导致细胞色素C无法达到激活下游胱冬肽酶的阈值,从而保护细胞器功能,抑制细胞凋亡。而Bax是促凋亡基因,Bax的N端暴露,引起细胞色素C和各种促凋亡因子的释放,最终导致细胞凋亡的比值决定了细胞是否凋亡[21-22]。Caspase家族是细胞凋亡过程中发挥关键作用的一组半胱氨酸蛋白酶,而其中的caspase-3在凋亡级联反应中是最为关键的凋亡蛋白酶,当受刺激后,caspase-3 会最终被活化剪切成cleavedcaspase3,细胞开启不可逆性的凋亡程序。Bcl-2、Bax联合cleaved-caspase 3可以直接体现出细胞接受相关刺激后出现的凋亡情况。本实验通过蛋白免疫印迹检测相关凋亡蛋白情况可见,同一作用时间下,随着DHA刺激浓度的增加,Bax及cleaved- caspase 3表达较正常组明显升高,而Bcl-2表达则逐渐下降,Bcl-2/Bax比值下降,提示不同浓度的DHA可以促进宫颈癌细胞的凋亡发生,且随着浓度升高,凋亡程度越明显。蛋白表达的测定结果与前文所提的MTT及流式细胞学结果是相一致的。上述结果提示我们DHA有可能是通过线粒体凋亡途径调节宫颈癌细胞的凋亡。
通过研究DHA对宫颈癌细胞侵袭、迁移的影响,本研究发现在同一作用时间下,不同浓度DHA溶液刺激宫颈癌HeLa细胞、Siha细胞后,MMP-9蛋白表达水平呈不同浓度下降,且随着浓度的升高,MMP-9蛋白的表达逐渐下降。基质金属蛋白酶(MMPs)家族是一类可分解细胞外基质成分的锌蛋白酶,在肿瘤的侵袭和转移过程中发挥着重要作用。MMP-9对肿瘤的侵袭与转移起着非常重要的作用,在肿瘤侵袭和转移中,其通过破坏局部组织结构、基底膜屏障、促进肿瘤新生血管形成,而促进肿瘤生长、侵袭和转移[23]。DHA 通过下调MMP-9蛋白的表达使得宫颈癌细胞溶解细胞外基质的能力下降,抑制其转移能力。
本研究还发现DHA刺激可导致血管内皮生长因子(VEGF)蛋白表达水平的降低,VEGF是特异性作用于血管内皮细胞的生长因子,对血管生长具有很强的诱导作用,参与诱导肿瘤血管生成。VEGF及其受体的过度表达与肿瘤生长、侵袭及转移关系密切[24]。VEGF的蛋白表达情况可以用于预测肿瘤细胞的转移、侵袭能力[25]。VEGF则可使得肿瘤细胞血管生成减少,减少肿瘤组织的营养物质的输送,而导致肿瘤细胞营养物质供应不足,减缓肿瘤细胞的增殖,协同MMP-9抑制细胞的转移和侵袭。在划痕实验和transwell 迁移实验中,给予DHA溶液刺激后,细胞迁移能力明显减慢,浓度越高,细胞体外迁移能力越弱,因此,DHA可能是通过下调MMP-9及VEGF的表达抑制细胞的转移和侵袭。富含多不饱和脂肪酸的鱼油脂肪乳剂作为特殊的免疫营养物质已经运用于临床,并且有研究显示其在激活白细胞、促进免疫相关细胞因子的释放、调节脂质合成等方面具有一定作用。近年来,越来越多的证据表明其可以抑制多种肿瘤细胞的增殖,但其药理作用复杂,抗肿瘤作用的机制尚不明确。
本研究发现DHA可通过调控cleaved- caspase3、Bax及Bcl-2表达,从而起到促进宫颈癌细胞株HeLa和Siha细胞凋亡作用,并能通过降低MMP-9、VEGF的表达抑制宫颈癌细胞的迁移和侵袭。DHA除了自身具有抗肿瘤作用外,国内外研究人员还发现DHA可以提高结直肠癌、多发性骨髓瘤等多种肿瘤细胞的放化疗敏感性[16, 27]。因此,DHA亦有可能是一种具有强大潜力的宫颈癌放化疗增敏剂。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-32.( 1) 1) |
| [2] | August DA, Huhmann MB, ASPEN. Aspen clinical guidelines: nutrition support therapy during adult anticancer treatment and in hematopoietic cell transplantation[J]. J Parenteral Enteral Nutr, 2009, 33(5): 472-500.( 1) 1) |
| [3] | Riediger ND, Othman RA, Suh M, et al. A systemic review of the roles of n-3 fatty acids in health and disease[J]. J Am Diet Assoc, 2009, 109(4): 668-79.( 2) 2) |
| [4] | 唐洪君. n-3多不饱和脂肪酸抑制子宫内膜癌及其分子机制研究[D]. 广州: 南方医科大学, 2013.( 1) 1) |
| [5] | 曾田. 多不饱和脂肪酸对恶性肿瘤作用机制的研究进展[J]. 医学综述, 2013, 19(18): 3318-20.( 1) 1) |
| [6] | Rakatzi I, Mueller H, Ritzeler O, et al. Adiponectin counteracts cytokine- and fatty acid-induced apoptosis in the pancreatic beta-cell line INS-1[J]. Diabetologia, 2004, 47(2): 249-58.( 1) 1) |
| [7] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.( 1) 1) |
| [8] | 黎介寿. 肿瘤营养学的兴起及临床应用[J]. 中国临床营养杂志, 2004, 12(4): 221-2.( 1) 1) |
| [9] | 刘玉迪, 崔久嵬. 肿瘤免疫营养治疗[J]. 肿瘤代谢与营养电子杂志, 2015, 2(4): 19-24.( 1) 1) |
| [10] | Baracos VE, Mazurak VC, Ma DW. n-3 polyunsaturated fatty acids throughout the cancer trajectory: influence on disease incidence, progression, response to therapy and cancer-associated cachexia[J]. Nutr Res Rev, 2004, 17(2): 177-92.( 1) 1) |
| [11] | Gogos CA, Ginopoulos P, Salsa B, et al. Dietary omega-3 polyunsaturated fatty acids plus vitamin E restore immunodeficiency and prolong survival for severely ill patients with generalized malignancy: a randomized control trial[J]. Cancer, 1998, 82(2): 395-402.( 1) 1) |
| [12] | Colomer R, Moreno-Nogueira JM, García-Luna PP, et al. N-3 fatty acids, cancer and cachexia: a systematic review of the literature[J]. Br J Nutr, 2007, 97(5): 823-31.( 1) 1) |
| [13] | Fasano E, Serini S, Piccioni E, et al. DHA induces apoptosis by altering the expression and cellular location of GRP78 in colon cancer cell lines[J]. Biochim Biophys Acta, 2012, 1822(11): 1762-72.( 1) 1) |
| [14] | Song KS, Jing K, Kim JS, et al. Omega-3-polyunsaturated fatty acids suppress pancreatic cancer cell growth in vitro and in vivo via downregulation of Wnt/Beta-catenin signaling[J]. Pancreatology, 2011, 11(6): 574-84.( 1) 1) |
| [15] | Abdi J, Garssen J, Faber J, et al. Omega-3 fatty acids, EPA and DHA induce apoptosis and enhance drug sensitivity in multiple myeloma cells but not in normal peripheral mononuclear cells[J]. J Nutr Biochem, 2014, 25(12): 1254-62.( 1) 1) |
| [16] | Parada B, Reis F, Cerejo R, et al. Omega-3 fatty acids inhibit tumor growth in a rat model of bladder cancer[J]. Biomed Res Int, 2013: 368178.( 2) 2) |
| [17] | Bougnoux P, Hajjaji N, Maheo K, et al. Fatty acids and breast cancer: sensitization to treatments and prevention of metastatic re-growth[J]. Prog Lipid Res, 2010, 49(1): 76-86.( 1) 1) |
| [18] | Berquin IM, Edwards IJ, Chen YQ. Multi-targeted therapy of cancer by omega-3 fatty acids[J]. Cancer Lett, 2008, 269(2): 363-77.( 1) 1) |
| [19] | Adams JM, Cory S. The Bcl-2 protein family: arbiters of cell survival [J]. Science, 1998, 281(5381): 1322-6.( 1) 1) |
| [20] | 庞若宇, 关美萍, 郑宗基, 等. 二甲双胍对糖基化终末产物诱导的成纤维细胞凋亡及相关蛋白caspase-3、Bax及Bcl-2表达的影响[J]. 南方医科大学学报, 2015, 35(6): 898-902.( 1) 1) |
| [21] | Susnow N, Zeng L, Margineantu D, et al. Bcl-2 family proteins as regulators of oxidative stress[J]. Semin Cancer Biol, 2009, 19(1): 42-9.( 1) 1) |
| [22] | Tischner D, Woess C, Ottina E, et al. Bcl-2-regulated cell death signalling in the prevention of autoimmunity[J]. Cell Death Dis, 2010, 1: e48.( 1) 1) |
| [23] | Singh D, Srivastava SK, Chaudhuri TK, et al. Multifaceted role of matrix metalloproteinases (MMPs)[J]. Front mol biosci, 2015, 2: 19.( 1) 1) |
| [24] | Costache MI, Ioana M, Iordache S, et al. VEGF expression in pancreatic cancer and other malignancies: a review of the literature [J]. Rom J Intern Med, 2015, 53(3): 199-208.( 1) 1) |
| [25] | 欧玉荣, 康敏, 周蕾, 等. 胃癌中幽门螺杆菌L 型感染与MIF、 MMP9、VEGF 表达的关系[J]. 南方医科大学学报, 2014, 34(2): 180-7.( 1) 1) |
| [26] | Fahrmann JF, Hardman WE. Omega 3 fatty acids increase the chemo-sensitivity of B-CLL-derived cell lines EHEB and MEC-2 and of B-PLL-derived cell line JVM-2 to anti-cancer drugs doxorubicin, vincristine and fludarabine[J]. Lipids Health Dis, 2013, 12(1): 1-13. |
 2016, Vol. 36
2016, Vol. 36
