类风湿关节炎(rheumatoid arthritis,RA)引起的炎性痛[1]是目前临床工作中最为常见的病理性疼痛之一,有病程长久、迁延反复和耗费巨大的特点。目前RA炎性痛治疗仍没有十分有效的方法,临床用药各有特点。他汀类药物可使多种蛋白难以进行异戊二烯化修饰,抑制炎症[2]。辣椒素受体(TRPV1)拮抗剂作为新型镇痛药正在被开发,但部分拮抗剂因体温过高的不良反应致研究中止[3]。有研究[4-6]提出可通过抑制络氨酸激酶A(TrkA)表达可减轻痛觉过敏,TrkA拮抗剂作为新型镇痛药正被广泛研究,有望用于临床。TrkA、TRPV1是炎性痛产生维持过程中的重要信号分子[4-9]。蜂毒干粉含蜂毒肽、蜂毒明肽等多种生物活性物质对治疗RA及炎性痛有效[10-12],但关于蜂毒对炎性痛TRPV1的调控作用机制的报道研究较少,目前还没有蜂毒消炎镇痛与TrkA、TRPV1关系的研究。本实验研究采用CIA大鼠造模,治疗采用蜂毒干预,观察双侧足跖厚度、肿胀关节评分和痛阈变化,初步验证蜂毒治疗RA炎性痛的有效性,探讨蜂毒对胶原诱导性关节炎(CIA)大鼠的治疗作用及其可能的作用机制,并采用免疫组化观察背根神经节TRPV1表达、western blotting检测TrkA含量,初步探讨TrkA、TRPV1与炎性痛的相关性。这不仅有利于蜂毒的规范使用,还为开发新作用靶点消炎镇痛药物提供新的思路。
1 材料和方法 1.1 实验动物成年雄性Wistar大鼠15只,体质量180~220 g,购于南方医科大学动物中心。
1.2 材料和仪器小牛Ⅱ 型胶原(chondrex公司),不完全弗氏佐剂(IFA)、蜂毒(BV)(Sigma-Aldrich公司)。TRPV1、TrkA试剂盒(abcam公司)。数显卡尺(Forgestar公司)。life science model 390 热痛测试仪(美国IITC公司)。其余材料由南方医科大学试剂中心提供。
1.3 方法 1.3.1 动物模型的建立和分组SPF级实验室自由饲养4 d。随机分为正常对照组、模型组、BV组,每组5只。实验前1 d(d0)将小牛Ⅱ 型胶原试剂(10 mg装)存于4 ℃ 过夜。实验第1天时于无菌条件下将其与IFA在等体积冰浴中混合充分乳化。检测时抽取一滴乳化剂滴入盛水烧杯中,均匀铺开为准。4 ℃ 冰箱保存备用。实验第1天(d1)时模型组和BV组大鼠于尾根部注射小牛Ⅱ 型胶原和IFA的乳化剂0.2 mL初次免疫,正常对照组于尾根部注射生理盐水0.2 mL。d8 时模型组和BV组再次注射乳化剂0.2 mL加强免疫,正常对照组再次注射生理盐水0.2 mL。从d10起每日造模大鼠足跖肿胀者逐渐增多,活动减少,行走拖步。14 d内造模大鼠均出现CIA体征,足跖厚度不同程度肿胀,且肿胀未见明显消退,均可进行下一步实验。
1.3.2 实验方法(1)足跖厚度:连续7 d采用数显卡尺,以大鼠足跖底正中面与足掌关节掌骨正中矢状面为轴,双下肢各测量3 次,求和取平均值;(2)肿胀关节评分(AI):连续7 d,按AI评分标准对大鼠四肢的各个关节的积分累计求和,即为每只鼠的AI。AI评分标准:0分,无红肿;1分,小趾关节轻度红肿;2分,小趾关节和足跖肿胀;3分,踝关节以下的足爪肿胀;4分,包括踝关节在内的全部足爪、关节肿胀;(3)痛阈:在最后1 d 进行测量。设RI=35,上限为20 s,将热痛测试仪热辐射光源焦点对准大鼠下肢足跖底正中皮肤,每只大鼠双下肢各测量2次,每次间隔10 min,求和取平均值。
1.3.3 治疗BV组治疗首先固定大鼠使其无法自由转动,用蒸馏水和蜂毒干粉配制3 mg/mL的蜂毒溶液,用1 mL注射器抽取,从d15起于大鼠单侧足三里穴注射0.1 mL。1次/d,连续治疗7 d。取穴参照《实验针灸学》定位法。模型组注射生理盐水,方法、穴位、剂量和疗程同BV组。正常对照组不干预。
1.3.4 免疫组化检测DRG内TRPV1含量变化干预结束后戊巴比妥钠腹腔麻醉,剪开膈肌、胸壁,暴露心脏;经左心室行主动脉插管,左手固定心脏,右手持针从心尖搏动处插入左心室、主动脉弓,先生理盐水快冲,右心耳泛白剪开右心耳,后用4%多聚甲醛灌注先快后慢固定。固定后取腰段脊柱,沿坐骨神经逆行追踪L4-6神经至椎间孔,轻用力将DRG从椎间孔取出。标本常规脱水,石蜡包埋,切片厚4 μm。常规脱蜡至水,室温孵育,PBS冲洗,热修复,封闭,滴加1∶100稀释TRPV1一抗(abcam),4 ℃ 过夜。冲洗,二抗标记,孵育,漂洗等,显色,冲洗,复染,脱水,封固,置目镜(×200)测微尺下观察阳性细胞计数。
1.3.5 Western blotting 检测DRG中TrkA 的含量改变标本DRG(L4-6)取材步骤同免疫组化。称质量后研碎,裂解,离心,取上清液,蛋白浓度测定等。清洗玻片,制胶,上样,电泳跑胶,转膜,封闭,按1∶5000稀释TrkA一抗(abcam)、二抗依次孵育过夜并洗3次,最后显色,曝光,扫描图片,用Quantity One 软件对Western blotting条带进行灰度分析,记录其灰度值。蛋白质的相对含量用目的蛋白与内参条带光密度的比值表示,按计量资料进行统计分析。
1.4 数据处理及统计方法采用t检验、ANOVA等进行比较,结果以均数±标准差形式表达,P<0.05 表示差异有统计学意义(SPSS17.0)。
2 结果 2.1 足跖厚度与正常对照组相比(表 1),CIA大鼠足跖厚度明显增加,模型组在NS注射7 d后足跖厚度变化不明显;BV组在给予BV治疗3 d内与模型组相比足跖厚度下降不明显,治疗4、5 d后下降明显(P<0.05),治疗6、7 d后厚度降至与正常对照组相似(P<0.05)。BV组差值与模型组、正常对照组有明显差异(P<0.05),模型组和正常对照组差值无明显差别(P>0.05)。
| 表1 各组大鼠双下肢足跖厚度的变化 Tab. 1 Changes of the rats' hind paw thickness(Mean±SD, mm) |
BV组给予BV治疗3 d后与模型组相比AI评分无明显差别(P>0.05);在治疗4~7 d间AI降低明显,与模型组有显著差异(P<0.05);正常对照组大鼠不造模未见肿胀,与CIA大鼠有明显差别(表 2)。
| 表2 各组大鼠四肢肿胀关节评分的变化 Tab. 2 Changes of the rats' AI(Mean±SD, score) |
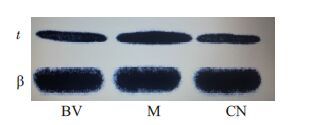
模型组和BV组痛阈明显低于正常对照组,BV组痛阈高于模型组(P<0.05);模型组、BV组TRPV1阳性细胞百分数、TrkA含量显著高于正常对照组(P<0.05),BV组TRPV1 阳性细胞数、TrkA 含量低于模型组(P<0.05,表 3、图 1)。
| 表3 各组大鼠DRG内TRPV1阳性细胞百分数和TrkA含量 Tab. 3 Pain thresholds and percent of TRPV1 positive cells and expression of TrkA (Mean±SD, n=5) |
|
图1 不同组大鼠背根神经节中TrkA、β-actin蛋白的表达 Fig.1 Expressions in TrkA and β-actin protein in the dorsal root ganglion of rats in different groups.t: TrkA; β: β-actin; CN: Control group; M: Model group; BV: Bee Venom group. |
类风湿关节炎引起的炎性痛[1]是严重影响人们生活工作的常见病理性疼痛。TRPV1 拮抗剂可治疗疼痛,TrkA也被用于新型镇痛药研究[13]。蜂毒能刺激垂体-肾上腺皮质,抑制炎症因子和前列腺素合成酶等的表达[10-12],蜂毒对治疗RA有效[10-15],但缺少蜂毒对炎性痛TRPV1 的调控作用机制的报道研究。背根神经节(DRG)是伤害性刺激的传入通道,包含多种疼痛相关的受体、离子通道以及信号转导分子。
辣椒素受体TRPV1[7-9, 16-18]属热敏性、伤害性阳离子通道,主要在DRG、节状神经节和脑三叉神经节等分布;在IL1-β、IL15、TNF-α等促炎作用下PI3K、PKC和CaMKⅡ等磷酸化TRPV1的部分位点而呈致敏状态。TRPV1基因敲除小鼠注入CFA、角叉胶或TNF-α等后不再痛敏[9, 19],证明TRPV1是炎性痛必不可少的疼痛刺激信号整合者。丝氨酸苏氨酸激酶[20]p38MAPK通过磷酸化和级联反应参与炎性痛,RA 炎性痛大鼠p38MAPK水平升高,其抑制剂SBZO358O则减轻疼痛,证明它也是炎性痛中的重要分子[7, 21-22]。
TrkA 是近年来消炎镇痛作用靶点研究的热门分子。它属于原癌基因酪氨酸蛋白激酶家族,是NGF的高亲和力受体[4, 23],NGF(TrkA)可通过两条途径[19]影响TRPV1:(1)创伤或炎症时配体NGF堆积,同时DRG表达受体TrkA,NGF与TrkA 高度结合,激活PLC、PI3K等,从而降低TRPV1开放阈值;(2)局部产生NGF并沿外周神经逆行至DRG与TrkA结合,激活P38MAPK的转录和翻译,上调DRG内TRPV1表达,TRPV1再被运输到伤害感受器末梢,引起阳离子(Ca2+为主)从胞外进入胞内,产生动作电位,通道开放,同时进一步释放更多的炎症因子NGF、5-HT、TNF-α、组胺等,降低痛阈,并投射到大脑皮层,产生疼痛。
本研究采用IHC-P观察DRG中TRPV1的阳性细胞百分数和western blotting检测TrkA含量。结果发现CIA炎性痛大鼠的足跖厚度和AI高于正常对照组、痛阈低于正常对照组;DRG中TRPV1阳性细胞百分数高于正常对照组,即炎性痛时DRG中TrkA、TRPV1的表达水平亦升高;提示TRPV1和TrkA共同参与了炎性痛的产生,两者存在正相关。因此,本研究认为炎性痛发生时TrkA、TRPV1 水平上升,痛阈下降,TrkA 与TRPV1是炎性痛产生时疼痛信号转导的重要分子。
结果还发现,CIA 炎性痛大鼠在BV治疗后(BV组)足跖厚度和AI较模型组低,痛阈较模型组高;DRG中TRPV1阳性细胞百分数、TrkA含量BV组低于模型组,即蜂毒治疗炎性痛大鼠其DRG中TRPV1、TrkA的表达水平下降;提示蜂毒抑制炎性痛大鼠DRG 中TrkA、TRPV1的表达水平。本研究初步认为蜂毒通过抑制炎性痛大鼠DRG中TrkA、TRPV1的表达水平,从而影响TRPV1 对疼痛的调控作用。TrkA 可能是TRPV1疼痛信号转导通路的重要分子。
本研究认为蜂毒能够抑制炎性痛大鼠DRG 中TrkA、TRPV1的表达水平,从而减轻炎性痛。TrkA与TRPV1是疼痛信号转导的重要分子,两者的相关性可能是消炎镇痛的途径之一。NGF(TrkA)/MAPK(p38MAPK)/TRPV1可能是炎性痛产生和维持过程中的重要信号通路[4-9, 21-23]。研究的不足之处是尚未采用排除性试验方法证实蜂毒能够通过抑制TrkA的表达水平达到抑制TRPV1在疼痛信号转导中的调控作用,应进一步研究其中一种分子拮抗剂使用后另一种分子表达的变化,从而更全面证实TrkA与TRPV1在疼痛信号转导通路中的相互关系。这有利于蜂毒临床运用的规范化,并为开发新作用靶点的消炎镇痛药提供新的理论依据。
| [1] | 王吉波, 吕振华. 类风湿关节炎[M]. 北京: 人民卫生出版社, 2008:13-27.( 2) 2) |
| [2] | 李永乐. 他汀类药物抗炎机制及其在神经病理性疼痛中的应用[J]. 医学研究生学报, 2013, 26(9): 1001-3.( 1) 1) |
| [3] | 戴冬艳, 张惠斌, 钱海, 等. 治疗疼痛新途径: 瞬时受体电位香草酸亚型1拮抗剂的研究进展[J]. 中国药科大学学报, 2010, 41(01): 11-9.( 1) 1) |
| [4] | 程鸣佳, 林一丹. 神经生长因子-TrkA信号通路在疼痛中的作用机制及TrkA抑制剂的研究进展[J]. 创伤外科杂志, 2014, 16(5): 468-71.( 4) 4) |
| [5] | 邓小华, 罗学港. 神经生长因子受体TrkA在中枢神经系统的表达、分布和作用[J]. 国外医学. 神经病学神经外科学分册, 2000, 27(1):52-5. |
| [6] | 梅旭晖, 纪倩, 吴剑聪, 等. 推拿对坐骨神经损伤大鼠神经生长因子及其受体TrkA的影响[J]. 北京中医药大学学报, 2013, 36(7): 497-500, 后插2.( 1) 1) |
| [7] | 衡立君, 高国栋, 陈军. 辣椒素受体VR1在局部炎症状态下的敏化机制[J]. 神经解剖学杂志, 2004, 20(3): 315-8.( 2) 2) |
| [8] | 陈敏, 张陆勇, 严明. 辣椒素受体研究进展[J]. 中国临床药理学与治疗学, 2006, 11(2): 126-30. |
| [9] | Palazzo E, Luongo L, De Novellis V, et al. Transient receptor potential vanilloid type 1 and pain development[J]. Curr Opin Pharmacol, 2012, 12(1): 9-17.( 4) 4) |
| [10] | 刘喜德, 张金禄, 郑汉光, 等. 蜂针疗法治疗类风湿关节炎的临床随机对照研究[J]. 针刺研究, 2008, 33(3): 197-200.( 2) 2) |
| [11] | 刘喜德, 张金禄, 郑汉光, 等. 蜂针疗法对类风湿关节炎患者外周血TNF-α IL-1β的影响[J]. 中华中医药学刊, 2008, 26(5): 996-7. |
| [12] | 周颖芳, 段颖华, 李万瑶. 蜂针对胶原诱导关节炎大鼠HPA轴的影响[J]. 辽宁中医药大学学报, 2012, 14(4): 233-5.( 2) 2) |
| [13] | 戴冬艳, 张惠斌, 钱海, 等. 治疗疼痛新途径: 瞬时受体电位香草酸亚型1拮抗剂的研究进展[J]. 中国药科大学学报, 2010, 41(1): 11-9.( 1) 1) |
| [14] | Lee JY, Kang SS, Kim JH, et al. Inhibitory effect of whole bee venom in adjuvant-induced arthritis[J]. In Vivo, 2005, 19(4): 801-5. |
| [15] | Li MM, Yu YQ, Fu H, et al. Extracellular signal-regulated kinases mediate melittin-induced hypersensitivity of spinal neurons to chemical and thermal but not mechanical stimuli[J]. Brain Res Bull, 2008, 77(5): 227-32.( 1) 1) |
| [16] | 贾岳, 洪炎国. 瞬时受体电位香草酸亚型1(TRPV1)与炎性痛[J]. 生命科学, 2010, 22(12): 1259-63.( 1) 1) |
| [17] | 鹿晓文, 寇亮, 杜莉. 瞬时受体电位香草酸亚型1介导疼痛及其调节机制[J]. 国际口腔医学杂志, 2014, 41(1): 82-7. |
| [18] | 赵齐飞, 李彬. 瞬时受体电位香草酸亚型1在炎症中的作用[J]. 中国当代医药, 2013, 20(33): 20-1.( 1) 1) |
| [19] | Khan AA, Diogenes A, Jeske NA, et al. Tumor necrosis factor alpha enhances the sensitivity of rat trigeminal neurons to capsaicin[J]. Neuroscience, 2008, 155(2): 503-9.( 2) 2) |
| [20] | 黄美娜. 电针对慢性吗啡耐受大鼠辣椒素受体磷酸化改变的影响及机制研究[D]. 天津: 天津医科大学, 2011.( 1) 1) |
| [21] | Ji RR, Samad TA, Jin SX, et al. p38 MAPK activation by NGF in primary sensory neurons after inflammation increases TRPV1 levels and maintains heat hyperalgesia[J]. Neuron, 2002, 36(1):57-68.( 2) 2) |
| [22] | 龚伟, 王升旭. 电针夹脊穴在佐剂性关节炎大鼠镇痛过程中磷酸化p38丝裂原活化蛋白激酶的变化及作用[J]. 中国临床康复, 2004, 8(8): 1514-5.( 1) 1) |
| [23] | 尹方明. P75和TrKA: 两种NGF受体系[J]. 国外医学: 神经病学神经外科学分册, 1997, 24(4): 205-8.( 2) 2) |
 2016, Vol. 36
2016, Vol. 36
