2南方医科大学P3 实验室
3南方医科大学第一临床医学院,广东广州510515
2 Guangdong Provincial Key Laboratory of Tropical Disease Research, School of Public Health and Tropical Medicine, P3 Laboratory, Southern Medical University, Guangzhou 510515, China
3 First School of Clinical Medicine, Southern Medical University, Guangzhou 510515, China
Muc2 基因是美国学者Gum等[1] 于1989 年自人小肠黏膜的cDNA表达文库中克隆得到的一种粘蛋白核心肽基因,定位在染色体11p15.3~15.5上,是编译分泌型粘蛋白Mucin2(Muc2)的主要基因。粘蛋白Muc2是构成肠道粘液层的主要成分,正常时仅在小肠和空肠的杯状细胞中有表达且表达量较低,可在肠腔的上皮表面形成一层粘液层发挥润滑和拮抗致病菌的黏附和侵袭的作用[2-3] 。我们在前期研究中发现,该粘蛋白不仅在多种上皮来源的肠道疾病和肿瘤中出现结构和功能质或量的改变[4-9] ,它的表达更与益生菌诱导粘蛋白分泌,上调基因表达和抑制致病菌黏附侵袭的生物学行为密切相关[10-11] 。为进一步探讨益生菌加强肠屏障功能的机制,分析比较益生菌单独防治和调节粘蛋白Muc2辅助治疗肠道细菌性感染的异同,本研究利用CRISPRCas9技术构建Muc2基因表达下调的人结肠癌Ht29细胞模型,分析粘蛋白Muc2在鼠李糖乳杆菌GG(LGG)株抑制大肠杆菌(Escherichia coli,E.coli)K1株E44黏附和侵袭肠上皮中的作用。
1 材料和方法 1.1 细胞系、菌株及质粒
E.coli K1 株E44、益生菌LGG、HEK293T 和Ht29细胞由美国南加州大学洛杉矶儿童医院黄胜和教授提供并保存于本实验室。DH5-α感受态细胞购自北京鼎国昌盛生物技术有限责任公司。pCMV-dR8.2 dvpr、pCMV-VSV-G和plentiCRISPRv2由本室保存。
1.2 主要试剂RPMI 1640 培养基、DMEM高糖培养基、BCA蛋白定量试剂盒、30%丙烯酰胺溶液和5XSDS蛋白电泳上样缓冲液均购自北京鼎国昌盛生物技术有限责任公司;限制性内切酶BasBI和T4连接酶购自TAKARA公司;质粒小提试剂盒购自TIANGEN 公司;E.Z.N.A.TMEndo-Free Plasmid Mini Kit Ι无内毒素质提试剂盒购自OMEGA公司;氯仿、异丙醇其余试剂为国产分析纯;DNA测序由生工生物工程(上海)股份有限公司完成。
1.3 构建ΔMuc2细胞模型查询NCBI 基因库中人Muc2 基因序列,并根据CRISPR/Cas9 系统中sgRNA对20个碱基靶序列DNA识别要求靶序列后紧跟一个-NGG(N代表ATGC中任意一个碱基)的PAM序列等设计原则,筛选特异性序列为变异抑制靶点,利用sgRNA 设计网站(http://www.e-crisp.org/E-CRISP/designcrispr.html)设计合成4 条Muc2 Oligo单链,如下:
MCU21 F 5'-CACCGGCCGGGGAGGCTTCCTGGTG-3'
MCU21 R 5'-AAACCACCAGGAAGCCTCCCCGGCC-3'
MCU22 F5'-CACCGCTGGGCATCTGGGCTGGAGA-3'
MCU22 R5'-AAACTCTCCAGCCCAGATGCCCAGC-3'
斜体处为BsmB I酶切位
将sgRNA 寡核苷酸单链退火形成双链DNA;用BsmBI限制性内切酶酶切lenticrisprv2质粒,使慢病毒CRISPR 质粒消化和脱去磷酸;连接酶切后的lenticrisprv2 质粒和线性化sgRNA,连接体系:2 μL BasBI digested plasmid;6 μL vector;1 μL T4 DNA连接酶;1 μL Ligase;10 μL total,16° 连接12 h 构建lenticrisprv2-sgRNA,连接产物转化大肠杆菌DH5-α感受态细胞,阳性重组体鉴定后小提质粒并测序验证。相应包装质粒pCMV-dR8.2 dvpr 和pCMV-VSV-G 的质粒也一并提取、低温浓缩和切胶回收。
筛选Puromycin工作浓度后,采用磷酸钙转染法,按一定比例混合plenticrisprv2-sgRNA、pCMV-dR8.2 dvpr 和pCMV-VSV-G,转染HEK293T 细胞。使用PEG8000收集纯化慢病毒,0.45 μm滤膜过滤,24孔板转染人结肠癌细胞Ht29及筛选稳定株,蛋白免疫印迹法和MTT法评估基因表达下调模型构建效果。
1.4 黏附实验和侵袭实验黏附实验:E44+LGG 处理组按(107CFU LGG+106CFU E44)/孔加入培养有Ht29细胞的24孔细胞培养板中,孵育3 h,E44处理组用等体积新鲜完全培养液代替LGG。0.5% Tri ton X-100 200 μL/孔孵育10 min,倍比稀释后涂布含利福平的LB琼脂平板,24 h后计数菌落数。
侵袭实验:E44+LGG 处理组按(107CFU LGG+106CFU E44)/孔加入培养有Ht29细胞的24孔细胞培养板中,孵育3 h,E44处理组用等体积新鲜完全培养液代替LGG。换入新鲜完全培养液(含100 μg/mL庆大霉素)孵育1 h。0.5% TritonX-100 200 μL/孔孵育10 min,倍比稀释后涂布含利福平琼脂平板,24 h后计数菌落数。
1.5 统计学处理结果用均数±标准差表示,统计方法采用SPSS13.0统计软件中的单因素方差分析。P <0.01认为差异有统计学意义。
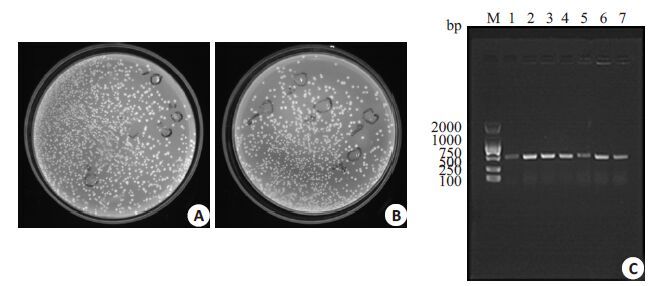
2 结果 2.1 ΔMuc2细胞模型构建泳道1-3 为sgRNA(Muc2 1)所属鉴定结果,泳道4-7为sgRNA(Muc2 2)所属鉴定结果。目标条带最亮,其他条带较淡,提示最后的PCR产物质量较好,无明显降解,且大小皆为所设计的插入片段大小。插入序列及其位置、方向与预期相符,lenticrisprv2-sgRNA质粒构建正确(图 1)。
|
图1 Lenticrisprv2-sgRNA质粒的构建和鉴定 Fig.1 Construction and identification of lenticrisprv2-sgRNA plasmid. A, B: Transformation of competent cells of E. coli DH5-α; C: Identification of the target DNA recombinated with colony PCR and sequencing, which demonstrated correct insertion position and direction of the sequences. |
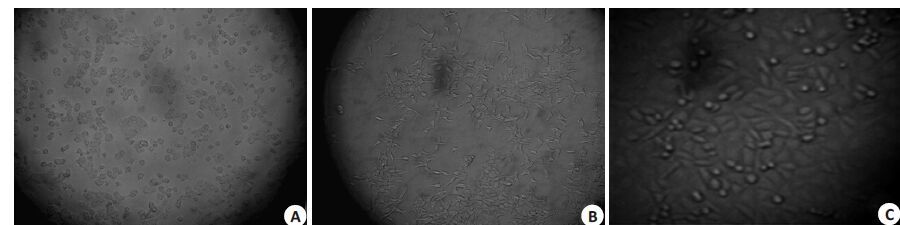
转染前按浓度梯度0、1、2、3、4、5、6、7 μg/mL选取Puromycin工作浓度,根据其结果,选择5 μg/mL为野生型Ht29 细胞4 d 内全部致死的Puromycin 最低浓度。慢病毒包装、纯化、浓缩、转染后,筛选KD-Muc2-Ht29稳定转染细胞株(图 2)。
|
图2 研究中各细胞的形态观察 Fig.2 Morphological observation of wild-type Ht29 cells (A), HEK293T cells (B), and the stably transfected cell line KD-Muc2-Ht29 (C) (Original magnification: ×100). Ht29 cells were maintained in RPMI 1640 (supplemented with 10% FBS and 0.1% SM and PG) in 5% CO2 at 37 ℃. HEK293T cells were cultured in high-glucose DMEM (10% FBS) in 5% CO2 at 37 ℃. KD-Muc2-Ht29 cells were maintained in RPMI 1640 (10% FBS) in 5% CO2 at 37 ℃. |
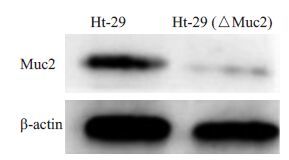
经细胞总蛋白提取和蛋白定量后,蛋白免疫印迹法检测沉默后Muc2蛋白的表达,取得SDS-PAGE结果并进行目的基因与内参照条带光密度分析。结果表明抑制率可达81%(P <0.01,图 3)。
|
图3 慢病毒转染前后粘蛋白Muc2相关蛋白表达含量对比 Fig.3 Comparison of expression of Muc2 protein in cells with gene silencing. *P <0.01 vs Ht29 group. |
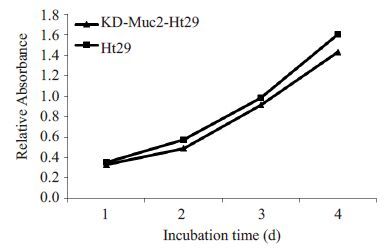
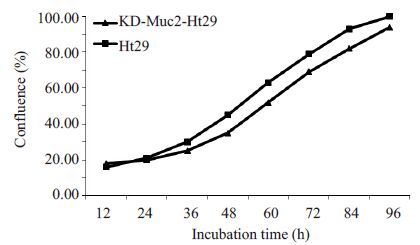
MTT法测定Muc2 表达下调的Ht29 细胞与正常HT29 细胞的生长曲线和汇合率曲线,结果显示Muc2缺失前后两种细胞的活性和生长情况良好,生长曲线(图 4)和汇合率曲线(图 5)没有明显差异。估算正常Ht29细胞群体的倍增时间约为26 h,KD-Muc2-Ht29细胞的倍增时间约为24 h。[Td=Δt Lg2/(LgNt-LgN0)] 。
|
图4 4 d 内MTT法测得正常Ht29 细胞与KD-Muc2-Ht29细胞的生长曲线 Fig.4 Growth curve of Ht29 cells and KD-Muc2-Ht29 cells measured with MTT assay in 4 days. |
|
图5 4 d内正常Ht29细胞与KD-Muc2-Ht29细胞的汇合率曲线 Fig.5 Convergence rate of Ht29 cells and KD-Muc2-Ht29 cells in 4 days. |
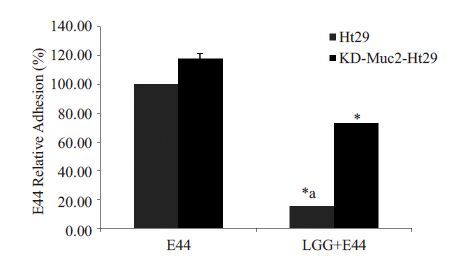
竞争性排斥分析Muc2 沉默在益生菌拮抗E44 黏附野生型Ht29细胞中的调节作用。将E44处理组黏附率假定为100%标化LGG与E44 共孵育时E44 的相对黏附率(相对黏附率%=(LGG+E44 处理组的菌落数/ E44处理组的菌落数)×100%)。Muc2基因表达下调前,E44相对黏附率为15.38%,益生菌LGG显著抑制致病菌E44黏附侵袭Ht29细胞(P <0.01);Muc2基因沉默后,E44相对黏附率为72.23%,益生菌LGG的干扰作用明显降低(P <0.01,图 6)。
|
图6 Muc2在益生菌拮抗E44黏附Ht29细胞中的调节作用 Fig.6 Antagonistic effect of Muc2 gene against E44 adhesion to Ht29 cells before and after transfection. After three generations of culture (12 h), the probiotics reached the count of 107 cells/mL and E. coli K1(E44) reached 108 cells/mL. *P<0.01 vs LGG+E44 before Muc2 knockdown; aP< 0.01 vs control E44. |
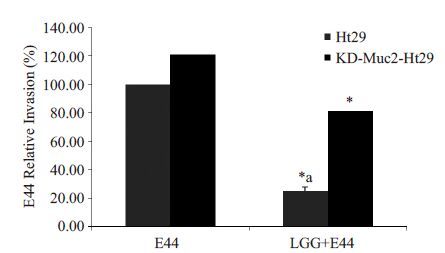
以E44 处理组侵袭率假定为100%标化LGG 与E44 共孵育时E44 的相对侵袭率(相对侵袭率%= (LGG+E44 处理组的菌落数/E44 处理组的菌落数)× 100%)。Muc2基因沉默前,E44相对侵袭率为25.13%,益生菌LGG显著抑制致病菌E44 黏附侵袭Ht29 细胞(P <0.01);Muc2基因沉默后,E44相对侵袭率为81.49%,益生菌LGG的干扰作用明显下调(P <0.01,图 7)。
|
图7 Muc2在益生菌拮抗E44侵袭Ht29细胞中的调节作用 Fig.7 Antagonistic effect of Muc2 gene on E44 invasion of Ht29 cells before and after transfection. After three generations of culture, the probiotics reached the count of107 cells/mL and E.coli E44 reached 108 cells/mL (12 h later). *P<0.01 vs LGG+E44 before Muc2 knockdown; aP< 0.01 vs control E44. |
大肠杆菌E.coli K1株E44是引起新生儿脑膜炎和菌血症极为常见的革兰氏阴性菌,黏附和侵袭是E.coli K1株与宿主细胞Ht29发挥作用的关键,致病菌只有穿透肠屏障才能引起血源性感染[12-14] 。因此,要阻断细菌穿透肠屏障引起细菌性感染,有必要研究Muc2基因在益生菌调节大肠杆菌黏附和侵袭肠屏障中的作用机理,对理解益生菌保护肠屏障作用的分子机制或寻找潜在的益生菌辅助治疗方案都具有重要价值。
CRISPR/Cas9系统是一类广泛存在于细菌和古细菌体内的高度保守获得性免疫机制,其识别靶点依靠PAM区和靠近PAM区的11 bp 种子序列。sgRNA和Cas蛋白是CRISPR/Cas9系统发挥活性的核心[15-17] ,可对外来入侵的噬菌体或是遗传物质进行有效干扰,在细菌、真核生物[18] ,高等哺乳动物等都表现出较高的基因组编辑活性。本研究实现对益生菌保护肠黏膜屏障的关键基因Muc2的定点抑制,在野生型人结肠癌细胞株Ht29中建立完整的ΔMuc2细胞模型;通过蛋白免疫印迹法和MTT法检测,在Muc2基因目的位点的抑制率可达80%以上,且基因沉默后的细胞生长曲线无明显变化证明该细胞模型是有效的。为进一步验证Muc2基因沉默对益生菌抑制大肠杆菌黏附和侵袭的影响,我们对其进行竞争性排斥分析。结果显示Muc2基因沉默前,E44相对黏附率为15.38%,相对侵袭率为25.13%,益生菌LGG显著抑制致病菌E44黏附侵袭Ht29细胞;Muc2基因沉默后,E44 相对黏附率为72.23%,相对侵袭率为81.49%,益生菌LGG的干扰作用明显下调,说明Muc2基因沉默使益生菌对大肠杆菌黏附和侵袭的干扰作用大幅度下调,益生菌对致病菌黏附和侵袭肠屏障的拮抗作用无法脱离Muc2基因单独起作用,且Muc2的高表达有助于益生菌发挥抑制作用;同时研究发现Muc2基因沉默后,E44 相对黏附率为72.23%,相对侵袭率为81.49%,益生菌对致病菌黏附和侵袭的拮抗作用并未完全消失,提示在益生菌的拮抗作用中除了Muc2基因的表达以外,还有其他影响机制存在。
综上,本研究以粘蛋白Muc2基因作为研究起点,沉默Muc2 基因表达,探究Muc2 基因、鼠李糖乳杆菌GG 株和大肠杆菌E.coli K1株E44之间的关系,检测Muc2 基因在益生菌对大肠杆菌黏附和侵袭肠上皮细胞的拮抗作用中的生物学功能。研究结果亦提示益生菌刺激粘蛋白Muc2表达上调是其强化加固肠粘膜屏障和拮抗致病菌功能的关键性机制之一,调节粘蛋白Muc2辅助治疗肠道细菌性感染可比益生菌单独防治更大程度地发挥生物学效应,具体机制有待进一步探讨。通过CRISPR/Cas9修饰益生菌抑制致病菌进程中的关键基因,调节粘蛋白Muc2辅助益生菌制剂治疗有望成为防治肠道感染性疾病新的突破口。
| [1] | Gum JR, Byrd JR, Hicks JW, et al. Molecular cloning of human intestinal mucins cDNAs[J] . J Biol Chem, 1989, 26(1/1): 6480. ( 1) 1) |
| [2] | Itoh Y, Kamata-Sakurai M, Denda-Nagai K, et al. Identification and expression of human epiglycanin/MUC21: a novel transmembrane mucin[J] . Glycobiology, 2008, 18(1): 74-83. ( 1) 1) |
| [3] | Shet T, Valsangar S, Dhende S. Secretory carcinoma of breast: pattern of MUC 2/MUC 4/MUC 6 expression[J] . Breast J, 2013, 19 (2): 222-4. ( 1) 1) |
| [4] | Yu JY, He XL, Puthiyakunnon S, et al. Mucin2 is required for probiotic agents-mediated blocking effects on meningitic E. coli-induced pathogenicities[J] . J Microbiol Biotechnol, 2015, 25 (10): 1751-60. ( 1) 1) |
| [5] | Moniaux N, Escande F, Porchet N, et al. Structural organization and classification of the human mucin genes[J] . Front Biosci, 2001, 6: D1192-206. |
| [6] | Williams SJ, Wreschner DH, Tran M, et al. Muc13, a novel human cell surface mucin expressed by epithelial and hemopoietic cells[J] . J Biol Chem, 2001, 276(21): 18327-36. |
| [7] | Bresalier RS, Ho SB, Schoeppner HL, et al. Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis[J] . Gastroenterology, 1996, 110(5): 1354-67. |
| [8] | Chang CY, Chen Y, Lin WC, et al. MUC2 polymorphisms are associated with endometriosis development and infertility: a case-control study[J] . BMC Med Genet, 2012, 13(15): 15. |
| [9] | Park JS, Yeom JS, Seo JH, et al. Immunohistochemical expressions of MUC2, MUC5AC, and MUC6 in normal, helicobacter pylori infected and metaplastic gastric mucosa of children and adolescents [J] . Helicobacter, 2015, 20(4): 260-8. ( 1) 1) |
| [10] | Huang SH, He L, Zhou Y, et al. Lactobacillus rhamnosus GG suppresses meningitic E. coli K1 penetration across human intestinal epithelial cells in vitro and protects neonatal rats against experimental Hematogenous Meningitis[J] . Int J Microbiol, 2009: 647862. ( 1) 1) |
| [11] | Yu JY, He XL, Santhosh P, et al. Mucin2 is required for probiotic agents-mediated blocking effects on meningitic E. coli-induced pathogenicities[J] . J Microbiol Biotechnol, 2015, 25(10): 1751-60. ( 1) 1) |
| [12] | Ho SB, Shekels LL, Toribara NW, et al. Mucin gene expression in normal, preneoplastic, and neoplastic human gastric epithelium[J] . Cancer Res, 1995, 55(12): 2681-90. ( 1) 1) |
| [13] | Huang SH, Stins MF, Kim KS. Bacterial penetration across the blood-brain barrier during the development of neonatal meningitis [J] . Microbes Infect, 2000, 2(10): 1237-44. |
| [14] | Huang SH, Chen YH, Zhang S. E. coli invasion of the blood-brain barrier[J] . Med Mol Biol, 1999, 2: 114-36.( 1) 1) |
| [15] | 卢利莎, 白杨, 刘鑫, 等. 利用CRISPR/Cas9技术构建敲除MEIS2 基因的HEK293T人胚肾细胞系[J] . 中国细胞生物学学报, 2015(4): 535-41. ( 1) 1) |
| [16] | 苏甲林, 阙彪, 张继勤, 等. 建立CRISPR/Cas9慢病毒系统高效敲除 人源AIP1基因[J] . 生物技术通报, 2015(8): 219-24. |
| [17] | 马元武, 马婧, 路迎冬, 等. 利用CRISPR/Cas9抑制大鼠胰岛素受体 底物1(Ir s1)基因[J] . 中国比较医学杂志, 2014(3): 55-60. ( 1) 1) |
| [18] | 颜雯, 李海涛, 向华, 等. CRISPR-Cas基因组改造技术研究进展[J] . 广东农业科学, 2014, 41(2): 149-52.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
