2南方医科大学第五附属医院神经外科,广东 广州
2Department of Neurosurgery, Fifth Affiliated Hospital of Southern Medical University, Guangzhou 510900, China
PC4 和SFRS1 相互作用蛋白1(PSIP1),也被称为晶状体上皮源性生长因子(LEDGF)是肝癌衍生生长因子家族成员之一[1],主要在脑、心脏和睾丸等人体组织内表达,还可参与肿瘤细胞的生长、增殖、分化及血管生成等诸多肿瘤病理生理过程[2-3]。在胶质瘤中,其对肿瘤的侵袭、迁移作用尚未见报道。因此,本研究用siRNA干扰技术使PSIP1蛋白表达降低,通过体外侵袭、迁移实验检测U87细胞侵袭迁移能力,探讨PSIP1在胶质瘤发生侵袭转移中的作用,为胶质瘤的靶向治疗提供新的理论依据。
1 材料和方法 1.1 材料人脑胶质瘤U87 细胞购置中国科学院上海细胞库;siRNA由上海吉玛制药技术有限公司设计和合成。Lipofectamine2000 Reagent 购自Invitrogen;Transwell小室为Corning产品;PSIP1(1∶500)、Slug、N-cadherin、β-catenin及β-Actin(1∶1000)兔单抗和羊抗兔二抗均购自Sigma。
1.2 方法 1.2.1 siRNA设计合成靶向PSIP1 基因的特异性 siRNA 序列为:正义链5'-AGACAGCAUGAGGAAGCGdTdT-3',反义链3'-dTdTUCUGUCGUACUCCUUCGC-5'。合成的siRNA粉末溶解在RNase Free dH2O中,配制成20 mmol/L储存液分装保存,按照转染试剂说明书进行转染)。
1.2.2 细胞培养及转染U87细胞使用含10%胎牛血清及1%青霉素和链霉素的DMEM 置于37 ℃,5% CO2,湿度充分的恒温培养箱中培养。转染前1 d,将U87细胞传代于6孔板中培养,细胞密度应能在24 h内使细胞汇合达到70%~90%。按Lipofectamine2000 Reagent说明书进行转染。转染后6~8 h更换含血清的完全培养液培养。
1.2.3 Real-timePCR 检测将实验分为3 组,PSIP1-siRNA 转染组、Negtive control-siRNA(NC-siRNA)转染组及未转染组。每组至少3个重复。各组同时检测目标基因和管家基因(GAPDH)的Ct值。分别提取各组转染后24 h 细胞总RNA,总RNA 进行反转录成cDNA,通过实时定量PCR扩增目的基因。反应体系为20mL,其中SYBR Ex Taq 10mL,上、下游引物各0.4 mL,cDNA 2 mL,ddH2O7,2 mL。反应条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火、延伸20 s,反应40 个循环。采用2-△△Ct法分析目的基因mRNA的相对表达水平。扩增基因的特异性引物序列为:GAPDH:5'-ATCATCAGCAATGCCTCCTG-3'(forward),5'-ATGGACTGTGGTCATGAGTC-3'(reverse);PSIP1:5'-TGTAAAGCCACCCACAAACA-3(forward),5'-GTTGCTGCCTGTTGACTTGA-3(' reverse)。
1.2.4 Westernblotting检测实验分组同1.2.3,转染24 h后,提取各组蛋白,测定蛋白浓度。取各组等量的总蛋白进行SDS-PAGE电泳,转膜,封闭,一抗、二抗孵育后显影。所加一抗分别为:PSIP1(1∶500)、Slug、N-cadherin、b-Catenin 及b-Actin(1∶1000)。将所得结果分别进行分析。
1.2.5 细胞侵袭实验实验分组同1.2.3。应用8mm滤膜Transwell 小室,分别收取各组转染24 h后PSIP1 表达下降的胶质瘤U87 细胞和对照细胞采用DMEM重悬,取200 mL细胞悬液(8×104/mL)加入上室,下室加入500 mL含10%胎牛血清的DMEM 置于37 ℃,5% CO2孵箱培养8 h后取出。甲醇固定后DAPI染色,置200倍倒置显微镜下观察,随机取10个视野,计数小室下面的细胞数。实验重复3次。
1.2.6 细胞迁移实验实验分组同1.2.3,转染24 h后,收取各组细胞,采用无血清培养基传代于新的6孔板中培养,细胞密度以贴壁后细胞汇合达90%以上为宜,培养过夜,200 mL枪头用于划痕,分别于0、24、48 h观察细胞并拍照。计算不同时间段细胞迁移面积。实验重复3次。
1.3 统计学方法各组实验数据以均数±标准差表示,统计处理采用SPSS 20.0和Graph pad 6.0软件进行单因素方差分析,P<0.05为差异有统计学意义。
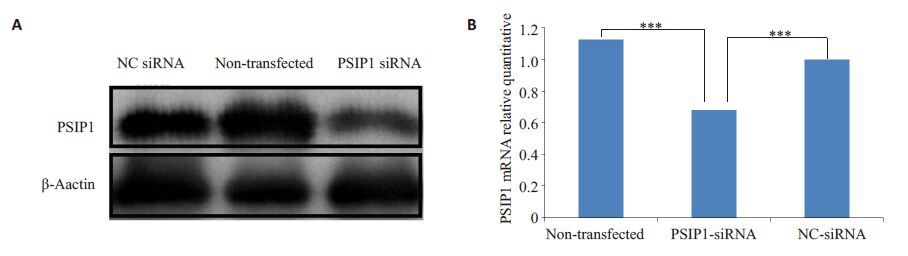
2 结果 2.1 转染siRNA后U87细胞中PSIP1 mRNA水平和蛋白水平的变化转染24 h后,分别提取各组U87细胞的RNA进行检测,验证其干扰效果,PSIP1-siRNA转染组0.68±0.01较NC-siRNA组0.99±0.02 及未转染组1.13±0.01 U87细胞中PSIP1在mRNA水平明显下降,差异具有统计学意义(P<0.001)。转染24 h后,提取各组细胞的蛋白进行Western blot检测,PSIP1 蛋白相对表达强度各组分别为:PSIP1-siRNA 转染组0.27±0.03,NC-siRNA 组0.59±0.04,未转染组0.60±0.05;与NC-siRNA组及未转染组比较PSIP1-siRNA转染组细胞中PSIP1蛋白水平下降(图 1)。说明siRNA能有效降低U87细胞中PSIP1表达,保证后续实验顺利进行。
|
图1 转染后各组U87细胞PSIP1蛋白(A)和mRNA(B)的表达 Fig.1 Expression of PSIP1 protein (A) and PSIP1 mRNA (B) in U87 cells transfected with siRNA. ***P<0.001 vs non-transfected or NC siRNA groups. |
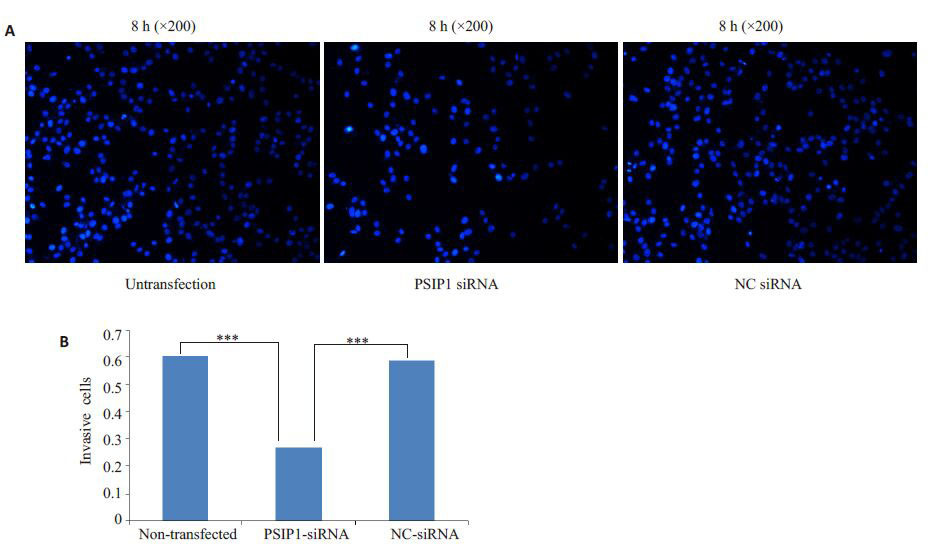
转染成功后进行侵袭实验,PSIP1-siRNA转染组8 h穿过Transwell 小室基底膜的细胞86.70±4.71 相对于NC-siRNA 转染组143.40±7.42 和未转染组150.30±5.27 明显减少,差异具有统计学意义(P<0.001),NC-siRNA转染组与未转染组之间差异无统计学意义(P>0.05,图 2)。
|
图2 转染后各组U87细胞侵袭能力 Fig.2 Detection invasion abilities of U87 cells 8 h after transfection. A: Change of invasion abilities of U87 cells after transfection (DAPI staining,original magnification: × 200); B: Cells number per field in each group. ***P<0.001 vs non-transfected or NC siRNA groups. |
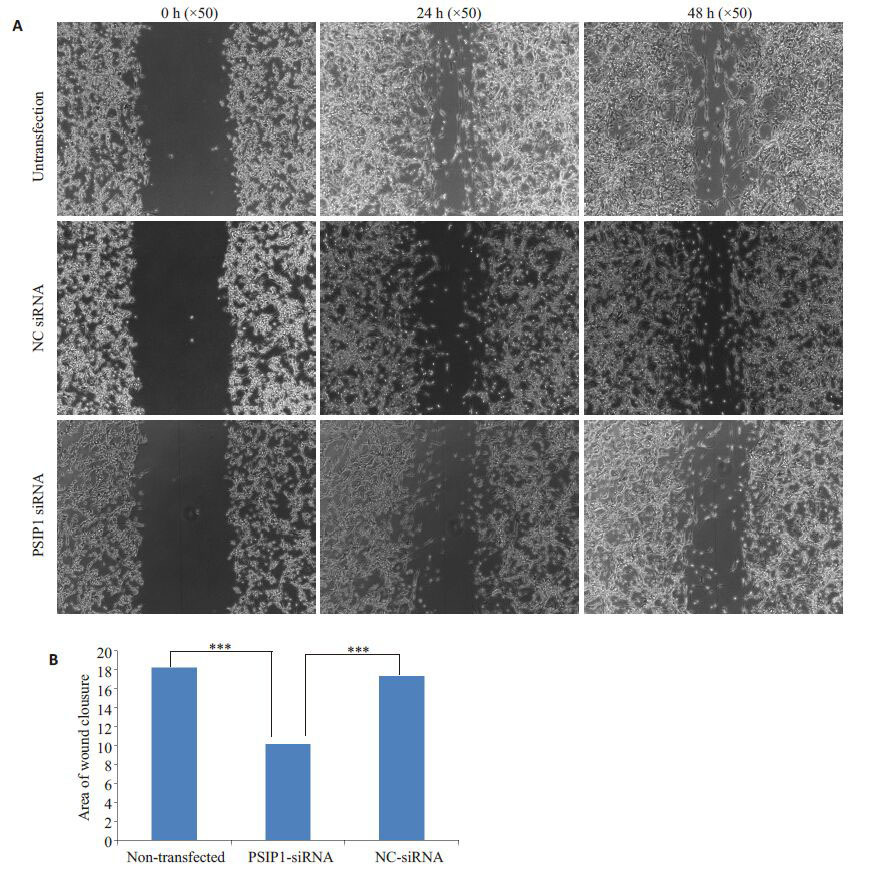
转染成功后,PSIP1-siRNA转染组24、48 h细胞迁移面积10.11±0.25 相对于NC-siRNA 转染组17.28±0.35和未转染组18.17±0.18明显减小,差异具有统计学意义(P<0.001),而NC-siRNA转染组和未转染组之间差异无统计学意义(P>0.05,图 3)。
|
图3 转染后各组U87细胞迁移能力 Fig.3 Detection of migration abilities of U87 cells at 0,24 and 48 h after transfection. A: Migration of U87 cells in each group after transfection (Original magnification: × 50); B: Statistical analysis of the wound healing assays. ***P<0.001 vs non-transfected or NC siRNA groups. |
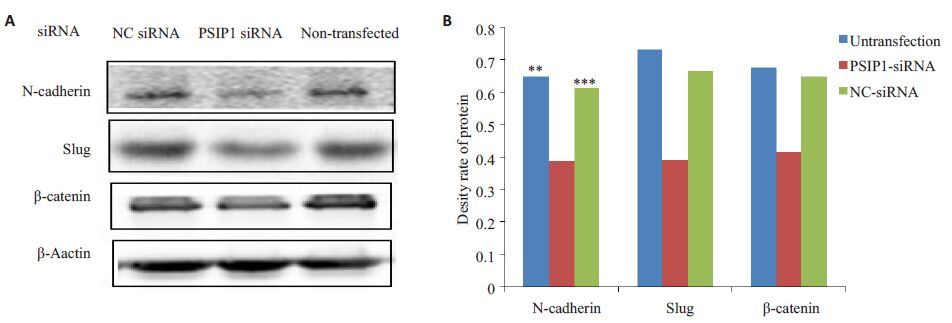
Western blot检测了Slug、N-cadherin、β-catenin,结果如图 4 示,PSIP1-siRNA 转染组U87 细胞中,Slug、N-cadherin、β-catenin蛋白表达下调。
|
图4 转染后U87细胞N-Cadherin、Slug、β-Catenin蛋白的表达 Fig.4 Protein expression of N-cadherin,Slug and β-catenin in U87 cells after transfection. A: Western blotting results of the protein levels of N-cadherin,Slug and β-catenin in each group; B: Quantitative protein expression of N-cadherin,Slug and β-catenin relative to β-actin. ***P<0.001; **P<0.01 vs non-transfected or NC siRNA groups. |
胶质瘤是颅内最常见的恶性肿瘤,目前胶质瘤的治疗以手术切除为主,辅以放疗/化疗等综合治疗,但总体疗效仍不满意,复发率高,预后差[4-5]。胶质瘤的一个重要特征是高度侵袭性,这种特性使得其与正常脑组织分界不明显而不能用手术方法完全切除[6]。而上皮细胞间质化(EMT)作为肿瘤发展过程中的重要现象,可促进肿瘤细胞的侵袭[7-8]。因此,研究胶质瘤的侵袭浸润对指导胶质瘤的治疗具有重要意义。目前PSIP1/LEDGF在抗艾滋病研究方面取得较大进展[9-10],同时也参与肿瘤细胞的生长、增殖、分化及血管生成等诸多肿瘤病理生理过程[2-3]。但关于PSIP1表达对胶质瘤侵袭、迁移能力的影响及其是否与EMT有关的相关研究尚未见报道。
本研究通过小RNA干扰技术,下调胶质瘤U87细胞中PSIP1表达,观察了PSIP1水平降低对胶质瘤细胞侵袭、迁移能力的影响。转染培养24 h 后采用RealtimePCR检测转染效率,结果显示,PSIP1表达明显下降,U87细胞侵袭、迁移能力均显著下降,差异具有统计学意义。表明抑制PSIP1表达可明显降低胶质瘤U87细胞侵袭和迁移能力。以上研究结果表明PSIP1在胶质瘤细胞侵袭中起重要作用。为了初步探讨干扰PSIP1表达对胶质瘤U87细胞侵袭和迁移能力影响机制,结合文献报道[11-13],肿瘤EMT的发生通常伴随间质细胞来源的N-cadherin、β-catenin、Vimentin及FibroneCtin表达增加。本实验中,通过siRNA干扰降低PSIP1 表达后,间质细胞来源的N-cadherin和β-catenin蛋白表达降低,说明PSIP1可通过调节N-cadherin和β-catenin蛋白的表达影响胶质瘤U87细胞的侵袭、迁移能力,从而推断PSIP1可通过EMT影响胶质瘤U87细胞的侵袭、迁移能力。为进一步研究siRNA干扰降低PSIP1表达对U87 细胞侵袭及迁移能力的分子机制,本实验检测了EMT密切相关的转录因子Slug在U87细胞中的表达。结果显示,干扰PSIP1表达后,Slug蛋白表达明显下降,说明PSIP1可通过Slug诱导U87细胞发生EMT。Slug属于Snail锌指转录因子超家族成员之一,具有高度保守的锌指结构(C2H2-型)区域,可以通过与靶基因的E-box结构域结合从而抑制其转录,在胚胎发育,肿瘤转移及组织纤维化过程起重要作用[14-15]。在EMT过程中,Slug基因通过抑制E-cadherin的转录与表达,使上皮细胞间紧密连接丢失,失去粘附特性,从而促进上皮细胞向间质细胞转化,参与恶性肿瘤的侵袭与转移[16-17]。此外,目前研究表明,经典Wnt信号通路(Wnt/β-catenin信号通路)是诱导上皮组织EMT的重要信号通路,Wnt信号通路激活后可使Slug表达增加,从而诱导EMT[18];本实验结果显示干扰PSIP1表达后,调控经典Wnt通路的β-catenin 蛋白表达明显下调,说明PSIP1 可通过调控Wnt/β-catenin 信号通路参与胶质瘤的侵袭、迁移。因此,我们推测PSIP1可通过调节Wnt/β-catenin信号通路来调节Slug的表达,进而诱导EMT的发生,参与胶质瘤U87细胞的侵袭、迁移。
综合上述,siRNA干扰降低PSIP1 表达后,可通过抑制经典Wnt/β-catenin 信号通路来调节Slug 的表达进而调控EMT,从而参与调控U87 细胞的侵袭及迁移,这对指导胶质瘤的靶向治疗有重要意义。
| [1] | Dietz F, Franken S, Yoshida K, et al. The family of hepatomaderived growth factor proteins: characterization of a new member HRP-4 and classification of its subfamilies[J]. Biochem J, 2002, 366 (Pt 2): 491-500. ( 1) 1) |
| [2] | Guo S, Liu HD, Liu YF, et al. Hepatoma-derived growth factor: a novel prognostic biomarker in intrahepatic cholangiocarcinoma[J]. Tumour Biol, 2015, 36(1): 353-64. ( 2) 2) |
| [3] | Ishihara K, Fatma N, Bhargavan B, et al. Lens epithelium-derived growth factor deSumoylation by Sumo-specific protease-1 regulates its transcriptional activation of small heat shock protein and the cellular response[J]. FEBS J, 2012, 279(17): 3048-70. ( 2) 2) |
| [4] | Hegi ME, Diserens AC, Godard S, et al. Clinical trial substantiates the predictive value of O-6-methylguanine-DNA methyltransferasepromoter methylation in glioblastoma patients treated with temozolomide[J]. Clin Cancer Res, 2004, 10(6): 1871-4. ( 1) 1) |
| [5] | Stupp R, Mason WP, Van Den Bent MJ, et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J]. N Engl J Med, 2005, 352(10): 987-96. ( 1) 1) |
| [6] | Paw I, Carpenter RC, Watabe K, et al. Mechanisms regulating glioma invasion[J]. Cancer Lett, 2015, 362(1): 1-7. ( 1) 1) |
| [7] | Micalizzi DS, Ford HL. Epithelial-mesenchymal transition in development and cancer[J]. Future Oncol, 2009, 5(8): 1129-43. ( 1) 1) |
| [8] | Huangyang P, Shang Y. Epigenetic regulation of epithelial to mesenchymal transition[J]. Curr Cancer Drug Targets, 2013, 13(9): 973-85. ( 1) 1) |
| [9] | Basu A, Woods-Burnham L, Ortiz G, et al. Specificity of antinuclear autoantibodies recognizing the dense fine speckled nuclear pattern: Preferential targeting of DFS70/LEDGFp75 over its interacting partner MeCP2[J]. Clin Immunol, 2015, 161(2): 241-50. ( 1) 1) |
| [10] | Desimmie BA, Weydert C, Schrijvers R, et al. HIV-1 IN/pol recruits LEDGF/p75 into viral particles[J]. Retrovirology, 2015, 12(1): 16. ( 1) 1) |
| [11] | Kahlert UD, Nikkhah G, Maciaczyk J. Epithelial-to-mesenchymal (-like) transition as a relevant molecular event in malignant gliomas [J]. Cancer Lett, 2013, 331(2): 131-8. ( 1) 1) |
| [12] | Zhang X, Liu G, Kang Y, et al. N-cadherin expression is associated with acquisition of EMT phenotype and with enhanced invasion in erlotinib-resistant lung cancer cell lines[J]. PLoS One, 2013, 8(3): e57692. |
| [13] | Rizvi I, Gurkan UA, Tasoglu S, et al. Flow induces epithelialmesenchymal transition, cellular heterogeneity and biomarker modulation in 3D ovarian cancer nodules[J]. Proc Natl Acad Sci USA, 2013, 110(22): E1974-83. ( 1) 1) |
| [14] | 陈立芬, 杨智宇. Slug转录因子在肿瘤侵袭转移中的研究进展[J]. 中 国临床保健杂志, 2011, 14(5): 556-9. ( 1) 1) |
| [15] | Wang Y, Shi J, Chai K, et al. The role of snail in EMT and tumorigenesis[J]. Curr Cancer Drug Targets, 2013, 13(9): 963-72. ( 1) 1) |
| [16] | Morita T, Mayanagi T, Sobue K. Dual roles of myocardin-related transcription factors in epithelial mesenchymal transition via slug induction and actin remodeling[J]. J Cell Biol, 2007, 179(5): 1027-42. ( 1) 1) |
| [17] | Yang AD, Camp ER, Fan F, et al. Vascular endothelial growth factor receptor-1 activation mediates epithelial to mesenchymal transition in human pancreatic carcinoma cells[J]. Cancer Res, 2006, 66(1): 46-51. ( 1) 1) |
| [18] | Prasad CP, Rath G, Mathur S, et al. Expression analysis of E-cadherin, Slug and GSK3beta in invasive ductal carcinoma of breast [J]. BMC Cancer, 2009, 9(6): 325.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
