2广州荔湾区中医医院妇产科,广东 广州510000
2Department of and in prevention of cisplatin-induced ovarian damage in rats
卵巢早衰(POF)是指女性在40岁以前发生的以闭经、不育、雌激素缺乏及促性腺激素水平升高为特征的一种疾病[1]。其中由于化疗药物细胞毒性作用导致的化疗性卵巢早衰(CIPOF)是导致POF的一个重要原因[2]。近年来,叉头转录因子FOXO亚家族成员之一Foxo3a被认为在保护卵巢功能方面具有重要价值。2003年一篇发表在Science 杂志上的研究[3]发现Foxo3a-/-小鼠表现出原始卵泡广泛大量激活、卵泡过早耗竭、生育时限缩短的特征,而Schneider[4]和Pelosi 等[5]发现上调Foxo3a 基因表达能够延长大鼠的生育能力,提示Foxo3a 基因可能是抑制原始卵泡过度活化的重要调控因子。
哺乳动物的卵巢功能与原始卵泡池的大小和卵泡的闭锁程度直接相关,而卵巢颗粒细胞的生长和分化是卵泡生长启动和发育的关键[6]。孟春花等[7]发现Foxo3a基因可以通过抑制猪颗粒细胞凋亡来调节猪卵泡的闭锁及生长,同时有研究显示静止于G0/G1期的颗粒细胞对化疗药物不敏感[8]。因此,降低卵巢细胞对化疗药物的敏感性从而降低化疗药物毒副作用的同时,又不影响其对肿瘤细胞的杀伤作用,是解决化疗性卵巢早衰的关键。综上,本实验将利用重组腺病毒介导Foxo3a基因转染大鼠原代卵巢颗粒细胞,研究Foxo3a基因对大鼠卵巢颗粒细胞体外发育的调控作用和机制以及对顺铂诱导细胞凋亡是否具有保护作用,进而探究其在化疗性卵巢早衰防护中的价值。
1 材料和方法 1.1 材料来源SPF级23~26日龄雌性SD大鼠,体质量45~60 g,由中山大学实验动物中心提供。重组腺病毒AD-rFoxo3a及rAD由深圳百恩维科技有限公司构建。大鼠Foxo3a引物购自Invitrogen。FSHR一抗购自北京博奥森生物技术有限公司。Trizol 购自日本Takara。FastQuant RT Kit(With gDNase)、SuperReal PreMixPlus(SYBR Green)购自Tiangen。Foxo3a、cyclin D1、p27、Bax、Bim 一抗均购自美国Cell SignalingTechnology。Hoechst33342/PI双染试剂盒购自南京凯基生物科技发展有限公司。CCK8 试剂盒购自日本Dojindo。
1.2 大鼠卵巢原代颗粒细胞培养及鉴定 1.2.1 大鼠卵巢原代颗粒细胞分离及培养大鼠提前48 h腹腔注射PMSG(30 U),无菌条件下迅速取出双侧卵巢,用含有1% 双抗的PBS漂洗,体视显微镜下去除输卵管、卵巢被膜及血管,用29G针头刺破卵泡,释放颗粒细胞,经胶原蛋白酶消化、200目不锈钢细胞筛过滤后,1000 r/min离心10 min。台盼蓝染色鉴定细胞活力>90%,加入含有15% FBS的DMEM/F12培养基中,置于5% CO2,37 ℃饱和湿度培养箱内培养48 h,待细胞贴壁后更换培养液。
1.2.2 大鼠卵巢原代颗粒细胞鉴定HE染色:制备颗粒细胞爬片,经甲醛固定后依次通过无水乙醇、95%乙醇、80%乙醇脱水,进行苏木素及伊红染色,再依次通过95%乙醇、无水乙醇,晾干后中性树脂封片。置于光学显微镜下观察细胞形态。免疫荧光法检测FSHR蛋白表达:将原代颗粒细胞接种于48孔板,待细胞贴壁后加入4%多聚甲醛固定,10%山羊血清封闭30 min后,滴加FSHR兔多克隆抗体(1∶100)4 ℃孵育过夜,避光条件下加入荧光二抗FITC-IgG(1∶200)室温下孵育2 h。置于倒置荧光显微镜下观察荧光表达情况。
1.3 重组腺病毒体外感染颗粒细胞大鼠卵巢原代颗粒细胞以2×105/孔密度接种于6孔板,当细胞贴壁达50%~70%时,实验组加入病毒液AD-rFoxo3a(MOI=50),阴性对照组加入病毒液rAD(MOI=50),空白对照组加入相应量培养基,感染6 h后更换完全培养基。显微镜下观察细胞生长增殖情况。
1.3.1 RT-PCR法检测目的基因Foxo3a表达 (1)提取总RNA:在感染细胞36 h 及48 h 后使用Trizol 试剂提取各组细胞中总RNA;(2)反转录反应:以GAPDH基因作为内参,反应条件:42 ℃ 15 min,95 ℃ 3 min;(3)实时定量PCR反应:取反转录产物反应,设置3个复孔,反应条件:95 ℃ 10 s,60 ℃ 30 s,共40个循环。(4)定量计算:记录样本循环反应阈值(Ct)并校正,以2-△△Ct表示实验组表达量相当于对照组表达量(设置为1)的变化倍数,其中△△Ct=(Ct Foxo3a-Ct GAPDH)实验组-(CtFoxo3a-Ct GAPDH)对照组。实验重复3次。
1.3.2 Westernblotting 检测Foxo3a、cyclin D1、p27、Bax、Bim蛋白表达情况 (1)抽提总蛋白:在感染48 h后取各组细胞沉淀,加入蛋白裂解液提取总蛋白,测定蛋白浓度;(2)SDS-PAGE电泳:根据蛋白浓度计算上样量进行电泳;(3)免疫印迹:将杂交膜封闭后分别加入各蛋白一抗,4 ℃孵育过夜后加入二抗孵育1 h,显影观察。实验重复3次。
1.3.3 绘制细胞生长曲线将各处理组细胞以密度2000/孔接种于96孔板,每组设置5个复孔。分别于接种后24、36、48、60、72 h加入CCK8试剂,酶标仪450 nm波段测定各孔吸光度(A)并计算平均值,实验重复3次,绘制生长曲线。
1.3.4 细胞周期检测收集各组细胞悬液,PBS洗涤后加入预冷的70%冰乙醇固定细胞置于4 ℃过夜,弃上清后向细胞沉淀加入50 μL RNA酶,加入450 μL PI染液重悬,于流式细胞仪进行分析。实验重复3次。
1.3.5 细胞凋亡检测(1)流式细胞术:收集各组单细胞悬液,PBS 洗涤后加入Binding Buffer 400 μL 重悬细胞,分为对照管和检测管,检测管加入FITC 标记的Annexin V试剂5 μL,室温避光反应15 min,再加入10 μLPI试剂,选用激发光波长为488 nm,接收波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI荧光。实验重复3次;(2)Hoechst33342/PI双染:根据试剂盒要求分别加入Hoechst33342及PI染液进行染色。荧光显微镜下观察荧光表达情况。
1.4 顺铂对颗粒细胞的毒性作用调整细胞密度为5000/孔接种于96 孔板,设置5个复孔。各组细胞转染48 h 后加入最适浓度的顺铂(5 μg/mL),光镜下观察细胞生长情况,作用24 h后应用流式细胞术检测细胞凋亡情况,方法同上。
1.5 统计学方法实验数据采用SPSS20.0软件进行统计分析,2组间比较采用独立样本t检验;3组及3组以上的比较采用单向方差分析,组间两两比较采用LSD 法(方差齐)或Dunnett T3法(方差不齐,采用Welch法校正),以P<0.05为差异显著。
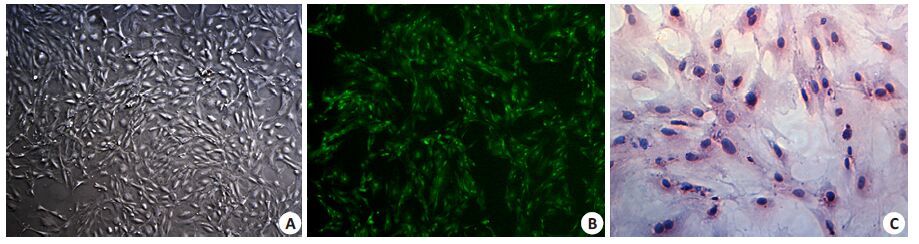
2 结果 2.1 大鼠卵巢原代颗粒细胞培养及鉴定大鼠卵巢原代颗粒细胞体外培养24 h即可贴壁,培养48 h完全贴壁,细胞呈单层贴壁集落样生长,细胞质内可见颗粒样物质(图 1A)。培养第2~4天细胞处于分裂高峰,细胞间可有丝状突起,形状呈短梭状或多角形;培养第5~7天细胞呈现长梭形类成纤维细胞形态;培养第8天后细胞立体感逐渐消失,状态渐差。倒置荧光显微镜下观察细胞FSHR表达情况,可见>95%的细胞胞质有绿色荧光表达(图 1B)。普通光学显微镜下观察经HE染色后的细胞爬片,可见大鼠卵巢原代颗粒细胞形态呈短梭形或多角形,可有伪足,细胞核大而圆、深染,胞质富含颗粒细胞及空泡,呈淡红色(图 1C)。
|
图1 大鼠原代卵巢颗粒细胞体外培养 Fig.1 Rat ovarian granulose cells in culture. A: Cells cultured in vitro for 48 h (Original magnification: ×40); B: Immunohistochemical staining for FSHR for identification of the granulose cells (×40); C: HE staining for identification of the cells (×400). |
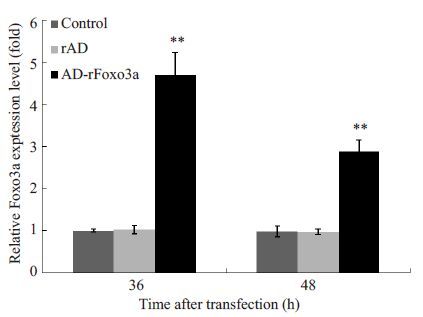
结果可见实验组Foxo3a表达量明显高于阴性对照组及空白对照组,差异具有统计学意义(P<0.01),且感染36 h较48 h表达量高,差异具有统计学意义(P<0.01)。而后两组Foxo3a基本无表达,两者差异无统计学意义(图 2)。
|
图2 RT-PCR检测颗粒细胞中 Foxo3a 的表达 Fig.2 Dectection of Foxo3a mRNA expression in granulosa cells by RT-PCR. **P<0.01 vs control group and rAD group. |
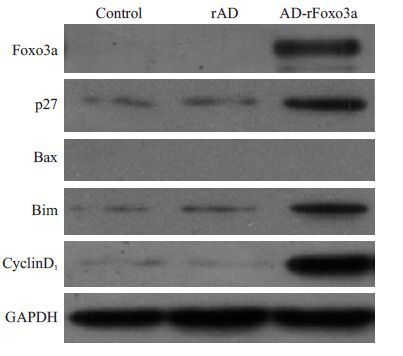
检测Foxo3a、cyclin D1、p27、Bax、Bim 蛋白表达结果显示,实验组在相对分子质量约20 000、250 000、350 000 及80 000 附近显示特异性条带,而空白对照组和阴性对照组未显示,即实验组Bim、p27、cyclin D1、Foxo3a蛋白有表达,空白对照组和阴性对照组未表达。3组的Bax蛋白均未表达(图 3)。
|
图3 各组颗粒细胞Bim、p27、Bax、cyclin D1、Foxo3a蛋白表达情况 Fig.3 Expression of Bim,p27,Bax,cyclin D1,and Foxo3a in ovarian granulosa cells. |
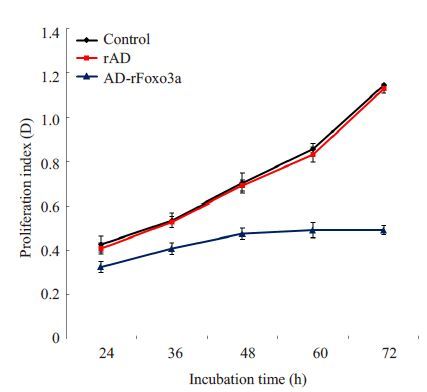
根据CCK8检测不同时间各组细胞的吸光度值(D值),取各孔平均值后绘制细胞增长曲线。结果发现,3组细胞体外培养48 h前细胞增值速率明显,但实验组的增值率较两个对照组缓慢。随着培养时间的增加,两个对照组的细胞生长趋于平稳,而实验组的细胞细胞增值速率明显落后,甚至出现降低。两个对照组细胞增值速率基本相似(图 4)。
|
图4 CCK8法检测过表达 Foxo3a 对大鼠卵巢颗粒细胞生长的影响 Fig.4 Effect of Foxo3a over-expression on proliferation of ovarian granulosa cells in vitro by CCK8 assay. |
结果表显示实验组G1期细胞所占比例较空白对照组和阴性对照组比例增加,S期细胞比例较空白对照组和阴性对照组减少,差异均具有统计学意义(P<0.01),实验组G2期细胞比例较空白对照组和阴性对照组差异无统计学意义(P>0.05),后两组各期细胞比例均无明显差异(表 1)。
| 表1 流式细胞仪检测各组细胞细胞周期分布的变化 Table 1 Changes of cell cycle distribution in the cells detected by flow cytometry (Mean±SD,n=3) |
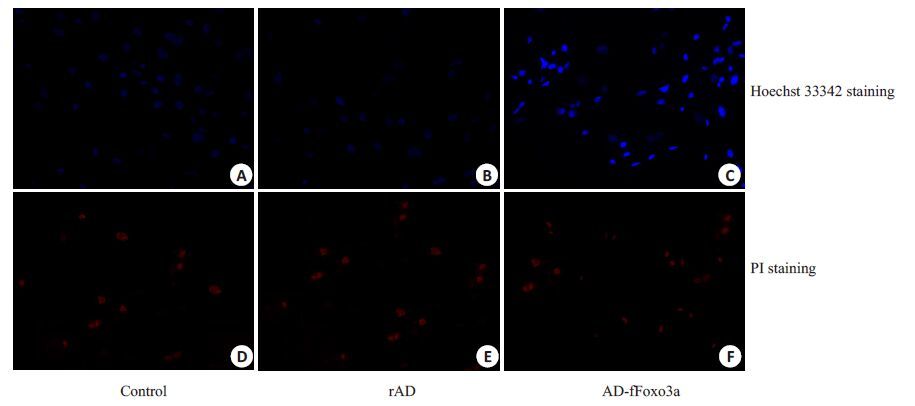
流式细胞仪检测结果表明实验组细胞总凋亡率较空白对照组和阴性对照组增加,差异具有统计学意义(P<0.01),而后两组细胞总凋亡率无明显差异(表 2)。3 组细胞经Hoechst33342/PI 双染后可见,实验组细胞呈现高蓝/低红荧光表现比例较空白对照组和阴性对照组多(图 5C,F),即凋亡细胞比例增多,而两个对照组细胞均呈现为低蓝/低红荧光表现(图 5A,B,D,E),结果与流式细胞仪检测结果一致。
| 表2 流式细胞仪检测各组细胞凋亡率的变化 Table 2 Cell apoptosis rate of the cells with different treatments detected by flow cytometry (Mean±SD,n=3) |
|
图5 Hoechst33342/PI双染法检测大鼠卵巢颗粒细胞凋亡/坏死情况 Fig.5 Dectection of cell apoptosis or necrosis by Hoechst33342/PI staining (Original magnification: × 40). A-C: Hoechst33342 staining; D-F: PI staining |
顺铂作用12 h后,光镜下见各组细胞开始逐渐出现皱缩,细胞间连接逐渐消失;作用24 h后细胞逐渐漂浮于培养基表面,贴壁细胞逐渐减少;随着培养时间的延长,凋亡及坏死细胞逐渐增多。流式细胞仪检测结果表明实验组细胞凋亡率较空白对照组和阴性对照组增加,差异具有统计学意义(P<0.01),而后2组细胞凋亡率无明显差异。经顺铂处理的3组细胞凋亡率均明显高于普通培养组(P<0.01),差异具有统计学意义(表 3)。
| 表3 流式细胞仪检测各组细胞的总凋亡率 Table 3 Total cell apoptosis rate detected by flow cytometry (Mean±SD,n=3) |
众所周知,化疗药物可通过诱导细胞凋亡等多种机制抑制癌细胞增殖,达到治疗及延长患者生存期的目的。但不可置否,化疗药物的细胞毒性尤其是生殖毒性可对卵巢功能产生不良影响[9-12]。研究显示,接受化疗的女性肿瘤患者中有70%~90%出现不同程度的卵巢功能受损[13]。顺铂是目前常用的化疗药物之一,其可[14]诱导卵母细胞和颗粒细胞凋亡,刺激原始静止卵泡过度活化从而增加卵泡对化疗药物的敏感性,最终导致卵巢功能衰退。我们前期研究已证明顺铂对体外培养的人、大鼠颗粒细胞及大鼠窦前卵泡均具有明显的毒性作用[15-17],并发现通过促进凋亡抑制基因表达可抑制体外颗粒细胞的凋亡并改善化疗性卵巢早衰大鼠的卵巢功能[18-19]。近年来有研究显示,Foxo3a基因可通过抑制卵泡过度活化和卵巢颗粒细胞凋亡从而对哺乳动物卵巢功能的保护起到关键作用[3-5, 20],因此本实验通过重组腺病毒过表达大鼠原代卵巢颗粒细胞Foxo3a基因,探究该基因对卵巢颗粒细胞体外发育可能的调控作用机制以及其对顺铂细胞毒性的保护作用。
本实验研究发现,过表达Foxo3a基因可通过上调大鼠原代卵巢颗粒细胞中cyclin D1及p27蛋白表达,促使细胞周期静止在G1期,与Liu 等[9]学者的观点一致。同时,我们亦观察到实验组细胞的凋亡比率较对照组增加,且凋亡相关蛋白Bim的表达亦有所增加,故我们认为过表达Foxo3a基因也可通过上调Bim蛋白表达进而诱导体外培养的大鼠颗粒细胞的凋亡,与Gilly等[21]的研究结果一致。基于既往Blumenfeld等[22]认为处于静止期的卵巢颗粒细胞对顺铂等化疗药物不敏感的理论基础,本实验向转染后的各组细胞中加入适当浓度的顺铂,以观察过表达Foxo3a基因是否可以逆转顺铂对卵巢颗粒细胞的毒性作用。我们发现实验组与对照组相比并未停止或减少细胞凋亡的发生,反而表现为细胞凋亡率增加。因此我们认为,过表达Foxo3a基因并不能抑制顺铂对体外培养的大鼠卵巢颗粒细胞的促凋亡作用。
已证实Foxo3a基因存在多个下游靶基因[9, 23-25],其可通过不同的分子通路或受到不同刺激因子影响来调控多个功能相近及相反的蛋白表达,当对细胞中某些蛋白的调控占优势时,则表现为相应的调控作用。根据本研究3组颗粒细胞生长曲线结果,我们认为体外培养的大鼠卵巢颗粒细胞过表达Foxo3a基因后表现出细胞增殖缓慢、生长滞后,而随着培养时间的延长,细胞出现生长停滞甚至表现为以凋亡占主要优势,即对于体外培养的大鼠卵巢颗粒细胞,Foxo3a基因上调细胞Bim等凋亡相关蛋白活性的程度及表达量可能较细胞周期调控蛋白如cyclin D1及p27等蛋白的能力更强,进而导致大鼠卵巢颗粒细胞在体外培养环境中以细胞凋亡为主要表现。同时,我们前期研究显示顺铂诱导卵巢颗粒细胞凋亡与促进凋亡基因Bax 表达、降低凋亡抑制基因Bcl-2表达高度相关[17],而本实验研究发现Foxo3a调控大鼠卵巢颗粒细胞凋亡的机制与Bax基因无明显相关性,故我们认为过表达Foxo3a基因不能阻断顺铂导致的促凋亡基因Bax高表达,同时可通过促进另一凋亡蛋白Bim的高表达进一步加速颗粒细胞的凋亡,因此无法逆转顺铂诱导卵巢颗粒细胞凋亡的结局。
目前研究者们就Foxo3a基因对雌性动物生殖细胞和卵泡发育调控及卵巢功能的保护作用众说纷纭。部分学者通过体内实验证实Foxo3a基因可以避免鼠原始卵泡过度耗竭、延长卵巢储备和生育能力[3, 5, 26],但另有部分学者如Liu[12]、Kong等[26]却认为Foxo3a基因持续表达引起卵母细胞及卵泡发育迟缓,而降低Foxo3a基因表达可增加鼠静息卵巢储备。本实验研究认为,过表达Foxo3a基因虽在体外可使大鼠卵巢颗粒细胞周期停滞在细胞周期静止期,但同时也促进了颗粒细胞的凋亡,并且不能逆转顺铂导致的颗粒细胞凋亡过程。由于卵巢内卵泡的生长发育及闭锁不仅受到颗粒细胞的影响,亦受到卵母细胞及其他生殖相关细胞的增殖和凋亡、卵巢内分泌及其他微环境影响[27-28],因此在体内外不同环境下同一基因对卵巢颗粒细胞生长发育的调控作用和机制可能有所差异,对于该基因是否对体内颗粒细胞和卵泡的生长发育亦存在类似的负性调控作用以及是否对顺铂的卵巢毒性作用具有保护作用则缺少体内实验证据。与此同时,有研究显示某些与细胞生长发育相关的基因如Smad3 和miRNA在鼠类卵巢中不同阶段卵泡中的颗粒细胞、不同阶段的卵泡内的表达规律存在差异[29-32],由于本实验未将不同生长发育阶段的卵泡中的颗粒细胞分别分离培养,因此我们认为Foxo3a基因对于大鼠不同阶段卵泡内的颗粒细胞的调控作用可能存在差异,该差异是造成本实验结果不同于其他学者研究结果的原因之一。
雌性动物卵泡的生长发育及闭锁由多种复杂机制和死亡配体-受体系统调控,控制卵泡生长活化及闭锁的基因的主要作用靶点亦可能位于卵泡表面,并依赖于体内内分泌系统及卵泡的三维结构特性,而非单一通过调控颗粒细胞或卵母细胞生长发育进而影响卵泡的发育或闭锁。由于本实验发现过表达Foxo3a基因可诱导体外卵巢颗粒细胞静止,故不能排除其在体内可以避免卵泡过度活化、诱导卵泡静止。虽然我们的体外实验未证实该基因能够逆转顺铂诱导颗粒细胞凋亡作用,但不能完全否认该基因对顺铂引起的卵巢损伤无保护作用。因此,我们将通过体内实验进一步探讨Foxo3a基因在体内对于卵巢颗粒细胞和卵泡生长发育的调控作用机制,探究该基因是否能够逆转顺铂的卵巢毒性作用,达到保护卵巢功能、预防化疗性卵巢早衰的作用,为临床应用提供可靠依据。
| [1] | Meskhi A, Seif MW. Premature ovarian failure[J]. Curr Opin Obstet Gynecol, 2006, 18(4): 418-26. ( 1) 1) |
| [2] | Voorhuis M, Onland-Moret NC, Janse F, et al. The significance of fragile X mental retardation gene 1 CGG repeat sizes in the normal and intermediate range in women with primary ovarian insufficiency[J]. Hum Reprod, 2014, 29(7): 1585-93. ( 1) 1) |
| [3] | Castrillon DH, Miao L, Kollipara R, et al. Suppression of ovarian follicle activation in mice by the transcription factor Foxo3a[J]. Science, 2003, 301(5630): 215-8. ( 3) 3) |
| [4] | Schneider A, Zhi X, Moreira F, et al. Primordial follicle activation in the ovary of Ames dwarf mice[J]. J Ovarian Res, 2014, 7(8): 120. ( 1) 1) |
| [5] | Pelosi E, Omari S, Michel M, et al. Constitutively active Foxo3 in oocytes preserves ovarian reserve in mice[J]. Nat Commun, 2013, 4 (6): 1843. ( 3) 3) |
| [6] | Chavakis E, Urbich C, Dimmeler S. Homing and engraftment of progenitor cells: a prerequisite for cell therapy[J]. J Mol Cell Cardiol, 2008, 45(4): 514-22.( 1) 1) |
| [7] | 孟春花, 张芬芬, 李健, 等. FoxO3a转录因子对不同直径猪卵泡中颗粒细胞的调节[J]. 南京晓庄学院学报, 2012(6): 65-8, 80.( 1) 1) |
| [8] | Partridge AH. Prevention of premature menopause and preservation of fertility in young cancer survivors: hopeful though modest long-term results[J]. JAMA, 2016, 314(24): 2625-7. ( 1) 1) |
| [9] | Liu H, Luo LL, Qian YS, et al. FOXO3a is involved in the apoptosis of naked oocytes and oocytes of primordial follicles from neonatal rat ovaries[J]. Biochem Biophys Res Commun, 2009, 381(4): 722-7. ( 3) 3) |
| [10] | Gracia CR, Sammel MD, Freeman E, et al. Impact of cancer therapies on ovarian reserve[J]. Fertil Steril, 2012, 97(1): 134-40.e1. |
| [11] | Sui XX, Luo LL, Xu JJ, et al. Evidence that FOXO3a is involved in oocyte apoptosis in the neonatal rat ovary[J]. Biochem Cell Biology, 2010, 88(4): 621-8. |
| [12] | Liu L, Rajareddy S, Reddy P, et al. Infertility caused by retardation of follicular development in mice with oocyte-specific expression of Foxo3a[J]. Development, 2007, 134(1): 199-209. ( 2) 2) |
| [13] | Meirow D, Nugent D. The effects of radiotherapy and chemotherapy on female reproduction[J]. Hum Reprod Update, 2001, 7 (6): 535-43. ( 1) 1) |
| [14] | Chang EM, Lim E, Yoon S, et al. Cisplatin induces overactivation of the dormant primordial follicle through PTEN/AKT/FOXO3a pathway which leads to loss of ovarian reserve in mice[J]. PLoS One, 2015, 10(12): e0144245. ( 1) 1) |
| [15] | 叶小凤. 骨髓间充质干细胞治疗顺铂所致大鼠在体卵巢化疗性损伤的实验研究[D]. 广州: 南方医科大学, 2011.( 1) 1) |
| [16] | 张芍. 骨髓间充质干细胞对顺铂所致大鼠窦前卵泡损伤的保护作用的实验研究[D]. 广州: 南方医科大学, 2010. |
| [17] | 张春燕, 何援利. 顺铂对人卵巢黄素化颗粒细胞的毒性及凋亡的影响[J]. 中国药理学通报, 2008, 24(6): 796-9.( 2) 2) |
| [18] | Wang X, He Y, Liu M, et al. Lentivirus-mediated bcl-2 gene therapy improves function and structure of chemotherapy-damaged ovaries in wistar rats[J]. Am J Reprod Immunol, 2013, 69(5): 518-28. ( 1) 1) |
| [19] | 王雪峰, 何援利, 谭峰. Bcl-2基因对环磷酰胺诱导的大鼠卵巢损伤的保护作用[J]. 中国妇幼保健, 2013, 28(1): 143-7.( 1) 1) |
| [20] | Christian M, Lam EW, Wilson MS, et al. FOXO transcription factors and their role in disorders of the female reproductive tract [J]. Curr Drug Targets, 2011, 12(9): 1291-302. ( 1) 1) |
| [21] | Gilley J, Coffer PJ, Ham J. FOXO transcription factors directly activate bim gene expression and promote apoptosis in sympathetic neurons[J]. J Cell Biol, 2003, 162(4): 613-22. ( 1) 1) |
| [22] | Blumenfeld Z, Avivi I, Eckman A, et al. Gonadotropin-releasing hormone agonist decreases chemotherapy-induced gonadotoxicity and premature ovarian failure in young female patients with Hodgkin lymphoma[J]. Fertil Steril, 2008, 89(1): 166-73. ( 1) 1) |
| [23] | 罗丽莉, 刘红, 钱元恕, 等. 新生大鼠卵母细胞凋亡信号通路SCF-FOXO3a的体外实验研究[J]. 生殖与避孕, 2009, 29(7): 417-21.( 1) 1) |
| [24] | 陏旭霞, 傅玉才, 罗丽莉, 等. Foxo3a转录因子参与卵母细胞的凋亡[J]. 中国现代医学杂志, 2007, 17(12): 1438-41. |
| [25] | 刘红. 新生大鼠卵母细胞凋亡信号通路调控的实验研究[D]. 汕头:汕头大学, 2009.( 1) 1) |
| [26] | Kong XX, Fu YC, Xu JJ, et al. Resveratrol, an effective regulator ofovarian development and oocyte apoptosis[J]. J Endocrinol Invest, 2011, 34(11): e374-81. ( 1) 1) |
| [27] | Manabe N, Goto Y, Matsuda-Minehata F, et al. Regulation mechanism of selective atresia in porcine follicles: regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50 (5): 493-514. ( 1) 1) |
| [28] | Ingman WV, Robertson SA. Defining the actions of transforming growth factor beta in reproduction[J]. Bioessays, 2002, 24(10): 904-14. ( 1) 1) |
| [29] | Xu J, Oakley J, Mcgee EA. Stage-specific expression of Smad2 and Smad3 during folliculogenesis[J]. Biol Reprod, 2002, 66(6): 1571-8.( 1) 1) |
| [30] | 李倩. mir-381在小鼠卵泡不同发育阶段的表达及其对颗粒细胞的影响[D]. 武汉: 华中农业大学, 2014. |
| [31] | 杜玉爱. 小鼠卵泡发育过程中miRNA-351、miRNA-871的表达规律及其对卵泡颗粒细胞功能的调控研究[D]. 武汉: 华中农业大学,2014. |
| [32] | 但意. MiRNA-130a在小鼠卵泡发育过程中的表达和对颗粒细胞增殖和凋亡的影响[D]. 武汉: 华中农业大学, 2014.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
