2南方医科大学南方医院消化科,广东 广州 510515
3南方医科大学南方医院感染内科,广东 广州 510515
2Department of Gastroenterology,Nanfang Hospital, Southern Medical University, Guangzhou, 510515, China
3Department of Infectious Diseases, Nanfang Hospital, Southern Medical University, Guangzhou, 510515, China
血管内膜保持完整性是机体能够维持循环系统与组织器官局部内环境稳定的关键因素之一。多种因素如炎症反应、应激反应、免疫反应、心脑血管病等引起内皮损伤后,会诱发或促进多种疾病的发生发展[1]。血管紧张素Ⅱ(AngⅡ)最初于1985年在牛脑中发现,是一类具有广泛生物学活性的内源性血管活性八肽[2-3]。有研究发现,AngⅡ可以通过与细胞膜上AT1受体结合作用于NAD(P)H氧化酶,使细胞内ROS生成翻倍[4],参与一系列心血管疾病的进展,特别是在高血压[5]、动脉粥样硬化[6]和心力衰竭[7]的发生过程中,AngⅡ介导的氧化应激相关性内皮功能障碍起到了关键作用[8-9],但其具体机制仍不清楚。近年来关注的热点NOD样受体热蛋白结构域相关蛋白3炎症小体是一种固有免疫系统的模式识别受体(PPR),它由NLRP3、凋亡相关斑点样蛋白ASC以及半胱氨酸蛋白酶caspase-1共同组成,细胞内的各种危险信号都可以激活NLRP3炎症小体,特别是细胞内产生的大量ROS,导致caspase1前体大量剪切成具有生物活性的caspase1 P10片段,促进下游IL-1β和IL-18等炎症因子的生成与成熟[10],诱导心血管病变的发生发展。但是极少有人研究AngⅡ是否通过激活NLRP3炎症小体,造成血管内皮细胞炎症反应,因此实验探讨AngⅡ诱导心血管病变的相关机制,验证NLRP3炎症小体是否参与到这一病理过程中。
1 材料和方法 1.1 实验试剂高糖DMEM培养基、Optimem培养基、胎牛血清、 PBS缓冲液以及胰蛋白酶购自Gibico。AngⅡ原液、氯沙坦、H2O2 清除剂CAT、NAD(P)H 抑制剂DPI、caspase-1 抑制剂YVAD、甘氨酸、Tris-base、SDS、牛血清白蛋白购自Sigma。NLRP3 siRNA转染试剂盒购自中国广州锐博公司。脂质体(Lipo2000)购自Invitrogen。RIPA裂解液、Cocktail tablets 蛋白酶抑制剂、PMSF购自中国Beyotime公司。BCA蛋白浓度检测试剂盒购自Thermo。SDS凝胶上样缓冲液、丙烯酰胺、硝酸纤维素膜购自Bioworld。NOX4、NLRP3 抗体购自Abcam,caspase1、IL-1β抗体购自Proteintech。荧光二抗购自南方医院新实验楼试剂中心。
1.2 细胞培养HUVECs购于美国ATCC中心。用含10%胎牛血清的DMEM培养细胞,放入5% CO2、37 ℃的孵箱中培养。当细胞铺满培养瓶底部时,进行传代。用0.25%的胰蛋白酶消化细胞,以1传3比例进行传代,传代后第2天进行换液。
1.3 实验分组及其干预(1)AngⅡ时间梯度刺激实验:分组包括对照组、1 h组、3 h组、6 h组、12 h组、24 h组,共6组。各组先用含10%胎牛血清的DMEM培养基培养细胞,然后改用不含血清的DMEM 2 mL进行培养,饥饿24 h。除对照组外,其他组在不同时间点加入10-5 mol/L AngⅡ原液20 μL,充分混匀,最终细胞在AngⅡ浓度为10-7 mol/L的培养液中培养相应时间;(2)Ang Ⅱ浓度梯度刺激实验:分组包括对照组、AngⅡ 10-5 mol/L组、AngⅡ10-7 mol/L组、AngⅡ 10-9 mol/L 组、AngⅡ10-11 mol/L 组,共5 组。各组先用含10%胎牛血清的DMEM培养细胞,然后改用不含血清的DMEM 2 mL进行培养,饥饿24 h。除对照组外,其他组分别加入相应浓度AngⅡ原液20 μL,充分混匀,刺激12 h;(3)AngⅡ受体阻断实验:分组包括对照组、AngⅡ组、AngⅡ+氯沙坦组,共3 组。各组先用含10%胎牛血清的DMEM培养细胞,然后改用不含血清的DMEM 2 mL进行培养,饥饿24 h。在AngⅡ+氯沙坦组分别加入20 μL氯沙坦(10-3 mol/L)预处理1 h,然后除了对照组,其他组加入10-7 mol/L AngⅡ原液20 μL,充分混匀,刺激12 h;(4)活性氧阻断实验:分组包括对照组、AngⅡ组、AngⅡ+DPI 组、AngⅡ+CAT组,共4组。各组先用含10%胎牛血清的DMEM培养细胞,然后改用不含血清的DMEM 2 mL进行培养,饥饿24 h。在AngⅡ+DPI组、AngⅡ+CAT组分别加入20 μL DPI(10-5 mol/L),CAT(10 mmol/L)预处理1 h,然后除了对照组,其他组加入10-7mol/LAngⅡ原液20 μL,充分混匀,刺激12 h;(5)NLRP3 干扰实验:分组包括Scramble siRNA 组、Scramble siRNA+AngⅡ组、NLRP3 siRNA组、NLRP3 siRNA+AngⅡ组,共4组。各组先用含10%胎牛血清的DMEM培养细胞,待细胞铺满六孔板底30%~50%的时候,进行转染实验。转染6 h后,再改用含10%胎牛血清的DMEM培养细胞。待细胞铺满六孔板底90%的时候,在Scramble siRNA + Ang Ⅱ组、NLRP3 siRNA+AngⅡ组加入10-7 mol/L AngⅡ原液20 μL,充分混匀,刺激12 h;(6)caspase1阻断实验:分组包括对照组、AngⅡ组、AngⅡ+YVAD组,共3组。各组先用含10%胎牛血清的DMEM培养细胞,然后改用不含血清的DMEM 2 mL进行培养,饥饿24 h。在AngⅡ+YVAD组加入20 μL YVAD(4×10-5 mol/L)预处理1 h,然后除了对照组,其他组加入10-7 mol/L AngⅡ原液20 μL,充分混匀,刺激12 h。
1.4 蛋白印迹法(Western blotting)检测NOX4、NLRP3、caspase1 和IL-1β蛋白的表达水平:以上各种实验,在刺激时间结束后收集各组细胞,除去旧的培养基,用PBS 缓冲液浸洗3 次,再将细胞放入-80 ℃过夜保存。加入RIPA裂解液裂解细胞,离心后提取上清,用BCA法检测蛋白浓度,在上清中加入凝胶上样缓冲液。用SDS-PAGE凝胶电泳分离蛋白。将电泳分离后不同相对分子质量的蛋白分子电转至硝酸纤维素膜上,用5%的牛血清白蛋白封闭液室温封闭1 h。加入一抗(1∶1000),4 ℃孵育过夜。TBST摇床浸洗3次,每次10min。将膜放入荧光二抗(1∶10000),避光孵育1 h。TBST摇床避光浸洗3次,每次10 min。将膜压干后,放入Beckman 荧光扫描仪内扫描。最后用Gel-Pro Analyzer 软件对图片进行灰度分析。每组实验重复3 次,以β-actin为内参照。
1.5 统计学分析采用SPSS 13.0统计软件分析数据。计量资料以均数±标准差表示,各组间均数比较采用单因素方差分析及LSD检验。以P <0.05为差异具有统计学意义。
2 结果 2.1 AngⅡ对激活HUVECs炎症小体的时间和浓度效应不同时间、浓度Ang Ⅱ刺激HUVECs 后,胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平检测结果(图 1~2):用浓度为10-7 mol/L AngⅡ刺激HUVECs,随着刺激时间的延长,胞内NOX4、NLRP3和caspase1 P10活性片段的蛋白表达逐渐增高,在12 h达到峰值且较对照组明显增高,然后表达降低;而IL-1β P17活性片段在刺激6 h后表达较对照组显著增高。用不同浓度的Ang Ⅱ 刺激HUVECs 12 h,胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平较对照组均有增加,而浓度为10-9 mol/L AngⅡ作用效果最明显。
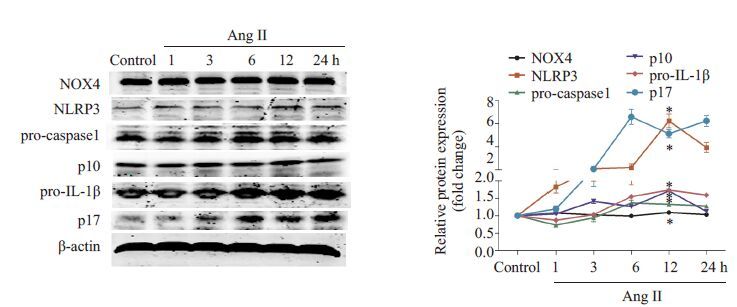
|
图 1 浓度10-7 mol/L AngⅡ不同时间刺激后,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.1 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs treated with 10-7 mol/L AngⅡ for varying lengths of time. *P <0.05 vs control group (n=3). |
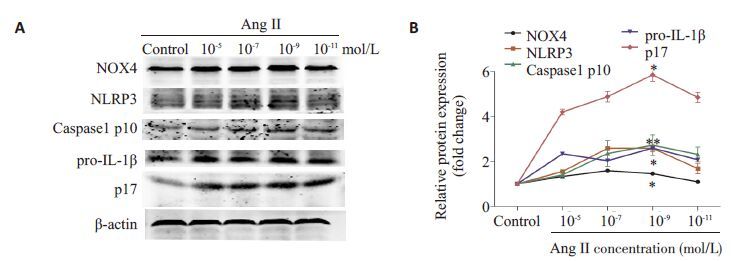
|
图 2 各浓度梯度AngⅡ刺激12 h后,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.2 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs treated with different concentrations of AngⅡ for 12 h. *P <0.05 vs control group (n=3). |
预先用氯沙坦阻断AngⅡ受体,再用10-9 mol/L Ang Ⅱ 刺激HUVECs 12 h,胞内NOX4、NLRP3、 caspase1和IL-1β蛋白表达水平检测结果(图 3):AngⅡ+ 氯沙坦组NOX4、NLRP3、caspase1 P10和IL-1β P17蛋白表达明显低于单纯AngⅡ刺激组。
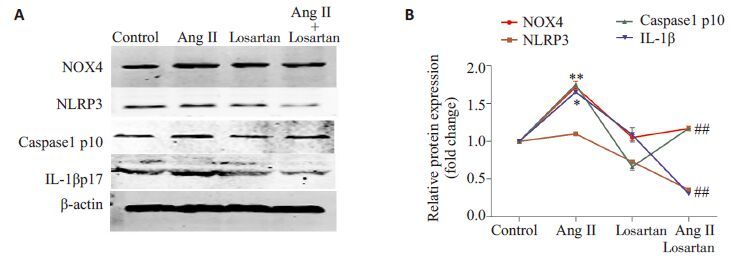
|
图 3 用AngⅡ受体阻断剂氯沙坦阻断AngⅡ作用,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.3 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs pretreated with Ang Ⅱ receptor blocker losartan prior to Ang Ⅱ treatment. *P <0.05 vs control group; #P <0.05 vs Ang Ⅱ group (n=3). |
预先用DPI和CAT阻断HUVECs内ROS生成,再用10-9 mol/L Ang Ⅱ刺激HUVECs 12 h,胞内NOX4、NLRP3、caspase1 和IL-1β蛋白表达水平检测结果(图 4):AngⅡ+DPI 组和AngⅡ+CAT 组NOX4、NLRP3、caspase1 P10和IL-1β P17蛋白表达明显低于单纯Ang Ⅱ刺激组。
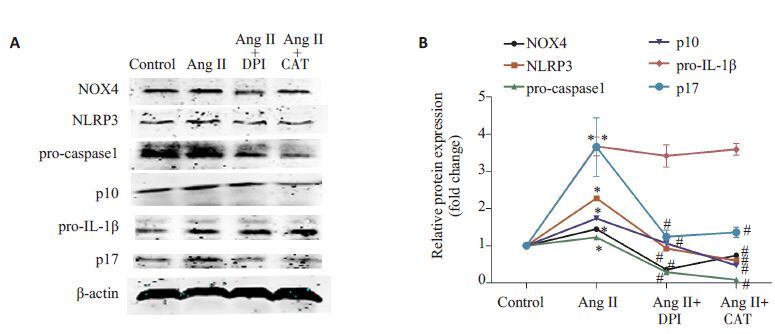
|
图 4 用NAD(P)H抑制剂DPI和H2O2清除剂CAT阻断细胞内ROS生成,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.4 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs pretreated with NAD(P)H inhibitor DPI and H2O2 scavenger CAT prior to Ang Ⅱ. *P <0.05 vs control group; #P <0.05 vs Ang Ⅱ group (n=3). |
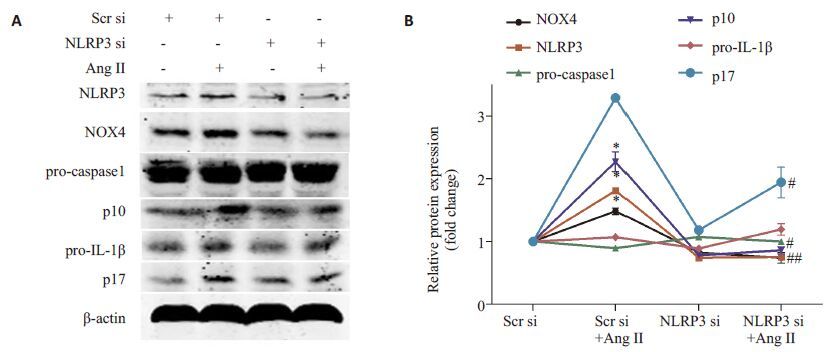
用NLRP3 siRNA沉默HUVECs内NLRP3基因的表达,再用10-9 mol/L AngⅡ刺激HUVECs 12 h,胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平检测结果(图 5):NLRP3 siRNA组和NLRP3 siRNA+AngⅡ组NLRP3 表达水平显著低于Scramble siRNA 组和Scramble siRNA+AngⅡ组;NLRP3 siRNA+AngⅡ组NOX4、NLRP3、caspase1 P10和IL-1β P17蛋白表达明显低于Scramble siRNA+AngⅡ组。
|
图 5 NLRP3 siRNA沉默细胞内NLRP3蛋白表达,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和 IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.5 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs transfected with NLRP3 siRNA prior to Ang Ⅱ. *P <0.05 vs scramble siRNA group; #P <0.05 vs scramble siRNA+Ang Ⅱ group (n=3). |
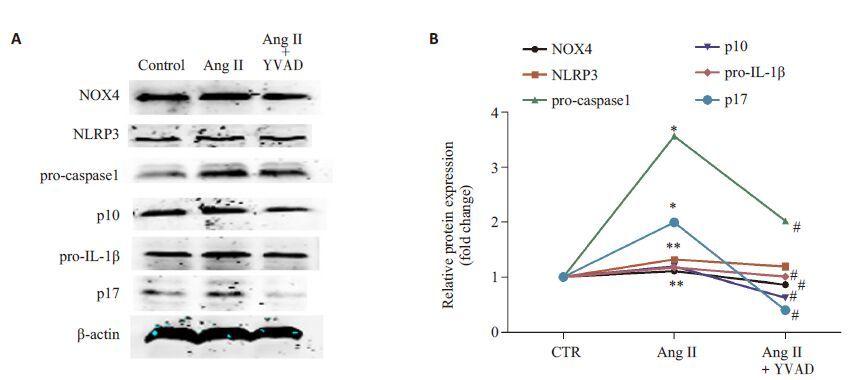
预先用YVAD抑制HUVECs内caspase1 活性,再用10-9 mol/L Ang Ⅱ刺激HUVECs 12 h,胞内NOX4、NLRP3、caspase1 和IL-1β蛋白表达水平检测结果(图 6):AngⅡ+YVAD组caspase1 P10和IL-1β P17蛋白表达明显低于单纯AngⅡ刺激组。同时AngⅡ+YVAD组NOX4和NLRP3蛋白表达也可在一定程度受到抑制。
|
图 6 用caspase1抑制剂YVAD阻断caspase1作用,各组脐静脉内皮细胞内NOX4、NLRP3、caspase1和IL-1β蛋白表达水平的蛋白印迹法检测结果 Fig.6 Protein levels of NOX4, NLRP3, caspase1 and IL-1β detected by Western blotting in HUVECs pretreated with caspase1 inhibitor YVAD prior to Ang Ⅱ. *P <0.05 vs control group; #P <0.05 vs Ang Ⅱ group (n=3). |
心血管疾病的发生与高血压、高脂血症、肥胖、糖尿病以及不良生活习惯等多种因素相关,大量研究表明, 免疫炎症机制是发起和推动这种疾病的关键驱动因素,它能使心血管损伤从早期无症状阶段发展到一个临床上有明显功能障碍和心血管重构的高级阶段,主要表现为内皮功能障碍、细胞外基质的改变、动脉粥样硬化、心肌肥厚以及伴随心肌重构而产生的血管壁的脆弱等现象[11]。因此,深入研究血管内皮炎症的发生机制具有重要的现实意义,可以为心血管疾病的预防与治疗提供理论依据。
血管内皮发生的氧化还原敏感的炎性反应过程,包括促炎因子及粘附分子的表达,脂质过氧化及细胞迁移[12]。它在高血压和动脉粥样硬化相关的血管炎症过程中扮演着重要的作用。氧化应激与炎症反应并存可诱导内皮细胞功能的损伤,进一步加重血管损伤[13]。细胞内ROS生成增多和清除能力下降,都可以导致细胞处于氧化应激状态,其中NAD(P)H氧化酶是心血管细胞ROS的最主要来源,大量NAD(P)H氧化酶生成的ROS造成心血管功能损伤,诱发心血管相关疾病的发生发展[14]。
AngⅡ是被研究的最多的NAD(P)H氧化酶激动剂。本研究观察AngⅡ作用于HUVECs 后,细胞内NAD(P)H氧化酶表达含量的变化,选NOX4蛋白这一代表性的NAD(P)H氧化酶作为观察指标。结果显示,AngⅡ确实可以上调HUVECs内NOX4蛋白的表达,特别是在浓度为10-9 mol/L AngⅡ刺激HUVECs 12 h后,NOX4蛋白表达显著增高。NOX4是细胞内ROS生成关键酶,可以促进ROS的大量生成,导致HUVECs处于氧化应激状态,而这也是下游各种信号通路开启的关键环节,包括抗氧化通路、促炎信号通路等。
当血管内皮细胞处于氧化应激状态时可以启动细胞内的炎症反应,最终导致血管内皮功能紊乱[15]。炎症小体是细胞内一种多蛋白复合体,主要包括有4种,分别是NLRP1、NLRP3、NLRC4和AIM2炎症小体,其中NLRP3炎症小体被研究的最深入。NLRP3炎症小体可以感受细胞内的危险信号分子,特别是细胞内大量生成的ROS,然后激活NLRP3 炎症小体,最终诱导IL-1β、IL-18 等促炎因子的生成与成熟[16]。NLRP3 炎症小体是否参与到血管内皮炎症的发生过程还不清楚,极少有人研究Ang Ⅱ是否可以通过促进ROS 生成,激活NLRP3炎症小体,最终诱导血管内皮炎症的发生。本研究发现在浓度为10-9 mol/L AngⅡ刺激HUVECs 12 h后,随着NOX4蛋白表达升高的同时,NLRP3炎症小体的相应组分NLRP3 和caspase1 都有明显上调,而NLRP3炎症小体的作用底物IL-1β前体被大量剪切成具有活性的IL-1β P17 片段,发挥促炎作用。而NAD(P)H抑制剂DPI和H2O2清除剂CAT可以明显阻断AngⅡ的上述作用,这些都提示了AngⅡ可以激活HUVECs的NLRP3炎症小体通路,而这一作用是依赖胞内ROS的。紧接着,我们用NLRP3 siRNA或者caspase1抑制剂YVAD阻断NLRP3炎症小体的功能,探究AngⅡ启动的炎症反应是否依赖NLRP3炎症小体。我们发现,随着NLRP3 炎症小体功能的阻断,下游的促炎物质IL-1β P10显著减少,起到一种保护作用。此外,我们还发现NLRP3蛋白沉默以后,NOX4蛋白的表达也出现明显下降,这提示NLRP3和NOX4之间可能存在着一种交互作用,而caspase1的抑制剂YVAD对NOX4蛋白表达影响不明显。
AngⅡ作为肾素-血管紧张素系统(RAS)中最重要的成分,在病理状态下,对各种心血管疾病的发生发展具有重要影响作用。本实验探讨了AngⅡ通过NLRP3炎症小体促进血管炎症的发生,而血管炎症状态是很多心血管疾病的共有发病基础,如果能控制住血管炎症,心血管疾病也可以得到较好的控制。
| [1] | Liu D, Zhang D, Scafidi J, et al. C1 inhibitor prevents Gramnegative bacterial lipopolysaccharide-induced vascμLar permeability[J]. Blood, 2005, 105(6): 2350-5.( 1) 1) |
| [2] | Gavras I, Gavras H. Angiotensin Ⅱ as a cardiovascμLar risk factor [J]. J Hum Hypertens, 2002, 16(Suppl 2): S2-6.( 1) 1) |
| [3] | 文海若, 李波, 付研. 血管紧张素Ⅱ在心血管疾病中的氧化应激调节机制[J]. 中国医刊, 2014, 49(2): 12-4.( 1) 1) |
| [4] | Brady NR, Hamacher-Brady A, Westerhoff HV, et al. A wave of reactive Oxygen species (ROS)-induced ROS release in a sea of excitable mitochondria[J]. Antioxid Redox Signal, 2006, 8(9/10): 1651-65.( 1) 1) |
| [5] | Mitchell KD, Botros FT, Navar LG. Intrarenal renin-angiotensin system and counteracting protective mechanisms in angiotensin Ⅱ-dependent hypertension[J]. Acta Physiol Hung, 2007, 94(1/2): 31-48.( 1) 1) |
| [6] | Warnholtz A, Nickenig G, SchμLz E, et al. Increased NADHoxidase- mediated superoxide production in the early stages of atherosclerosis: evidence for involvement of the renin-angiotensin system[J]. Circulation, 1999, 99(15): 2027-33.( 1) 1) |
| [7] | Sirker A, Zhang M, Murdoch C, et al. Involvement of NADPH oxidases in cardiac remodelling and heart failure[J]. Am J Nephrol, 2007, 27(6): 649-60.( 1) 1) |
| [8] | Thomas SR, Witting PK, Drummond GR. Redox control of endothelial function and dysfunction: molecμLar mechanisms and therapeutic opportunities[J]. Antioxid Redox Signal, 2008, 10(10): 1713-65.( 1) 1) |
| [9] | 冉海红, 张然. 肾素-血管紧张素系统通过氧化应激机制参与血管反应性的调节[J]. 生理科学进展, 2011, 42(2): 117-20.( 1) 1) |
| [10] | Tschopp J, Schroder K. NLRP3 inflammasome activation: The convergence of mμLtiple signalling pathways on ROS production? [J]. Nat Rev Immunol, 2010, 10(3): 210-5.( 1) 1) |
| [11] | 陈明, 陈志武, 龙子江. 炎性标志物对心血管疾病风险性的预测及意义[J]. 心血管病学进展, 2013, 34(2): 290-5.( 1) 1) |
| [12] | Lassègue B, Griendling KK. Reactive Oxygen species in hypertension; An update[J]. Am J Hypertens, 2004, 17(9): 852-60.( 1) 1) |
| [13] | 叶锦霞, 梁日欣, 王岚. 氧化应激与心血管疾病的关系研究进展[J]. 中国实验方剂学杂志, 2008, 14(10): 68-70.( 1) 1) |
| [14] | Touyz RM. Reactive Oxygen species, vascμLar oxidative stress, and redox signaling in hypertension: what is the clinical significance? J]. Hypertension, 2004, 44(3): 248-52.( 1) 1) |
| [15] | Saing L, Wei Y, Tseng C. Ergothioneine represses inflammation and dysfunction in human endothelial cells exposed to oxidized low-density lipoprotein[J]. 2015 Feb 10. doi: 10.1111/1440- 1681.12374.[Epub ahead of print].( 1) 1) |
| [16] | Szabo G, Csak T. Inflammasomes in liver diseases[J]. J Hepatol, 2012, 57(3): 642-54.( 1) 1) |
 2016, Vol. 105
2016, Vol. 105
