甲状旁腺激素是调节骨代谢的重要激素之一。低量间断注射甲状旁腺激素(PTH)可用于治疗绝经后年女性、老年男性及由糖皮质激素引起的骨质疏松症[1]。其治疗效应可能是通过抑制细胞凋亡从而增加成骨胞数量最终增加骨量来实现的[2]。但是高剂量、长时应用可能存在致癌的风险及减低PTH的疗效[3],因此化PTH,促进疗效,缩短使用时间,避免其副作用是目PTH领域研究的重要方向之一。PTH引起的这2种端的效应,是由于PTH的作用效果是与时间和剂量关的[4-5]。体内和体外研究表明,PTH可刺激骨细胞的殖、分化和凋亡[6]。PTH及其相关肽(PTHrP)调节骨细胞的增殖、分化和凋亡是通过激活甲状旁腺受体1(PTHR1)及其下游的多个信号途径实现的。
PTH(1-34)刺激PTHR1 与完整的PTH 刺PTHR1能引起相同的效应[7-8]。激活PTHR1可以引cAMP/PKA、PLC/PKC 及最新发现的不依赖PLC PKC激活途径(nonPLC/PKC)这3 条通路的激活[9],导成骨细胞增殖、分化,降低成骨细胞凋亡和减少过物酶体增殖激活受体(PPAR)对成骨分化的不良影响。然而,激活不同的通路能引起不同的效应。为了能更的理解PTH对骨代谢的影响,探究每一条通路的作机制及终末效应是至关重要。cAMP/PKA具有抑制凋亡蛋白如Bcl-2相关死亡启动蛋白(Bad)表达及增抗凋亡蛋白如Bcl-2表达,从而减低成骨细胞凋亡的用[10],而且能使Cyclin D1表达增多从而促进细胞增殖[11]。PLC/PKC通路对骨组织的影响需要进一步研究,小鼠PTHR1存在PLC通路缺陷时,在正常饮食情况下,骨量轻微降低;低钙饮食时,骨量较正常小鼠明显降低[12]。我们前期研究揭示,PTH经nonPLC/PKC通路促进受区松质骨合成,促进新骨形成[12],但是nonPLC/PKC路的具体信号中介分子不清楚,相应的影响骨代谢的理需要深入研究。最近研究发现,PTH短时间(1h)刺引起的细胞增值主要是由PKA通路主导的,而PKC路主要参与PTH的长时间(24和48 h)的刺激从而导细胞增殖的减少和凋亡[13]。既往研究表明nonPLC/PKC通路主要位于hPTH(29-34)序列当中[14-15]。在实验,我们应用构建一种N端1号位氨基酸丝氨酸(Ser)突变成甘氨酸(Gly)的hPTH(1-34)肽,使得该肽不能活PLC但能激活AC[16]。然后再截断[Gly]hPTH的基(C)端(去除激活nonPLC/PKC的PTH(29-34)序列),同时为了保持其结合力,我们将19号位的谷氨酸(Glu)替换成精氨酸(Arg)[16]。为了更好的观察nonPLC/PKC对于成骨细胞的增殖与凋亡的现象,我们合成了[G1,R19]hPTH(1-28)[简称G1R19(1-28)]和[G1,R19]hPTH(1-34)[简称G1R19(1-34)][9]。
本实验的研究目的是观察PTH 的非依赖PLC PKC通路是否会对MC3T3-E1细胞的凋亡和细胞的量造成影响以及这种影响随刺激时间变化的关系。
1 材料和方法 1.1 主要试剂及器材模拟肽G1R19(1-28)和G1R19(1-34)由广州特生物科技有限公司合成;PKC抑制剂Go6983购自美Selleck;MC3T3-E1细胞购自上海细胞库;α-MEM培基、FBS、青-链霉素双抗购自美国GIBCO;CCK-8试盒购自日本DOJINDO;Caspase-Glo® 3/7 试剂盒购美国Promega;细胞培养箱为美国Galaxyg;显微镜为本Olypus公司IX71倒置相差显微镜;SpectraMax®M5 酶标仪为美国Molecular Devices。
1.2 方法在倒置相差显微镜下计数MC3T3-E1细胞,以15 000每孔的密度接种96孔板,每孔含300 μL具有10%FBS的α-MEM(含100 U/mL青霉素和100 μg/mL链霉素),吹打均匀后,置于37 ℃、5%CO2培养箱中培养72 h直细胞达到汇合状态。当细胞达到汇合状态时,每个孔PBS清洗3遍,用不含FBS的α-MEM培基培养24 h此来达到细胞周期同步化。然后再用PBS清洗3遍,用具有2%FBS 的α-MEM培养细胞,随后随机分为5组:100 nmol/L G1R19(1-28);100 nmol/L G1R19(1-34);100 nmol/L G1R19(1-34)+1 μmol/L Go6983;1 μmol/LGo6983;空白对照组(加入等体积的去离子水)。设实验总观察时间为48 h,每组实验组分别予刺激细胞1、24、48 h,在刺激结束后,使用PBS清洗3 遍,加入具2%FBS的α-MEM培基并且加入与实验试剂等体积去离子水直至48 h(图 1),检测细胞数量及凋亡。
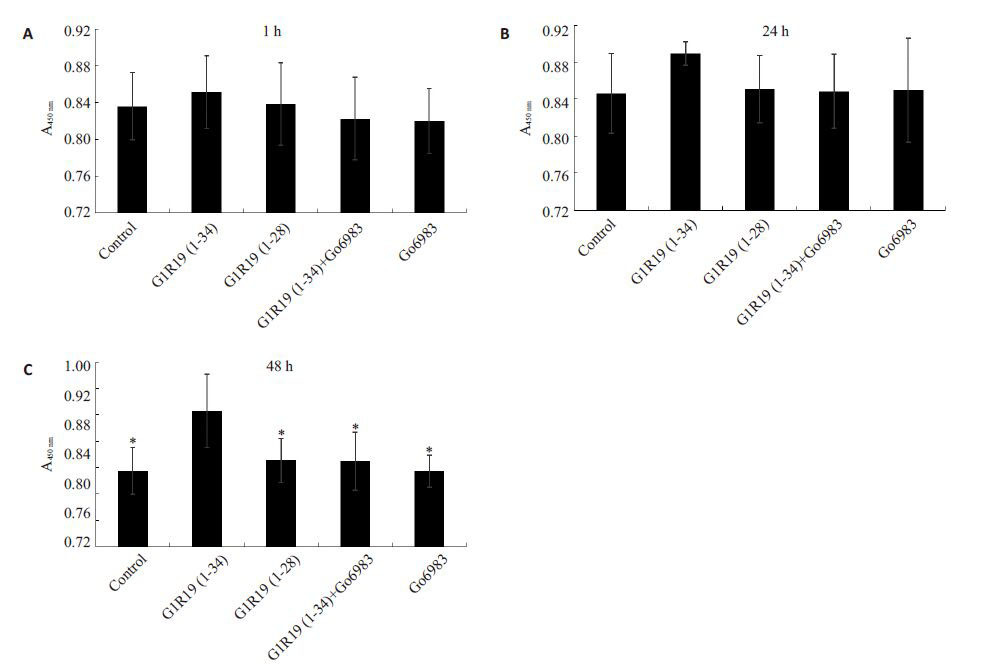
|
图 1 CCK-8检测结果 Fig.1 Results of CCK-8 assay. A, B, C: Drug stimulation for 1, 24 and 48 h, respectively. The results show that at 48 h, compared with G1R19(1-28), G1R19(1-34) significantly promoted proliferation of MC3T3-E1 cells, and its effect was blocked by Go6983. *P <0.05 vs G1R19(1-34) group. |
在刺激结束后,按照CCK-8说明书入CCK-8试剂,在培养箱中培养90 min,应用酶标仪测吸光度(A450值)并记录结果。
1.2.2 凋亡在哺乳类动物细胞的凋亡途径中,caspase 3/7是其主要的组成部分,应用Caspase-Glo® 3/7试剂检测细胞的凋亡。按照Caspase-Glo® 3/7 试剂盒说书,向每个96孔板中各加入100 μL试剂,再加入100 μL的培养基定容至200 μL,22 ℃暗室中培养60 min,然应用酶标仪检测吸光度并记录结果。
1.3 统计学分析所有数据采用SPSS 13.0 统计软件包进行统计分析。数据以均数±标准差表示,组间比较采用单因方差分析,两两比较采用LSD检验;当P <0.05认为差有统计学差异。
2 结果应用G1R19(1-28)、G1R19(1-34)、G1R19(1-34)+Go6983 以及Go6983 和空白对照组分别刺MC3T3-E1细胞1、24、48 h后,检测其凋亡及细胞数的变化。
图 1A和图 1B显示G1R19(1-34)与G1R19(1-34)+Go6983相比,在1 h和24 h具有促进细胞数量增加的势,但结果并没有统计学差异;图 1C 显示,在48 h G1R19(1-34)组与G1R19(1-28)组相比可以明显增细胞的数量(P <0.05),进一步研究发现,在G1R19 (1-34)组添加PKC的抑制剂Go6983后,细胞数量的加效应消失(P <0.05)。
图 2A和图 2B显示G1R19(1-34)与G1R19(1-34)+Go6983相比,在1 h和24 h具有抑制细胞凋亡的作用,但是差异无统计学意义,图 2C 显示,在48 h G1R19 (1-34)组与G1R19(1-28)组相比可以明显抑制细胞亡(P <0.05),给予PKC的抑制剂Go6983后,其抑制亡现象消失(P <0.05)。
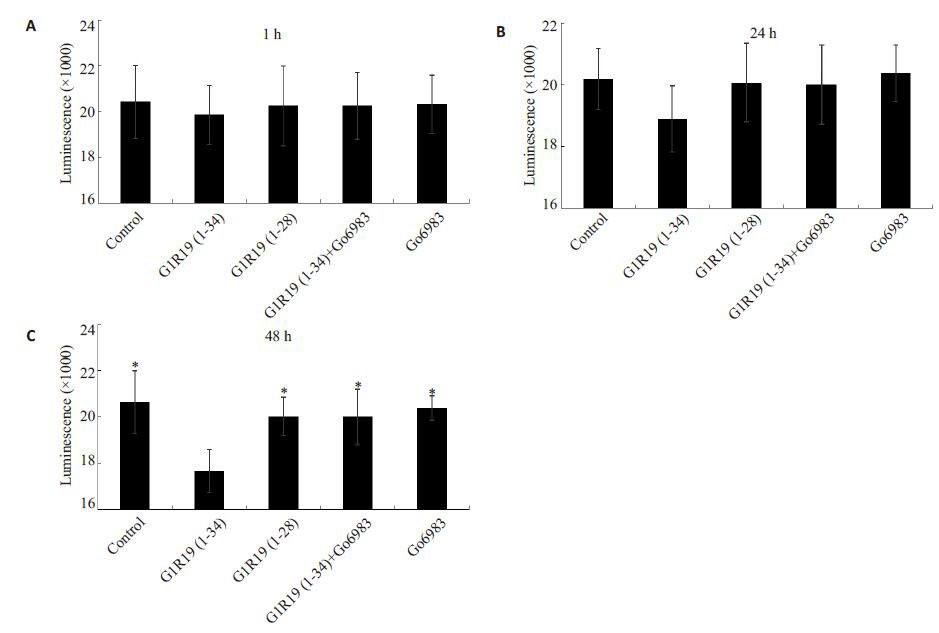
|
图 2 Caspase-Glo® 3/7检测结果 Fig.2 Results of Caspase-Glo® 3/7. A, B, C: Drug stimulation for 1, 24 and 48 h, respectively. At 48 h, compared with G1R19(1-28), G1R19(1-34) inhibited the apoptosis of MC3T3-E1 cells significantly, and its effect was blocked by Go6983. *P <0.05 vs G1R19(1-34) group. |
在本研究当中,我们应用了具有信号选择特性的拟肽G1R19(1-28)、G1R19(1-34)以及PKC的抑制Go6983 来研究PTH 的非PLC/PKC 通路对MC3T3-E1细胞数量及凋亡的影响。目前认为,PTHR1受体至少通过两条途径激活PKC,其一为激活PLC,PLC催化磷脂酰肌醇4,5-二磷酸(PIP2)分子水解成酸肌醇(IP)和二酰基甘油(DAG),引起胞内钙离子的放,进而激活PKC,此途径为PKC激活的经典途径。外一条途径为不依赖PLC的PKC激活途径(nonPLC/PKC),其具体信号特征及骨代谢功能尚未清楚。我的前期研究也揭示,甲状旁腺激素29-34位蛋白结构(PTH(29-34))介导PTH/nonPLC/PKC信号通路的激活[9],PTH经nonPLC/PKC通路,提升松质骨骨量,改善骨梁结构[12, 17]。有nonPLC/PKC 信号途径选择功能PTH模拟肽能显著促进脊柱融合[18]。nonPLC/PKC路的激活能够使得成骨细胞CITED1的表达量显著加,而CITED1 具有调节骨组织代谢的作用[19]。但nonPLC/PKC通路的具体中介分子仍不清楚,其对于代谢的终末效应及作用机制仍需要深入研究。
我们通过应用2种模拟肽G1R19(1-28)和G1R19 (1-34)在48 h的孵育时间内分别刺激MC3T3-E1细1、24、48 h,然后在孵育时间结束后,观察其对于细胞量及凋亡是否具有影响。图 1C显示,在48 h G1R19(1-34)组与G1R19(1-28)组相比可以明显增加细胞数量(P <0.05)。为了研究这种差别是否经过nonPLC/PKC通路引起的,我们在加入G1R19(1-34)前,先加nonPLC/PKC通路抑制剂Go6983,抑制此条通路的活,通过对比G1R19(1-34)组与G1R19(1-34)+Go6983组,发现其促进细胞数量增多的效应消失,说nonPLC/PKC通路在长时间(48 h)刺激细胞的时候有促进细胞数量增多的效应。图 1C中,G1R19(1-34)的细胞数量较空白对照组显著增多,G1R19(1-28)组空白对照组无明显差别,也再次说明了该效应是nonPLC/PKC信号通路引起的。在动物实验中,已验PTH/nonPLC/PKC通路具有促进骨折愈合、促进新形成及提升骨松质骨量的效应[9, 12, 20]。图 2C显示,在48 h G1R19(1-34)组与G1R19(1-28)组相比可以明显抑细胞凋亡(P <0.05),给予PKC抑制剂Go6983后,其制凋亡现象消失(P <0.05),说明nonPLC/PKC通路在时间(48 h)刺激细胞的时候具有抑制细胞凋亡的用。而G1R19(1-34)较空白对照组具有明显抑制细凋亡,G1R19(1-28)组与空白对照组无明显差别,也次表明,该抑制凋亡效应是由nonPLC/PKC通路引的。既往研究表明PTH 通过抑制凋亡调节蛋(CARP)-1的表达从而抑制成骨细胞的凋亡[21];而PTH的PLC/PKC通路具有促进成牙质细胞、牙周韧带细胞、人胚肾细胞等的凋亡[22-23];虽然PTH的总效应是抑制骨细胞凋亡,但是其各信号转导通路对于凋亡的效应各不相同的,Yang等[9]证实了nonPLC/PKC通路具有进成骨细胞分化的作用,这间接表明了nonPLC/PKC路可能抑制成骨细胞的凋亡,本实验凋亡结果与其合。既往研究表明激活PLC/PKC通路相比激活PKA通路需要更多的PTHR的表达[6, 24],而目前对于nonPLC/PKC通路,其介导的分子尚不清楚,结合本次的实验果,我们假设对于激活nonPLC/PKC可能同样需要更的PTHR 的表达,因此在刺激48 h 的时候,G1R19(1-34)组与G1R19(1-34)+Go6983 相比具有明显的进细胞增殖和抑制细胞凋亡的现象。从图 2中,G1R19(1-34)组对比空白对照组具有明显的抑制细胞凋亡作用,其可能是由于G1R19(1-34)缺少PLC/PKC通的作用。在本实验中,我们通过检测CCK-8 及通Caspase-Glo® 3/7 试剂盒检测细胞凋亡,发现在1、24、48 h时,G1R19(1-34)组随着凋亡数量的减少,细胞量逐渐增多的现象。但是既往Yang等[9, 17]提出nonPLC/PKC通路的激活会引起PKC-δ的激活,而在老鼠的类骨细胞系UMR-106-01 中,PKC-δ的激活促进着IGFbinding protein-5 mRNA的表达[25],最后刺激着成骨胞的有丝分裂从而引起细胞的增殖[26]。因此,我们不排除nonPLC/PKC在细胞增殖方面影响着这种细胞数的变化。这需要进一步进行增殖试验及死活细胞染色。
图 1C和图 2C中,G1R19(1-28)组与空白对照组明显差别,这与Guimaraes 等[13]提出的PTH(1-34)cAMP/PKA通路对成牙质骨细胞的增殖与凋亡具有响主要体现在短时间(1 h)的刺激,而长时间对牙质细胞的凋亡与增殖的影响主要是由于PKC通路的激有关。因此,在长时间刺激下(48 h),G1R19(1-28)MC3T3-E1细胞的细胞数量与凋亡无影响。而在短间的刺激下,本实验图 1A和图 2A中,G1R19(1-28)与空白对照组也无明显差别,主要是由于为了便于我讨论nonPLC/PKC通路对细胞数量与凋亡的影响,因降低了其刺激浓度[9]。结合实验结果及既往研究,G1R19(1-34)组细胞数量的增多最主要是由于细胞亡的减少引起的,但是不能排除可能存在促进细胞增的效应。
本研究的研究意义在于对于绝经后老年女性、老男性及由糖皮质激素引起的因骨量减少而导致的骨疏松症患者,该研究结果表明PTH的nonPLC/PKC路可抑制成骨细胞的凋亡从而提高成骨细胞的数量。我们前期研究揭示,PTH经nonPLC/PKC通路具有促新骨形成[9]及促进提升松质骨骨量[12]。因此我们假设实验效应会引起骨量的增加,最终能够治愈或改善骨质疏松症,这对于我们设计和研究新的基于PTH结构效果更好的肽提供了理论支持。
本实验的不足之处在于,细胞数量的变化可能是于增殖及凋亡共同的。因此在长时间(48 h)刺激时,胞数量的增多不能排除是由于nonPLC/PKC通路促细胞的增殖而引起的,这需要我们进行增殖实验及死细胞染色进一步确定。
总之,结果表明PTH 的nonPLC/PKC 通路对MC3T3-E1细胞的增殖和凋亡及细胞数量的影响具时间依赖性。我们的研究首次发现nonPLC/PKC在时间(48 h)刺激后,能够抑制细胞的凋亡及提高细胞数量。这有益于我们加深PTH对于骨代谢影响的解,同时也为我们设计和研究新的基于PTH结构的果更好的成骨药物提供了理论支持。
| [1] | Hodsman AB, Bauer DC, Dempster DW, et al. Parathyroid hormone and teriparatide for the treatment of osteoporosis: a review of the evidence and suggested guidelines for its use[J] . Endocr Rev, 2005, 26(5): 688-703.( 1) 1) |
| [2] | Jilka RL. Molecular and cellular mechanisms of the anabolic effect of intermittent PTH[J] . Bone, 2007, 40(6): 1434-46.( 1) 1) |
| [3] | Drake MT, Srinivasan B, Mödder UI, et al. Effects of intermittent parathyroid hormone treatment on osteoprogenitor cells in postmenopausal women[J] . Bone, 2011, 49(3): 349-55.( 1) 1) |
| [4] | Lombardi G, Di Somma C, Rubino M, et al. The roles of parathyroid hormone in bone remodeling: prospects for novel therapeutics[J] . J Endocrinol Invest, 2011, 34(7 Suppl): 18-22.( 1) 1) |
| [5] | Yu EW, Neer RM, Lee H, et al. Time-dependent changes in skeletal response to teriparatide: escalating vs. constant dose teriparatide (PTH 1-34) in osteoporotic women[J] . Bone, 2011, 48(4): 713-9.( 1) 1) |
| [6] | Datta N. Abou-Samra AB.PTH and PTHrP signaling in osteoblasts [J] . Cell Signal, 2009, 21(8): 1245-54.( 2) 2) |
| [7] | Reeve J, Meunier PJ, Parsons JA, et al. Anabolic effect of human parathyroid hormone fragment on trabecular bone in involutional osteoporosis: a multicentre trial[J] . Br Med J, 1980, 280(6228): 1340-4.( 1) 1) |
| [8] | Valenta A, Roschger P, Fratzl-Zelman N, et al. Combined treatment with PTH (1-34) and OPG increases bone volume and uniformity of mineralization in aged ovariectomized rats[J] . Bone, 2005, 37 (1): 87-95.( 1) 1) |
| [9] | Yang D, Guo J, Divieti P, et al. Parathyroid hormone activates PKC-delta and regulates osteoblastic differentiation via a PLC-independent pathway[J] . Bone, 2006, 38(4): 485-96.( 8) 8) |
| [10] | Bellido T, Ali AA, Plotkin LI, et al. Proteasomal degradation of Runx2 shortens parathyroid hormone-induced anti-apoptotic signaling in osteoblasts. A putative explanation for why intermittent administration is needed for bone anabolism[J] . J Biol Chem, 2003, 278(50): 50259-72.( 1) 1) |
| [11] | Datta NS, Pettway GJ, Chen C, et al. Cyclin D1 as a target for the proliferative effects of PTH and PTHrP in early osteoblastic cells [J] . J Bone Miner Res, 2007, 22(7): 951-64.( 1) 1) |
| [12] | Guo J, Liu M, Yang D, et al. Phospholipase C signaling via the parathyroid hormone (PTH)/PTH-related peptide receptor is essential for normal bone responses to PTH[J] . Endocrinology, 2010, 151(8): 3502-13.( 4) 4) |
| [13] | Guimarães GN, Rodrigues TL, De Souza AP, et al. Parathyroid hormone (1-34) modulates odontoblast proliferation and apoptosis via PKA and PKC-dependent pathways[J] . Calcif Tissue Int, 2014, 95(3): 275-81.( 2) 2) |
| [14] | Whitfield JF, Isaacs RJ, Chakravarthy B, et al. Stimulation of protein kinase C activity in cells expressing human parathyroid hormone receptors by C- and N-terminally truncated fragments of parathyroid hormone 1-34[J] . J Bone Miner Res, 2001, 16(3): 441-7.( 1) 1) |
| [15] | Jouishomme H, Whitfield JF, Chakravarthy B, et al. The protein kinase-C activation domain of the parathyroid hormone [J] . Endocrinology, 1992, 130(1): 53-60.( 1) 1) |
| [16] | Takasu H, Gardella TJ, Luck MD, et al. Amino-terminal modifications of human parathyroid hormone (PTH) selectively alter phospholipase C signaling via the type 1 PTH receptor: implications for design of signal-specific PTH ligands [J] . Biochemistry, 1999, 38(41)2) |
| [17] | 李俊青, 江建明, 冯瑞强, 等. 蛋白激酶C激活的荧光共振能量转移分析[J] . 南方医科大学学报, 2011, 31(11): 1867-70.( 2) 2) |
| [18] | Vilardaga JP, Romero G, Friedman PA. Molecular basis of parathyroid hormone receptor signaling and trafficking: a family B GPCR paradigm[J] . Cell Mol Life Sci, 2011, 68(1): 1-13.( 1) 1) |
| [19] | 郝松, 孟越, 李威, 等. 甲状旁腺素非PLC依赖PKC通路激活增强 成骨细胞CITED1表达[J] . 南方医科大学学报, 2015, 35(4): 486-91.( 1) 1) |
| [20] | 袁亮, 林振, 付兆宗, 等. 信号选择性甲状旁腺素模拟肽促进去势雄 性小鼠的骨折愈合[J]. 南方医科大学学报, 2013, 33(2): 182-7.( 1) 1) |
| [21] | Chukkapalli S, Levi E, Rishi AK, et al. PTHrP attenuates osteoblast cell death and apoptosis induced by a novel class of anti-cancer agents[J] . Endocrine, 2016, 51(3): 534-44.( 1) 1) |
| [22] | Lossdörfer S, Götz W, Rath-Deschner B, et al. Parathyroid hormone (1-34) mediates proliferative and apoptotic signaling in human periodontal ligament cells in vitro via protein kinase C-dependent and protein kinase A-dependent pathways[J] . Cell Tissue Res, 2006, 325(3): 469-79.( 1) 1) |
| [23] | Turner PR, Mefford S, Christakos S, et al. Apoptosis mediated by activation of the G protein-coupled receptor for parathyroid hormone (PTH)/PTH-related protein (PTHrP) [J] . Mol Endocrinol, 2000, 14(2): 241-54.( 1) 1) |
| [24] | Bringhurst FR, Juppner H, Guo J, et al. Cloned, stably expressed parathyroid hormone (PTH)/PTH-related peptide receptors activate multiple messenger signals and biological responses in LLC-PK1 kidney cells[J] . Endocrinology, 1993, 132(5): 2090-8.( 1) 1) |
| [25] | Erclik MS, Mitchell J. The role of protein kinase C-delta in PTH stimulation of IGF-binding protein-5 mRNA in UMR-106-01 cells [J] . Am J Physiol Endocrinol Metab, 2002, 282(3): E534-41.( 1) 1) |
| [26] | Andress DL, Birnbaum RS. Human osteoblast-derived insulin-like growth factor (IGF) binding protein-5 stimulates osteoblast mitogenesis and potentiates IGF action[J] . J Biol Chem, 1992, 267 (31): 22467-72.( 1) 1) |
 2016, Vol. 26
2016, Vol. 26
