胰腺实性假乳头状瘤(Solid pseudopapillary neoplasm of the pancreas,SPN)是一种少见的胰腺囊性 肿瘤,约占胰腺原发性囊性肿瘤的5%左右,好发于年轻 女性,在年龄<40岁的胰腺肿瘤患者中,SPN约占30% 左右[1]。近年来,随着影像学技术的进步,该病的检出率 越来越高。SPN为一种低度恶性肿瘤,部分研究认为肿 瘤直径与肿瘤的生物学行为密切的相关[2-3],肿瘤直径越 大,其恶性程度越高[4-5],研究表明,直径>5 cm是恶性 SPN的重要危险因素[3, 5],但目前相关研究较少,且多集 中在影像学方面的差异,直径对SPN生物学行为及预后 的研究仍较少,本研究对直径≤5 cm与直径>5 cm SPN 进行比较,分析不同直径的SPN一般资料及预后差异,旨在加强对本病的认识。
1 对象和方法 1.1 资料收集解放军总医院2006年8月~2014年12月经术后病理证实为胰腺实性假乳头状瘤患者的临床资料,回 顾性分析患者的一般资料、实验室检查、影像学表现、肿 瘤大小、位置、病理学特征、手术方式及预后。排除标准 为:(1)合并其他恶性疾病的SPN患者;(2)术前即出现 其他部位转移无法切除的SPN患者;(3)胰腺原发肿瘤 未完整切除的SPN患者。参考Kang[3, 5]等研究结果,以 直径5 cm为截点对SPN进行分层。恶性SPN的诊断标 准参照2000年及2010年[1]WHO胰腺肿瘤分类标准,如 SPN合并以下情况则定义为恶性:周围神经侵犯、血管 侵犯、胰周组织侵犯,肿瘤复发或转移的诊断标准为再 次手术病理证实或经影像学证实。
1.2 随访所有患者术后1月常规复查,如病理未见恶性病理 学特征,则每年随访1次,随访3年后如无肿瘤复发或转 移,则改为不定期随访。如病理为恶性SPN则至少0.5 年随访1次,随访3年后如无复发或转移则改为每年随 访1次,随访5年后改为不定期随访。随访内容包括胰 腺功能检查、肿瘤标记物及腹部超声或CT检查。随访 方式包括门诊或电话随访,患者未复诊或因联系方式变 更无法获知患者当前健康状态则定义为失访。随访始 点为患者手术时间,终点为死亡时间或2015年6月。
1.3 统计学方法采用SPSS统计软件19.0 版本对数据进行统计学 分析。计量资料采用均数±标准差表示,组间比较采用t 检验或秩和检验。计数资料的比较采用χ2 检验或 Fisher 精确概率法。以kaplan-Meier 法计算患者总生 存率,并行log rank检验。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料2006年8月~2014年12月经病理证实为胰腺实性 假乳头状瘤并可获得完整病例资料的148例患者纳入 研究,经影像学及术后病理证实,直径≤5 cm 79例,直 径>5 cm 69例。直径≤5 cm组,女性56例,男性23例,平均年龄33.0岁;直径>5 cm组,女性61例,男性8例,平均年龄28.3岁。50.7%(75/148)的患者无明显不适,仅为查体或因其他原因意外发现胰腺占位,73例临床症 状明显者中腹胀、腹部不适27例,腹痛25例,无意中扪 及腹部肿块11例,腰背部疼痛6例,突发性低血糖伴心 悸、出汗、意识障碍2例,血便1例,黄疸1例。 通过对两组患者的一般资料比较,性别、年龄差异 具有统计学意义(P=0.009,P=0.016),直径>5 cm的患 者中女性更为多见(61/8 vs 56/23,P=0.009),发病年龄 更为年轻(28.3±12.3岁vs 33.0±11.4岁,P=0.016,表 1)。
| 表1 直径不同SPN患者临床病理资料比较 Table 1 Comparison of clinical characteristics SPN patients with different tumor size |
实验室检查仅6例患者出现轻度淀粉酶升高,3例 出现胆红素升高,其余患者实验室检查正常。肿瘤标记 物CA19-9升高5例,其中直径≤5 cm 2例,直径>5 cm 3 例,差异无统计学意义(P=0.064)。11 例患者合并 CA-125、CA-724、CA153 升高,其中仅1 例同时合并 CA-199升高。
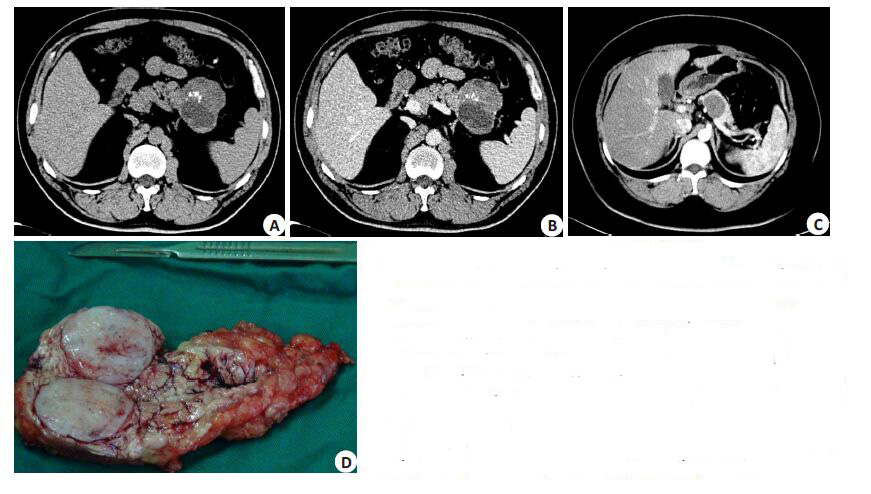
SPN典型影像学表现为胰腺内包膜完整的囊实性 占位,肿瘤可位于胰腺的任何部位,部分肿瘤可见钙化,增强扫描时囊壁或囊内实性部分可见增强,但强度弱于 周围正常胰腺组织(图 1A、B)。根据术前影像学检查,直径<5 cm组肿瘤位于胰腺头颈部(包括勾突部)45例,胰腺体尾部34例,直径>5 cm组肿瘤位于胰腺头颈部37 例,胰腺体尾32例。3例直径>5 cm的患者同时合并肝 转移灶。影像学特征方面,肿瘤的囊内构成在两组中差 异具有统计学意义(P<0.001),直径≤5 cm的肿瘤更易 表现为均一的囊性或实性肿物(图 1C、D),而肿瘤>5 cm 的患者中,肿瘤更易表现为囊实性肿物,两组患者在肿 瘤部位、合并钙化、远端胰管或胆管扩张方面差异无统 计学意义(表 1)。
|
图1 胰腺实性假乳头状瘤CT特征及肿瘤剖面图 A: Unenhanced computed tomography (CT) scan showing a 6 cm x5 cm x5 cm SPN in the body and tail of the pancreas, calcification is seen in the periphery; B: Dynamic contrast-enhanced CT reveals heterogeneous enhancement of the solid lesions, but cystic lesions did not show enhancement; C: Dynamic contrast-enhanced CT reveals homogeneous solid mass measuring 4 cm×4 cm×3 cm in the body of the pancreas (CT value of tumor is 43.2, and CT value of gallbladder is 26.3); D: Gross tumor appearance after distal pancreatectomy, showing homogeneous grey tumor in pancreatic parenchyma. Fig.1 Computed tomographic and macroscopic findings of SPN. |
所有患者均行手术治疗,根据肿瘤大小、肿瘤与主 胰管的关系及肿瘤所在部位不同选择合适的手术方 式。直径≤5 cm的患者手术方式包括肿瘤局部切除13 例,胰十二指肠切除术21例,胰腺中段切除12例,胰体 尾切除术23例,联合脾脏切除的胰体尾切除术10例;其 中微创手术(腹腔镜或机器人辅助)19例,常规手术60 例。直径>5 cm的患者中行肿瘤局部切除11例,胰十二 指肠切除术23例(1例合并门静脉部分切除修补术,1例 合并肝转移瘤切除术),胰腺中段切除4例,胰体尾切除 术21例(1例合并部分横结肠切除术),联合脾脏切除的 胰体尾切除术10例(1例合并肝转移瘤切除,1例合并肝 转移瘤射频消融术);其中微创手术10例,常规手术59 例。两组患者在手术方式及手术类型方面差异无统计 学意义(P=0.902,P=0.144,表 1)。
根据术后病理,肿瘤均得到完整性切除,切缘均为 阴性。直径≤5 cm中恶性SPN 19例,直径>5 cm中恶性 SPN 22例,直径>5 cm中恶性SPN明显高于直径≤5 cm (22/69 vs 19/79),但差异无统计学意义(P=0.288)。恶 性生物学行为方面,仅周围血管侵犯差异具有统计学意 义(P=0.045),直径≤5 cm中未出现周围血管侵犯,而直 径>5 cm中5例出现周围血管侵犯(表 1)。
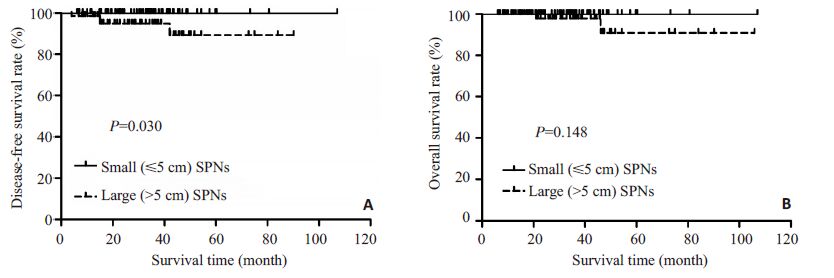
围手术期无患者死亡。4例术后出现复发或转移,其中3例合并肝转移,均为直径>5 cm的患者,术后复发 时间4个月~42个月不等,2例复发或转移患者再次行手 术治疗,其余患者行介入或化疗。1 例患者行胰体尾 SPN切除术,术后7年在胰腺头部再次出现胰腺占位,经术后病理证实为SPN,本例患者术后无瘤时间大于5 年,统计时按新发肿瘤处理。116例患者获得随访,随访 时间6~107月不等,平均随访时间32.6月,至随访结束,共有2例患者死亡,肿瘤直径均>5 cm,1例为25岁女性 患者,术后病理示肿瘤侵犯结肠肝曲肌层,术后21个月 死于多发转移,1例为42岁女性患者,术后病理示肿瘤 侵犯十二指肠壁全层,术后15个月出现肝内多发转移,行介入治疗及化疗,术后45个月出现多发骨转移,术后 46个月死于多器官脏器衰竭。SPN患者总体的1、3、5年 无瘤生存率分别为99.3%,97.7%和94.9%,直径≤5 cm 患者5年无瘤生存率100%,直径>5 cm的患者1、3、5年 无瘤生存率分别为98.6%,94.9%和89.3%,差异具有统 计学意义(P=0.030,图 2A)。SPN患者总体的1、3、5年 生存率为100%,99.1%和95.2%,直径≤5 cm的患者5年 总体生存率为100%,直径>5 cm的患者总体的1、3、5年 生存率为100%,97.9%和90.9%,差异无统计学意义(P= 0.148,图 2B)。
|
图2 直径≤5 cm与直径>5 cm SPN患者的生存曲线对比 A: Kaplan-Meier estimates of disease-free survival in SPNs with different tumor sizes; B: Kaplan-Meier estimates of overall survival in SPNs with different tumor size. Fig.2 Kaplan-Meier survival curves of small (≤5 cm) and large (>5 cm) SPNs. |
近年来,随着对SPN研究增多,对SPN的认识也越 来越深。SPN发病具有明显的性别差异,女性多发,提 示SPN为性激素依赖性肿瘤,但尚无研究证实性激素对 SPN的影响机制[6-7]。越来越多的研究证实,肿瘤直径与 肿瘤生物学行为及预后密切相关,肿瘤直径越大,越易 出现侵袭性或恶性生物学行为,多项研究示恶性SPN直 径常>5 cm[4-5],Kang等[4]多中心大样本的研究证实,直 径>8 cm是SPN切除后复发或转移的独立危险因素。 但目前对于不同直径对SPN的影响研究较少,本研究将 肿瘤直径以5 cm进行分层,旨在加深对SPN的认识,为 临床诊治提供进一步参考。
性别、肿瘤直径可能与肿瘤的影像学特征密切相 关[6, 8-10]。Baek等[8]对直径≤3 cm与直径>3 cm的SPN进 行比较,结果发现:直径>3 cm的SPN影像学表现多为 囊实性肿物,而直径≤3 cm的SPN多为实性肿物。Park 等[10]对男性与女性SPN进行比较,结果发现,男性患者 的肿瘤直径明显大于女性,且影像学表现更易为实性肿 物。本研究中,直径>5 cm的患者中,女性患者更为多 见,更易表现为典型的囊实性肿物,性激素可能与肿瘤 的囊性变密切相关,上述因素的共同作为导致不同直 径的SPN出现影像学的差异。目前对于SPN的诊断 多根据术前影像学检查,术前细针活检虽具有较高的 准确性[11-12],但对于术后胰瘘、出血、针道转移的顾虑,不 推荐为常规术前诊断手段。女性患者更易出现典型的 囊实性SPN表现,因此女性患者根据影像学表现多能得 出正确诊断,而男性患者鉴别较为困难,常需与胰腺癌 或胰腺神经内分泌肿瘤相鉴别。
2000年WHO对将SPN分为两类:交界性(癌前病 变)肿瘤和胰腺实性假乳头状癌(solid pseudopapillary carcinoma of pancreas,SPC),如SPN出现以下情况:周 围神经侵犯、血管侵犯、胰周组织侵犯,则定义为SPC。 在2010年最新的分类中,将所有的胰腺实性假乳头状 瘤均认为低度恶性肿瘤[1],尽管将所有SPN均定义为恶 性肿瘤,但SPN的生物学行为及预后明显区别于胰腺其 他恶性肿瘤,特别是常见的胰腺导管腺癌、胰腺黏液性 肿瘤,且完整切除肿瘤后,术后无需放疗或化疗,因此,部分学者认为,将本类疾病按恶性肿瘤对待,有可能导 致过度治疗[13]。SPN的预后极好,文献中报道其5年生存 率可高达98.3%[5, 14],但仍有少数肿瘤恶性程度较高,术后 肿瘤复发或转移甚至死亡[15-16]。目前对于合并高危因素 或恶性行为的SPN的定义仍存在争议,目前较为公认的 仍为WHO对于恶性SPN的诊断标准,因其更为符合一般恶性肿瘤的生物学特征,此后学者对恶性诊断标准进 一步补充,如:肿瘤转移或复发、明显的细胞异型性、包 膜侵犯、肿瘤侵袭性生长、细胞增殖指数等。我们的研 究中仍采用WHO的定义标准,并对其进一步完善,结 果发现直径≤5 cm 的SPN 其预后优于直径>5 cm 的 SPN,特别是在无瘤生存方面,肿瘤直径越大,其术后复 发或转移的风险越大。对恶性SPN诊断标准的定义有 助于对影响患者预后的相关因素进行研究,合理给予早 期干预,提高患者的预后[17]。
在我们的研究中,恶性SPN在两组中差异无统计 学意义,但直径>5 cm患者更易出现转移或复发。8例 出现远处转移的患者,其中6例为肝转移,术前3例合并 远处转移的患者,均为肝转移,肝脏是远处转移的主要 器官。血行转移可能是远处转移的重要机制,直径>5 cm 组中血管侵犯明显高于直径≤5 cm组,差异具有统计学 意义(P=0.045)。肝脏作为胰腺血流回流的第一站器 官,如肿瘤出现血行播散,可通过肠系膜上静脉-门静脉血 流方向转移至肝。文献中仍有无恶性生物学行为的SPN术后出现转移甚至肿瘤破裂致肿瘤播散的报道[4, 18],远 处转移的发生机制可能更为复杂,尚待进一步研究。
手术切除是目前治疗SPN的主要方法,即使术前 存在远处转移或术后出现转移或复发的患者,如能手术 切除,仍可获得较好的疗效,这可能与肿瘤的恶性程度 较低相关[2, 15, 19-20]。如肿瘤出现多发转移,则常提示预后 较差,在我们的研究中,3例患者出现多发转移,至随访 结束,除1例失访外,其余患者均死亡。本研究中,患者 5年的总体生存率为95.2%,我们认为实际5年生存率低 于此,因为本研究中,仅纳入可行手术切除的患者,因多 发转移无法行手术切除的患者未纳入此,而此类病人预 后多较差。
| [1] | Bosman FC, Hruban RH. WHO classification of tumours of the digestive system[M]. Lyon: IARC, 2010: 230-79. ( 3) 3) |
| [2] | Butte JM, Brennan MF, Gonen M, et al. Solid pseudopapillary tumors of the pancreas. Clinical features, surgical outcomes,and long-term survival in 45 consecutive patients from a single center [J]. J Gastrointest Surg, 2011, 15(2): 350-7. ( 2) 2) |
| [3] | Kang CM, Kim KS, Choi JS, et al. Solid pseudopapillary tumor of the pancreas suggesting malignant potential[J]. Pancreas, 2006, 32 (3): 276-80. ( 3) 3) |
| [4] | Kang CM, Choi SH, Kim SC, et al. Predicting recurrence of pancreatic solid pseudopapillary tumors after surgical resection: a multicenter analysis in Korea[J]. Ann Surg, 2014, 260(2): 348-55. ( 3) 3) |
| [5] | Kim MJ, Choi DW, Choi SH, et al. Surgical treatment of solid pseudopapillary neoplasms of the pancreas and risk factors for malignancy[J]. Br J Surg, 2014, 101(10): 1266-71. ( 4) 4) |
| [6] | 胡曙东, 谌业荣, 王亚非, 等. 男性与女性胰腺实性假乳头状瘤的临床 表现和多层螺旋计算机断层扫描特征比较[J]. 中华消化杂志, 2014, 34(6): 396-9.( 2) 2) |
| [7] | 张云利. 胰腺实性假乳头状瘤诊治研究进展[J]. 中国肿瘤, 2008, 17 (3): 218-20. ( 1) 1) |
| [8] | Baek JH, Lee JM, Kim SH, et al. Small ( 1) 1) |
| [9] | Sur YK, Lee JH, Kim JK, et al. Comparison of Mr imaging features of solid pseudopapillary neoplasm of pancreas between male and female patients[J]. Eur J Radiol, 2015, 84(11): 2065-70. ( 1) 1) |
| [10] | Park MJ, Lee JH, Kim JK, et al. Multidetector CT imaging features of solid pseudopapillary tumours of the pancreas in male patients: distinctive imaging features with female patients[J]. Br J Radiol, 2014, 87(135): 20130513. ( 2) 2) |
| [11] | Khashab MA, Kim K, Lennon AM, et al. Should we do EUS/FNA on patients with pancreatic cysts? the incremental diagnostic yield of EUS over CT/MRI for prediction of cystic neoplasms[J]. Pancreas, 2013, 42(4): 717-21. ( 1) 1) |
| [12] | Okabe Y, Kaji R, Ishida Y, et al. The management of the pancreatic cystic neoplasm: the role of the EUS in Japan[Z], 2011: 39-42. ( 1) 1) |
| [13] | 蒋慧, 郑建明. 2010 版. WHO胰腺肿瘤解读[J]. 中华胰腺病杂志, 2015, 15(2): 133-5.( 1) 1) |
| [14] | Law JK, Ahmed A, Singh VK, et al. A systematic review of solid-pseudopapillary neoplasms: are these rare lesions [J]? Pancreas, 2014, 43(3): 331-7. ( 1) 1) |
| [15] | Yu PF, Hu ZH, Wang XB, et al. Solid pseudopapillary tumor of the pancreas: A review of 553 cases in Chinese literature[J]. World J Gastroenterol, 2010, 16(10): 1209-14. ( 2) 2) |
| [16] | Ji S, Xu J, Zhang B, et al. Management of a malignant case of solid pseudopapillary tumor of pancreas: a case report and literature review[J]. Pancreas, 2012, 41(8): 1336-40. ( 1) 1) |
| [17] | Zhang H, Wang W, Yu S, et al. The prognosis and clinical characteristics of advanced(malignant)solid pseudopapillary neoplasm of the pancreas[Z], 2015. ( 1) 1) |
| [18] | Huang SC, Wu TH, Chen CC, et al. Spontaneous rupture of solid pseudopapillary neoplasm of the pancreas during pregnancy[J]. Obstet Gynecol, 2013, 121(2, 2): 486-8. ( 1) 1) |
| [19] | Papavramidis T, Papavramidis S. Solid pseudopapillary tumors of the pancreas: review of 718 patients reported in English literature [J]. J Am Coll Surg, 2005, 200(6): 965-72. ( 1) 1) |
| [20] | 王效谦, 朱峰, 陈冬, 等. 保留钩突部胰腺次全切除联合脾切除术治 疗胰腺实性假乳头状瘤一例[J]. 中华消化外科杂志, 2014, 13(4): 304-5.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
