2 特诊医疗中心,中山大学附属第三医院 广东广州 510630
3 肾脏内科,中山大学附属第三医院 广东广州 510630
2 VIP Healthcare Center, Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
3 Department of Nephrology, Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
动脉粥样硬化(atherosclerosis,AS)是许多心脑血管疾病的共同发病基础,也是引起心脑血管急性事件的主因[1]。AS的发生机制尚未完全阐明,目前认为其是一种与内皮损伤、自由基损伤、脂质过氧化,以及脂质沉积等相关的血管慢性炎症。AS中的糖脂代谢紊乱可导致非酒精性脂肪性肝病(non-alcoholic fattyliver disease,NAFLD)的发生,成为AS早期事件的标志,而肝脏脂肪变性又可直接促进AS的进展,诱发急性心脑血管事件[2]。研究发现微小RNA(microRNA,miRNA)参与了AS 发生过程中相关基因的调节[3],miRNA是否也在AS小鼠肝脏脂肪变性过程中起到重要作用尚未见报道。 虎杖苷(polydatin,PD)是从中药虎杖的干燥根茎中提取的第4种单体,亦称为白藜芦醇苷。现代药理研究表明,PD不仅对心肌细胞、血管平滑肌细胞、抗血小板聚集、改善微循环等有显著作用,还有保护肝细胞,降低血脂及抗脂质过氧化等作用[4, 5]。PD是否能减轻AS小鼠肝脏脂肪变性尚且未知。课题组前期通过基因测序发现了AS 中大量表达异常的miRNAs,其中miR-214表达显著下调,提示其在AS发病过程中或起到重要作用。本实验以高脂饮食喂养ApoE-/-小鼠建立小鼠AS模型,主要观察PD对AS小鼠肝功能、T-SOD、MDA及miR-214水平的影响,初步揭示PD减轻AS小鼠肝功能损伤的部分机制。
1 材料和方法 1.1 材料 1.1.1 实验动物及饲料40只8周龄SPF级ApoE-/-雄性小鼠购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001;10 只同龄SPF 级C57BL/6J雄性小鼠购于南方医科大学实验动物中心,动物许可证号:SCXK(粵)2011-0015。高脂饲料(0.15%胆固醇+21%猪油+78.85%基础饲料)和普通饲料均由广东省医学实验动物中心提供,许可证号:SCXK(粤)2013-0002。
1.1.2 实验药物及试剂PD(No.S0406A,纯度>98%)购于大连美仑生物技术有限公司,用二甲基亚砜充分溶解配制成实验浓度100倍的药物原液,-20 ℃保存,灌胃前用生理盐水稀释至实验浓度;辛伐他汀片[(No.J20130181)Merck Sharp&Dohme limited(U.K.)]。血清总胆固醇试剂盒(TC,No.006301)、甘油三酯试剂盒(TG,No.006304)、高密度脂蛋白胆固醇(HDL-C,No.006328)试剂盒、低密度脂蛋白胆固醇试剂盒(LDL-C,No.006340)、天冬氨酸氨基酶试剂盒(AST,No.20141218)和丙氨酸氨基转移酶试剂盒(ALT,No.20141217)、总超氧化物歧化酶试剂盒(T-SOD,No.20150120)、丙二醛试剂盒(MDA,No.20150119)均购自南京建成生物工程研究所。RNAiso Plus(批号9109)、Prime ScriptTM RT Reagent Kit(批号RR037A)、SYBR Premix Ex TaqTM(批号RR420A)均购于日本Takara公司。
1.1.3 器材PL303 电子天平(瑞士Mettler Toledo 公司),L420台式低速自动平衡离心机(湘仪离心机仪器有限公司),低温高速离心机(美国Thermo Electron公司)、Legaci超低温冰箱(美国Revco公司),酶标定量测定仪(美国Thermo 公司),Eclipse Ti 荧光倒置显微镜(日本Nikon公司)。
1.2 实验方法 1.2.1 动物分组和给药本实验选用40 只ApoE-/-小鼠(品系C57BL/6J,雄性,清洁级,8周龄),10只同周龄雄性C57BL/6J 小鼠。所有动物适应性喂养1 周,将ApoE-/-小鼠随机分成4组(n=10):模型组(Model)、辛伐他汀组(Simvastatin)、PD低剂量组(PDL)、PD高剂量组(PDH),均给予高脂饲料喂养;另取10只C57BL/6J小鼠为正常对照组(Control),普通饲料喂养。PD腹腔注射剂量分别为50、100 mg·kg-1·d-1,辛伐他汀灌胃剂量为5 mg·kg-1·d-1。
1.2.2 肝脏病理形态学观察将取血后的小鼠断颈处死,小心分离肝脏,在距离肝右叶边缘0.5 cm处,横切一块肝脏组织,放于10%的中性福尔马林中固定,组织脱水,常规石蜡包埋,5 μm连续切片,在60 ℃温箱中烤片1 h;脱蜡水化,HE染色,封片,在光学显微镜下观察拍照。
1.2.3 指标检测小鼠禁食12 h,尾静脉取血测检测空腹血糖后,用10%的戊巴比妥钠腹腔注射麻醉后,然后眼球摘除法获取血液标本,室温下血液自然凝固60 min后,以3000 r/min离心10 min,分离取上清分装,置于-20 ℃保存,依法检测小鼠血脂4项、AST与ALT。同时取肝组织约0.3 g,用冰生理盐水制备肝匀浆,测定肝组织中的T-SOD和MDA。
1.2.4 miR-214检测miR-214引物序列由上海吉诺公司设计,miR-214 引物序列上游为:5'-GCACAGCAGGCACAGACA-3';下游:5'-CAGAGCAGGGTCAGCGGTA-3',产物大小为66 bp。RNA提取:TRIzol法提取肝脏总RNA,琼脂糖凝胶电泳检测总RNA质量及完整性,紫外分光法测定吸光度(A)。cDNA合成:取14 μL模板RNA,2 μL Enzyme mix,5×RT缓冲液4 μL,组成总体积为20 μL 的反应体系,在42 ℃与95 ℃分别反应60 min、5 min。实时定量PCR:总反应体系20 μL,含PCR 反应混合物10 μL、miR-214 引物0.5 μL、cDNA1 μL、20×SYBR 1 μL、H2O 7.5 μL。反应条件:95 ℃10 min,(95 ℃ 10 s、60 ℃ 1 min)共40个循环。结果以每个管内荧光信号到达设定的阈值所经历的循环数C(T)表示,靶基因与内参的相对表达量用2-△△CT表示,实验重复3次,以U6基因为内参照。
1.3 统计学分析本研究数据采用SPSS20.0软件统计并分析,计量数据资料均采用均数±标准差表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果 2.1 虎杖苷对ApoE-/-小鼠肝组织形态的影响肉眼观察肝脏大体性状,正常对照组小鼠肝脏包膜光滑完整,表面呈暗深红色,边缘锐利,切面无油腻感;模型组小鼠肝脏体积明显增大,表面呈黄白色,包膜紧张,边缘厚钝,切面有油腻感。辛伐他汀以及PD组肝脏大体性状介于正常对照组与模型组之间,表面呈黄色,肝脏体积弥漫性增大,切面部分油腻感。
光镜下显示,正常对照组(图 1A)小鼠肝小叶结构清晰,肝索呈放射状排列,细胞间紧密联系;胞核大而圆,核仁明显,胞浆呈均质红染;汇管区小动脉、小静脉及胆管结构正常。模型组(图 1B)小鼠肝小叶结构不清晰,肝索排列紊乱,肝血窦形状改变,肝细胞明显肿胀,胞内可见大小不等脂滴空泡,胞核则被脂肪滴挤得明显偏位。辛伐他汀组(图 1C)小鼠肝小叶结构较清晰,肝细胞脂肪样变减轻,未见肝细胞点状坏死以及炎细胞浸润。PD低剂量组(图 1D)轻度混合性脂肪变性,肝细胞轻度肿胀,肝索排列较整齐,肝血窦清晰。PD高剂量组(图 1E)较模型组有显著的改善,其脂滴明显减少,肝血窦清晰,肝索排列整齐,无明显炎性细胞浸润。
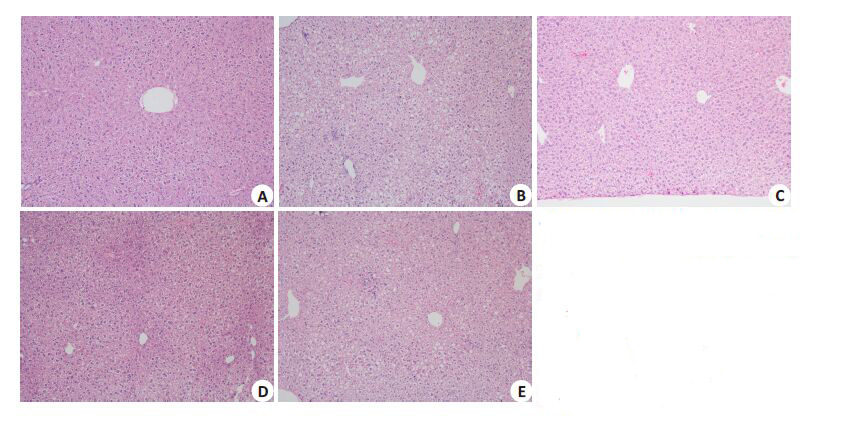
|
图1 虎杖苷对ApoE-/-小鼠肝脏组织形态学的影响 A: Control; B: Model group; C: Simvastatin group; D: Low-dose polydatin group; E: High-dose polydatin group. Fig.1 Effect of polydatin on liver pathologies in ApoE-/- mice (HE staining, original magnification: × 100). |
从表 1可见,与正常对照组相比,模型对照组小鼠血糖升高(P<0.01),血清TC、TG、LDL-C含量显著升高(P<0.01),HDL-C含量显著下降(P<0.01);与模型组相比较,辛伐他汀组和PD组血糖、TC、TG、LDL-C显著降低,而HDL-C升高(P<0.05),说明辛伐他汀和PD均有良好的降血脂作用。
|
|
表 1 PD对小鼠血糖和血脂的影响 Table 1 Effect of polydatin on blood glucose and lipid levels in ApoE-/- mice (Mean±SD, n=10, mmol/L) |
从表 2可见,模型组较正常对照组小鼠血清ALT、AST以及肝匀浆T-SOD、MDA含量差异具有统计学意义(P<0.01);与模型对照组相比,辛伐他汀组、PD低、高剂量组ALT、AST 明显降低,肝脏T-SOD 明显升高,MDA则显著降低(P<0.01),说明PD以及辛伐他汀都具有抗氧化应激的作用。
|
|
表 2 PD对小鼠肝脏T-SOD、MDA及miR-214的影响 Table 2 Effect of polydatin on T-SOD, MDAand miR-214 expressions in the liver (Mean±SD, n=10) |
与正常对照组相比,模型组小鼠miR-214水平显著降低(P<0.01),PD高低剂量及辛伐他汀均能明显增加肝脏miR-214水平(P<0.01),尤其是PD高剂量组升高最明显(表 2)。miR-214 水平的增高同时伴有肝脏T-SOD活性增加,MDA表达下降,进一步证实miR-214的抗氧化作用。
3 讨论AS是严重危害人类健康的一种心脑血管疾病,其发病机制复杂,发生发展都与多种因素有关。目前认为,AS是一种慢性炎症性疾病,主要与动脉壁内皮损伤、自由基损伤、脂质过氧化以及炎症因子关系密切。由于糖脂代谢紊乱,所以AS的病人常伴有肝功能异常,以及以脂肪变性为主的肝损害。AS的中医病因病机是以气虚血瘀和痰瘀互结较为突出的一种本虚标实证,主要与“痰浊”、“血瘀”有着重要的关联[6]。
糖脂代谢紊乱与AS的发生有着密切关系,糖尿病患者往往容易伴发AS,糖代谢紊乱是AS早期的危险因子。有研究表明,高血糖可以通过增加糖基化终末产物,增强氧化应激,激活蛋白酶,而加速AS的进一步发展[7]。所以,控制血糖对防治AS有着重要的临床意义。血脂在中医上即为脂膏,来源于津液,是人体的重要物质。在血脂四项中,TC、TG是被认为是检测高血脂症的特异性敏感性的指标,LDL-C与HDL-C也呈相关性改变。其中HDL-C则被认为是对AS具有保护作用的物质,其促进了胆固醇逆向转运。研究表明,HDL可以激活多种细胞的AMPK信号通路,促进了组织葡萄糖的摄取,从而延缓了高血糖对AS的进展[8]。研究显示,HDL可以通过几种途径来调节体内糖代谢,(1)调节胰岛素分泌;(2)通过腺苷酸活化蛋白激酶磷酸化和活化等非胰岛素依赖途径增加外周组织对糖类的摄取;(3)通过对外周组织的抗炎作用改善外周胰岛素的敏感性;(4)通过HDL直接信号转导通路作用于外周组织以及巨噬细胞,激发胆固醇逆向转运和脂质清除,从而改善炎症和氧化应激,并且降低血糖,而达到抗AS的作用[9]。本实验通过检测空腹血糖,血脂四项来探讨PD对于AS小鼠糖脂代谢紊乱的保护机制,结果表明,PD各组血糖,TC、TG、LDL-C均较模型组低,而保护性的HDL-C则较高,表明了PD能够较好的纠正AS糖脂代谢紊乱,进而延缓AS的进展。但PD调节血脂的作用明显不如辛伐他汀显著。
现代医学研究表明NAFLD是AS的标志,介入了AS的早期发生过程。糖尿病患者继发脂肪肝的平均发生率为50%,远远高于普通人群[10]。AST和ALT是糖和蛋白质相互转化所需要的酶。ALT主要存在肝脏、心脏和骨骼肌中,AST则在心肌细胞中的含量最高,在肝细胞损害时,也同样会使得AST 浓度的升高。AST 与AST能够敏感的反映肝脏损伤与否、其轻重程度以及评判肝损害防治的效果。故本实验通过检测小鼠血浆中的ALT和AST来反映小鼠肝损害的程度以及PD干预后的作用,结果显示,模型组AST和ALT的含量远高于正常对照组,而PD各防治组的ALT和AST指标,均低于模型对照组,且高剂量防治组的效果最好。在病理上,PD干预的肝组织,泡沫细胞都有明显的减少,说明了PD有良好的改善肝功能的作用,并且优于辛伐他汀。
氧化应激现已被普遍认为是AS的一种发病机理。在生理条件下,氧化与抗氧化是处于平衡状态的,一旦平衡被打破,使得活性氧类产生过多或抗氧化能力减弱,而最终导致氧化应激的发生[11]。机体脂质代谢紊乱会产生大量的自由基,可以引发强烈的脂质过氧化作用。氧自由基可以氧化LDL,促进泡沫细胞的形成,也可以破坏血管内皮细胞,导致其功能障碍,致使AS的发生[12]。MDA是氧自由基氧化细胞膜上磷脂形成脂质过氧化物的稳定存在形式,是脂质过氧化代谢的最终毒性产物,所以其含量可以反映机体脂质过氧化的程度,也间接反映了机体清除氧自由基的能力。SOD是体内清除氧自由基的重要的抗氧化酶,主要使O2-歧化为H2和O2,减轻机体脂质过氧化反应[13]。近年来,对于PD抗氧化应激的研究中,PD和白藜芦醇均能显著的降低血清中的MDA,并能够提升T-SOD等抗氧化酶的活性与含量,而尤其在提升T-SOD等抗氧化酶的活性中,PD则有显著的优势[14]。PD能通过降酶以及调节大鼠SOD、MDA、TNF-α等来保护和防治四氯化碳引起的大鼠急性肝损伤[15]。PD 还可通过阻滞MAPK 家族成员对PPARγ的磷酸化作用,来抑制ox-LDL诱导的脂质过氧化,并下调CD36的表达[16]。在脓毒血症中,PD通过抑制ALT、AST 活性以及TNF-α的升高,减少肝组织中COX-2的表达来减轻肝组织的病理损害,从而降低脓毒症小鼠的死亡率[17]。莫志贤等[18]也认为,PD能够在一定的浓度范围内,对过氧化氢引起的小鼠肝损伤具有保护性作用。本实验选取肝匀浆内SOD和MDA含量,来反映AS小鼠的脂质过氧化水平以及抗氧自由基的能力,结果显示PD各组SOD值较模型对照组高,MDA值则有所下降,辛伐他汀组则基本与PD低剂量组持平,说明PD有着良好的抗氧化功效,作用优于辛伐他汀。
miRNA是一类长度为18~24碱基的非编码单链小分子RNA,可调节靶基因mRNA的降解或翻译,参与细胞增殖、分化、凋亡及坏死等过程。研究表明,冠心病患者循环miR-214 的水平较正常人显著降低,提示miR-214很可能是急性心血管事件的一个潜在的生物标记物[19]。miR-214已被证实在多种细胞中具有显著抗氧化应激作用,尤其是心肌细胞和肝细胞中[20, 21],抗氧化损伤可能是miR-214抗AS肝损伤的部分作用机制。本研究发现,与正常对照组相比,模型组miR-214水平显著降低,PD及辛伐他汀干预后肝脏miR-214水平明显升高,进一步调节肝脏SOD及MDA水平,降低小鼠氧化应激水平。miR-214可能是PD减轻AS小鼠肝损伤及抗氧化反应的关键环节。
综上所述,PD对AS小鼠肝损伤具有一定的保护作用,表现在对AS小鼠血糖、血脂及氧化应激反应的调节方面,涉及的机制可能与PD升高肝脏SOD及miR-214水平,降低MDA有关。miR-214可能是PD抗AS小鼠肝损伤的中间靶点,具体的分子机制还有待研究。
| [1] | Fritz J, Edlinger M, Kelleher C, et al. Mediation analysis of the relationship between sex, cardiovascular risk factors and mortality from coronary heart disease: Findings from the population-based VHM&PP cohort [J]. Atherosclerosis, 2015, 243(1): 86-92. ( 1) 1) |
| [2] | Xu ZR, Li JY, Dong XW, et al. Apple polyphenols decrease atherosclerosis and hepatic steatosis in ApoE-/- mice through the ROS/MAPK/NF-κB pathway[J]. Nutrients, 2015, 7(8): 7085-105. ( 1) 1) |
| [3] | Norata GD, Sala F, Catapano AL, et al. MicroRNAs and lipoproteins: a connection beyond atherosclerosis [J]. Atherosclerosis, 2013, 227(2): 209-15. ( 1) 1) |
| [4] | Huang K, Chen C, Hao J, et al. Polydatin promotes Nrf2-ARE anti-oxidative pathway through activating Sirt1 to resist AGEs-induced upregulation of fibronetin and transforming growth factor-β1 in rat glomerular messangial cells [J]. Mol Cell Endocrinol, 2015, 399: 178-89. ( 1) 1) |
| [5] | Du J, Sun LN, Xing WW, et al. Lipid-lowering effects of polydatin from Polygonum cuspidatum in hyperlipidemic hamsters [J]. Phytomedicine, 2009, 16(6/7): 652-8. ( 1) 1) |
| [6] | 孙学刚, 曾平, 范钦, 等. 动脉粥样硬化中医病机的探讨[J]. 江苏中 医药, 2010, 42(2): 7-8. ( 1) 1) |
| [7] | Selvin E, Rawlings AM, Lutsey PL, et al. Fructosamine and glycated albumin and the risk of cardiovascular outcomes and death [J]. Circulation, 2015, 132(4): 269-77. ( 1) 1) |
| [8] | Drew BG, Fidge NH, Gallon-Beaumier G, et al. High-density lipoprotein and apolipoprotein AI increase endothelial NO synthase activity by protein association and multisite phosphorylation[J]. Proc Natl Acad Sci USA, 2004, 101(18): 6999-7004. ( 1) 1) |
| [9] | Du XM, Kim MJ, Hou L, et al. HDL particle size is a critical determinant of ABCA1-mediated macrophage cellular cholesterol export [J]. Circ Res, 2015, 116(7): 1133-42. ( 1) 1) |
| [10] | Kanazawa I, Tanaka K, Sugimoto T. DPP-4 inhibitors improve liver dysfunction in type 2 diabetes mellitus[J]. Med Sci Monit, 2014, 20: 1662-7. ( 1) 1) |
| [11] | 陈宝丽. 高同型半胱氨酸血症导致动脉粥样硬化氧化应激机制的研 究进展[J]. 医学综述, 2014, 20(2): 223-5. ( 1) 1) |
| [12] | Lankin VZ, Lisina MO, Arzamastseva NE, et al. Oxidative stress in atherosclerosis and diabetes[J]. Bull Exp Biol Med, 2005, 140(1): 41-3. ( 1) 1) |
| [13] | 戴海云, 李七一, 严士海. 冠心平对ApoE-/-小鼠动脉粥样硬化氧化与 抗氧化指标的影响[J]. 中成药, 2014, 36(6): 1285-7. ( 1) 1) |
| [14] | Wang HL, Gao JP, Han YL, et al. Comparative studies of polydatin and resveratrol on mutual transformation and antioxidative effect in vivo[J]. Phytomedicine, 2015, 22(5): 553-9. ( 1) 1) |
| [15] | Zhang H, Yu CH, Jiang YP, et al. Protective effects of polydatin from Polygonum cuspidatum against carbon tetrachloride-induced liver injury in mice[J]. PLoS One, 2012, 7(9): e46574. ( 1) 1) |
| [16] | 肖铭甲, 陈卫红, 吴炜, 等. 虎杖苷抑制ox-LDL诱导的脂质过氧化并 下调巨噬细胞清道夫受体CD36表达[J]. 中国病理生理杂志, 2010, 26(7): 1280-4. ( 1) 1) |
| [17] | Li XH, Wu MJ, Zhang LN, et al. Effects of polydatin on ALT, AST, TNF-alpha, and COX-2 in sepsis model mice[J]. Zhongguo Zhong Xi Yi Jie He Za Zhi, 2013, 33(2): 225-8. ( 1) 1) |
| [18] | 莫志贤, 邵红霞. 白藜芦醇苷体外对过氧化氢导致小鼠肝细胞损伤的 保护作用[J]. 中国药理学通报, 2000, 16(5): 519. ( 1) 1) |
| [19] | Lu HQ, Liang C, He ZQ, et al. Circulating miR-214 is associated with the severity of coronary artery disease[J]. J Geriatr Cardiol, 2013, 10(1): 34-8. ( 1) 1) |
| [20] | Wan DY, Zhang Z, Yang HH. Cardioprotective effect of miR-214 in myocardial ischemic postconditioning by down-regulation of hypoxia inducible factor 1, alpha subunit inhibitor[J]. Cell Mol Biol (Noisy-le-grand), 2015, 61(2): 1-6. ( 1) 1) |
| [21] | Dong X, Liu H, Chen F, et al. MiR-214 promotes the alcoholinduced oxidative stress via down-regulation of glutathione reductase and cytochrome P450 oxidoreductase in liver cells[J]. Alcohol Clin Exp Res, 2014, 38(1): 68-77.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36 , 温子云1, 何泽淮1, 李梅2, 尹琼丽2, 石成钢3, 成彩联3
, 温子云1, 何泽淮1, 李梅2, 尹琼丽2, 石成钢3, 成彩联3