帕金森病(Parkinson's disease,PD)是由于中脑黑质致密部(substantia nigra pars compacta,SNc)多巴胺(dopamine,DA)能神经元的变性丢失,导致出现静止性震颤等一系列运动障碍。然而,越来越多的临床资料表明:PD病人往往还伴随非运动症状,如抑郁、焦虑和认知功能减退,甚至这些症状早于运动症状出现[1]。内侧前额叶皮层(medial prefrontal cortex,mPFC)调控许多脑的高级功能,是治疗精神疾病的脑内药物靶点[2]。mPFC内的神经元以谷氨酸为神经递质的兴奋性锥体神经元为主,另有少部分γ-氨基丁酸(γ-aminobutyricacid,GABA)能抑制性中间神经元。mPFC接受来自中脑缝核的5-羟色胺(5-hydroxytryptamine 或serotonin,5-HT)能神经纤维支配,并且表达多种5-HT 受体,如5-HT1A、5-HT2、5-HT3和5-HT7[3]。有文献指出[4],在PD病人和PD模型动物脑内,5-HT1A、5-HT2A和5-HT3亚型在缝核、海马结构和前额叶皮层的表达发生了改变,电生理研究结果发现黑质纹状体通路损毁大鼠mPFC锥体神经元对5-HT1A、5-HT2A/2C和5-HT3受体刺激的反应性发生异常[5-6]。这些结果表明mPFC和5-HT递质系统功能紊乱有可能是PD病程中出现非运动症状的病理生理学基础。
5-HT7受体与多种生物功能有密切关系,如情绪调控、生物节律以及睡眠等,各项实验都显示大鼠的新皮层表达5-HT7受体[7],我们前期的实验表明:5-HT7受体参与了正常大鼠mPFC锥体神经元的电活动[8],然而,到目前为止,并没有在体电生理学研究大鼠单侧黑质-纹状体通路损毁后5-HT7受体功能的变化。因此,本实验采用电生理技术,在体研究6- 羟基多巴胺(6-hydroxydopamine,6-OHDA)单侧损毁SNc 建立的PD模型大鼠mPFC锥体神经元电活动的变化,并观察PD模型大鼠mPFC锥体神经元对5-HT7受体刺激的反应性改变。
1 材料和方法 1.1 材料实验动物:健康雄性Sprague-Dawley大鼠(体质量270~320 g),饲养在适宜环境,随意摄食和饮水,动物使用严格遵守国家实验动物管理和使用的相关规定。实验动物分成两组:正常组(n=69)和PD模型组(n=69)。
药物:地昔帕米、6-OHDA、阿朴吗啡和picrotoxinin均购自Sigma 公司(St.Louis,MO,美国),AS 19 和SB269970 购自Tocris 公司(Ellisville,MO,美国)。6-OHDA和阿朴吗啡溶于含0.02%抗坏血酸的生理盐水,地昔帕米和SB 269970 溶于生理盐水,AS 19 和picrotoxinin分别溶于含1%和5%二甲基亚砜的生理盐水中,所有药物均现配现用。
1.2 方法 1.2.1 PD模型制备采用6-OHDA单侧毁损大鼠中脑SNc的方法制备PD动物模型,方法与前期实验相同[6],简而言之,动物用4%水合氯醛麻醉(400 mg/kg),头部固定于立体定位仪(SN-2N,Narishige,Tokyo,日本),5 min 内将6-OHDA(8 μg/4 μL)注射到SNc(立体定位:AP-5.0-5.3,L1.9-2.1,D7.1-7.3),给药速度为0.5 μL/min。在手术前30 min动物腹腔注射地昔帕米(25 mg/kg)以保护去甲肾上腺素纤维免受6-OHDA损伤。手术两周后,动物皮下注射阿朴吗啡(0.05 mg/kg),每5 min向对侧旋转次数超过20圈者,才被入选下一步实验。
1.2.2 电生理学记录6-OHDA 注射后第3 周,记录mPFC锥体神经元放电,方法同前期实验[8]。mPFC锥体神经元细胞外放电波宽较长(>1 ms),放电形式为不规则放电基础上的爆发式放电。符合以上标准且基础自发放电频率能稳定维持2 min的神经元放电被纳入下一步实验。
1.2.3 给药方式体循环给药及局部给药方式方法同前期实验[8]。简而言之,体循环给药即通过大鼠颈外静脉,每间隔90 s,给予系列剂量的AS 19溶液(40、80、160、320、640 μg/kg),最后给予SB 269970(200 μg/kg),观察神经元放电。部分神经元在系列给药后,用picrotoxinin(2 mg/kg)替代SB 269970;局部给药即采用双管玻璃微电极记录到神经元放电后,用给药电极给予AS 19溶液0.08 μg,然后再给予SB 269970(2 mg/kg),观察神经元放电变化。
1.2.4 组织学和免疫组织化学染色组织学Nissl染色:电生理学记录完毕后,用玻璃微电极电泳滂胺天蓝标记最后1个记录位点(-20 μA,15 min)。大鼠过量麻醉、固定、取脑、冠状切片,Nissl染色以确定记录点位置。酪氨酸羟化酶(tyrosine hydroxylase,TH)免疫组织化学染色:为观察6-OHDA注射后DA能神经元毁损的程度,对SNc/腹侧被盖区(ventral tegmental area,VTA)相应部位的脑片行TH免疫组织化学染色,对损毁侧与未损毁侧TH染色阳性细胞数进行比较。
1.2.5 数据统计和分析在给药前,记录神经元的基础放电5 min。在给药后,单个神经元的放电变化超过基础放电的20%,即认为该神经元的电活动发生了显著改变。大鼠损毁侧与未损毁侧TH免疫阳性神经元数目的比较应用Student's t检验。给药后放电频率的变化采用单因素方差分析(one-way ANOVA)。Post-hoc多重比较采用Dunnett's检验。所有数据均采用均数±标准误或基础放电率的百分比表示。应用SPSS16.0进行统计学分析,认为P<0.05为差异具有统计学意义。
2 结果SNc损毁的PD模型鼠皮下注射阿朴吗啡后向损毁侧的对侧旋转的次数均大于20圈/5 min。所有记录的mPFC的神经元都具有已有文献所描述的锥体神经元的典型电生理特征[9](图1A~C)。正常鼠和PD模型鼠所有电生理记录位点经组织学染色证实均位于mPFC内(图1D)。
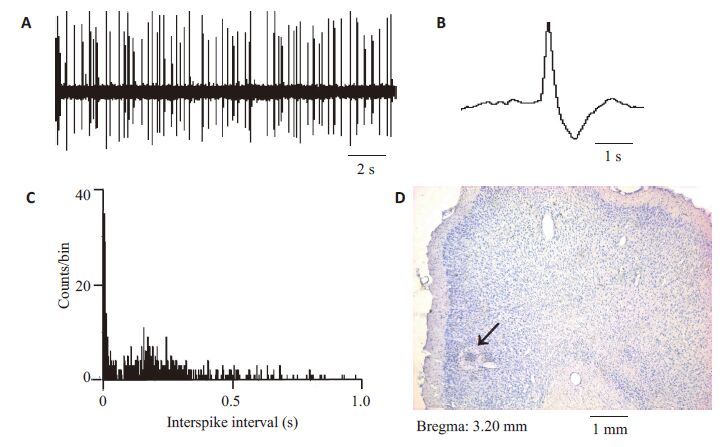
|
图1 大鼠mPFC中的记录位点以及mPFC中锥体神经元的放电特征 Fig.1 Localization of the neurons recorded in the mPFC of rats and spontaneous firing activity ofmPFC pyramidal neurons. A: Extracellular recordings of representative mPFC pyramidal neuronsshowing the spontaneous firing activity; B: Action potential waveform; C: ISIHs showing the firingpatterns of the neurons; D: Photomicrograph of Cresyl Violet staining showing the recording site(arrow) in the mPFC marked with iontophoretically injected Pontamine Sky Blue. |
观察6-OHDA损毁大鼠SNc 和VTA内TH着色神经元数目的改变,结果发现:损毁3周后,损毁侧SNc内的TH 阳性神经元完全消失(图2A~C),而且损毁侧VTA内的TH阳性神经元也减少了(41±2)%(n=12;P<0.001;配对t检验;图2A~C),对比VTA,SNc内的TH阳性神经元减少更为显著。
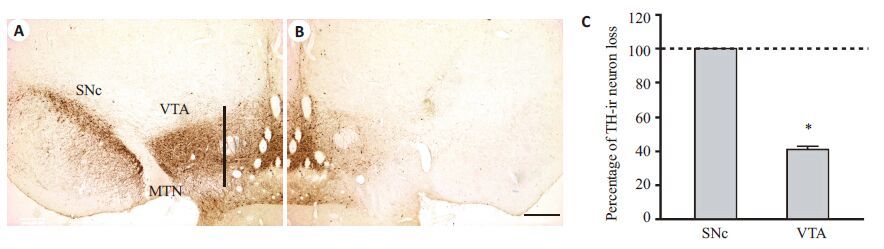
|
图2 SNc和VTA的TH免疫组织化学染色 Fig.2 TH immunohistochemical staining of the SNc and VTA. A, B: Photomicrographs of a representative section showingthe SNc and VTA dopaminergic neurons on the injected side (right) compared to non-injected side (left) in the6-OHDA-lesioned rat. Scale bar=400 μm; C: Histogram showing the percentage of TH-ir neurons loss in the SNc and VTAon the injected side of the lesioned rats (n=12). MTN: Medial terminal nucleus. *P<0.001 vs non-injected side. |
正常鼠锥体神经元的放电频率为1.1±0.1 spikes/s(n=69,图3B),而PD模型大鼠锥体神经元的放电频率明显增加到2.1±0.2 spikes/s(n=69,P<0.001;独立样本t检验;图3B)。
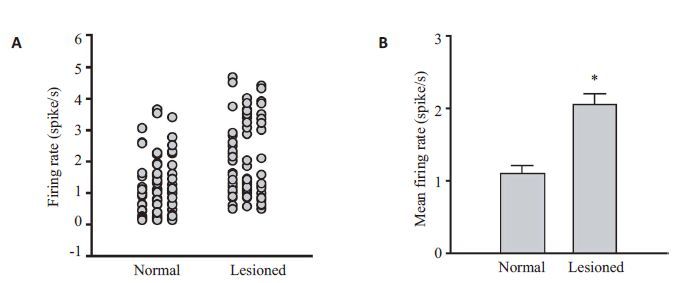
|
图3 大鼠mPFC锥体神经元的放电频率 Fig.3 Firing rate of pyramidal neurons recorded in the mPFC. A: Frequency distribution offiring rates of the neurons in normal (n=69) and 6-OHDA-lesioned (n=69) rats; B: Comparison of the mean firing rate of the neurons. *P<0.001 vs normal rats. |
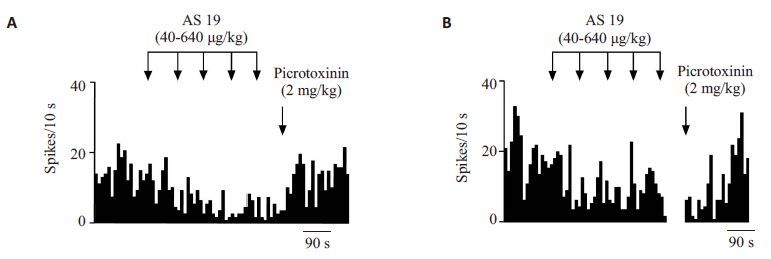
对于正常大鼠,体循环给予公认的5-HT7受体激动剂AS 19可引起锥体神经元电活动产生3种不同的反应。当给予累积剂量达到640 μg/kg的AS 19后,总共记录到得28个神经元当中,有15个(54%)神经元放电频率加快,5个神经元的放电频率降低(18%),还有8个神经元的频率没有发生改变(28%,图4A、B),但是综合考虑所有神经元的效应,发现系列静脉注射AS 19(40~640 μg/kg)引起锥体神经元放电频率剂量依赖性增加(n=28,F5,162=2.71,P<0.05;方差分析,图4E)。当给药剂量达到160 μg/kg时,神经元的兴奋程度已明显高于基础放电,且差别具有统计学意义(n=28,P<0.05;Dunnett's 检验,图4E),累积给药640 μg/kg时,放电频率是基础放电频率的(158±21)%。AS19所引起的兴奋效应能够被200 μg/kg 特异性5-HT7 受体拮抗剂SB269970(200 μg/kg)反转,频率恢复到基础放电频率的(104±15)%(n=15,图4A、B)。此外,AS 19的抑制效应能被GABAA受体拮抗剂picrotoxinin(2 mg/kg)反转,回到基础频率的(87±11)%(n=4,图5A)。
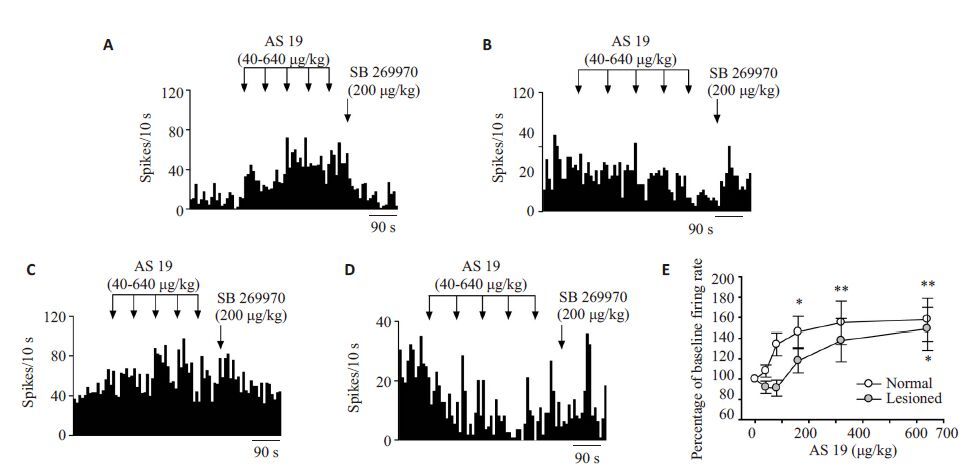
|
图4 大鼠静脉给予累积剂量的AS19对mPFC中锥体神经元的作用 Fig.4 Sytemic administration of AS 19 regulates firing rate of mPFC pyramidal neurons. A,B: Normal rats; C,D: Lesioned rats.Arrows indicate the time of administration of AS 19 or SB 269970; E: Dose-response curves showing the effects of the cumulativedoses of systemically administered AS 19 on the firing rate of the neurons in normal (n=28) and lesioned (n=26) rats. *P<0.05,**P<0.01 vs baseline firing rate. |
|
图5 体循环给予AS 19对mPFC锥体神经元产生的抑制效应可被picrotoxinin反转 Fig.5 Effect of picrotoxinin on AS 19-induced inhibition of mPFC pyramidal neurons. A: Normal rat; B: Lesioned rat. |
同样,体循环给予AS 19也能引起PD模型组大鼠锥体神经元3 种不同的反应。当给药累积剂量达到640 μg/kg时,26个神经元之中有14个兴奋(54%),7个抑制(27%),5个没有变化(19%)(图4C、D),考虑所有神经元的综合效应,相同剂量的AS19同样剂量依赖性地加快锥体神经元的放电频率(n=26,F5,150=3.14,P<0.01,方差分析,图4E)。与正常鼠不同的是,当给药剂量达到640 μg/kg时,模型鼠神经元的兴奋效应才具有统计学意义,此时的放电频率是基础放电频率的149±21%(n=26,P<0.05,Dunnett's t检验,图4E)。静注200 μg/kg 的SB 269970同样可以反转AS 19的效应,频率恢复到基础放电的(110 ± 6)%(n=7,图4C、D)。然而,运用picrotoxinin(2 mg/kg)却不能完全反转AS 19诱导的抑制,只能回到基础放电的69±10%(n=4,图5B)。
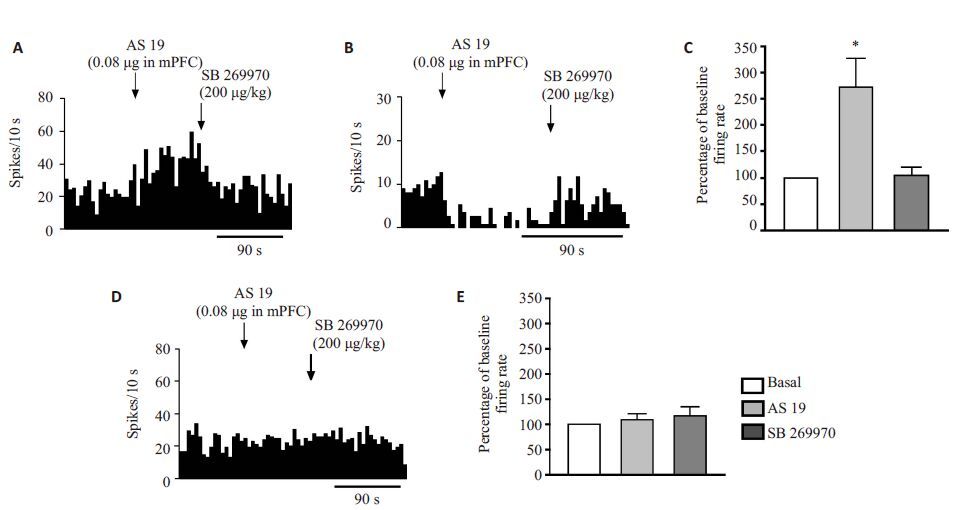
为了进一步验证激活5-HT7受体对mPFC锥体神经元电活动的影响,采用mPFC局部微量给药的方式,首先正常鼠局部微量注射生理盐水观察是否对神经元放电产生影响,结果发现100 nL 生理盐水能轻微降低锥体神经元的放电频率,是基础频率的(95±6)%(n=7,P>0.05,配对t test)。正常鼠局部给予AS 19 后(0.08 μg),18个神经元当中,有14个神经元兴奋,2个抑制,2个没有变化(图6A、B),总体反应是放电频率增加到基础放电的(272±55)%(n=18,P<0.01,配对t test,图6C),静脉注射200 μg/kg 的SB 269970 能够完全反转AS 19的兴奋效应(回到基础放电频率的(105±14)%,n=5,图6A~C)。而PD模型组局部给予相同剂量AS 19后,18个神经元当中只有5个神经元兴奋,5个抑制,8个未发生改变(图6D)。模型组大鼠对局部微量注射AS19 的总体反应是轻微兴奋(频率是基础放电频率的(109±12)%,n=18,P>0.05,配对t test,图6E),静脉注射200 μg/kg的SB 269970对神经元电活动没有影响(频率是基础放电频率的(117±18)%,n=4,图6D、E)。
|
图6 大鼠mPFC内局部注射AS19对锥体神经元的影响 Fig.6 Local administration of AS 19 regulates the firing rate of mPFC pyramidal neurons. A-C: Normal rats; D, E: Lesioned rats. Arrows indicate the time of administration of AS 19 or SB 269970. *P<0.01 vs baseline firing rate. |
本研究结果表明:(1)体循环给予5-HT7受体激动剂AS 19,累积剂量达到160 μg/kg 时,可增加正常鼠mPFC锥体神经元平均放电频率,局部微量注射0.08 μgAS 19也可兴奋锥体神经元;(2)对于PD模型鼠,静脉给药只有累积剂量达到640 μg/kg才能兴奋mPFC锥体神经元,局部给予相同剂量的AS 19并不改变神经元的放电频率;(3)体循环给予GABAA 受体拮抗剂picrotoxinin能完全反转正常鼠AS 19的抑制效应,而模型鼠只能部分反转。
前额叶皮层受大量来自缝核的5-HT能纤维支配,分布有大量5-HT受体,目前发现5-HT受体共有14种亚型,5-HT7受体是5-HT受体大家族成员之一。多项研究表明5-HT7受体不仅在皮层有分布,在海马、丘脑、下丘脑、缝核以及杏仁核等脑区均有分布[10],5-HT7受体被激活后和G蛋白偶联,从而促进cAMP形成,故5-HT7受体激活能引起神经元的兴奋效应[11]。AS 19对5-HT7受体具有高度的亲和力,与5-HT1A受体也能发生一定程度的结合[12]。本研究中,在正常组大鼠,当AS 19累积体循环给药剂量达到640 μg/kg时,有54%的锥体神经元明显兴奋,另有18%的神经元被抑制,28%的神经元无变化,但是综合所有神经元的总体效应却是兴奋的,局部给药可兴奋78%的mPFC锥体神经元,而且5-HT7受体的拮抗剂SB269970能完全反转这种兴奋效应,说明是5-HT7受体介导了AS 19所引起的这种兴奋效应,由此我们认为无论是体循环还是局部给予AS 19引起的mPFC锥体神经元的兴奋效应很可能是因为AS 19直接激活了这些神经元上的5-HT7受体,也就是说表现兴奋效应的锥体神经元上可能表达5-HT7受体。
研究表明:激活5-HT7受体会引起海马脑片CA1及CA3区锥体神经元兴奋,是因为该受体降低了慢后超极化电位,使超极化电位激活的Ih离子流增加[13],另有文献报道[14]5-HT7受体参与调控在体海马CA1及CA3区神经元电活动的易化,并参与去抑制海马切片CA3区癫痫样放电,这些研究结论都为本实验结果提供了有力的证据支持。那么,另有18%的锥体神经元应用相同剂量AS 19后呈现抑制效应,11%的神经元局部给药后放电频率减慢,而且SB 269979同样能反转这种抑制效应,表明这种抑制效应也是由5-HT7受体所介导。但是,这个现象显然与前述的兴奋效应是相矛盾的。实验还观察到,GABAA受体拮抗剂picrotoxinin也能反转AS 19引起的抑制效应,说明GABAA受体与AS 19的抑制效应有关。尽管5-HT7受体在mPFC锥体及中间神经元上的分布还不是十分明了,但体循环和局部给予AS 19产生的抑制效应很可能是因为支配锥体神经元的中间神经元上的5-HT7受体被激活而引起。此外,额叶皮层上有50%~60%的锥体神经元以及20%~30%的中间神经元都有5-HT1A受体表达,该受体能通过G蛋白与钾离子通道偶联,抑制腺苷酸环化酶活性,使膜电位发生超极化,使神经元出现抑制效应[15]。因而由AS 19 引起的mPFC锥体神经元的抑制效应,除GABA中间神经元的作用外,可能有部分原因是因为这些锥体神经元上的5-HT1A受体激活引起的。更重要的一点,5-HT7受体拮抗剂SB 269970不仅能反转兴奋效应,而且也能反转抑制效应,表明这些效应都是由5-HT7受体所介导,因为有文献已经证实SB 269970是5-HT7受体最有效的拮抗剂,它和5-HT7受体的结合能力是它和5-HT1,5-HT2,5HT3,5-HT4,5-HT5及5-HT6等受体结合力的50~100倍[16]。
PD模型大鼠体循环给予同样剂量的AS 19也能使mPFC锥体神经元产生3种不同的反应,54%的神经元兴奋,27%的神经元抑制,19%没有变化,综合评价所有神经元的反应,AS 19仍然是明显增加锥体神经元的放电频率,累积剂量达到640 μg/kg时,锥体神经元的放电频率是基础放电频率的1.46倍。但与正常大鼠相比,产生兴奋效应所需的累积剂量有明显不同,正常大鼠和PD模型大鼠神经元兴奋具有统计学意义所需AS19给药剂量分别为160 μg/kg和640 μg/kg。静脉给药引起PD 模型组大鼠神经元的兴奋和抑制效应都能被SB269970反转,表明这些效应都是由5-HT7受体介导的,而picrotoxinin 只能部分反转AS 19 产生的抑制效应,并且局部应用AS 19并不改变mPFC锥体神经元的放电频率,但是对于正常组大鼠,相同剂量的AS 19能使mPFC锥体神经元的放电频率加快。有研究发现PD病人额叶皮层上谷氨酸羟化酶(1种GABA合成酶)活性大大降低[17]。从当前的研究结果看,我们认为mPFC锥体和中间神经元上5-HT7和GABAA受体的表达下调和/或功能紊乱可能是PD模型大鼠mPFC锥体神经元对AS 19反应性降低的重要原因。
总之,本实验研究结果表明无论是体循环还是局部给予5-HT7受体激动剂AS 19都能引起正常大鼠mPFC锥体神经元呈现兴奋、抑制和不变3种形式的反应,而总体反应是兴奋,而且AS 19 引起的抑制效应能被GABAA 受体拮抗剂picrotoxinin反转。对PD模型大鼠而言,AS 19全身给药也能使mPFC锥体神经元产生3种反应,总体反应是兴奋,但产生兴奋所需的药物累积剂量明显比正常大鼠高,且抑制效应只能被picrotoxinin部分反转,局部应用AS 19不改变PD模型大鼠mPFC锥体神经元的放电。我们的实验结果说明AS 19以不同方式调控着mPFC锥体神经元的电活动,或者通过5-HT7受体直接兴奋锥体神经元,或者通过激活GABA能中间神经元上表达的5-HT7受体间接抑制这些神经元;黑质纹状体通路的退化导致mPFC锥体和中间神经元上5-HT7和GABAA受体出现功能紊乱和/或表达下调。这些结果为已知的5-HT7受体对神经元的作用,以及5-HT7受体参与PD病人的抑郁、焦虑和情绪紊乱等症状,提供了功能学和细胞学解释。
| [1] | Lohle M, Storch A, Reichmann H. Beyond tremor and rigidity: non-motor features of Parkinson's disease[J]. J Neural Transm, 2009,116(11): 1483-92.( 1) 1) |
| [2] | Morici JF, Bekinschtein P, Weisstaub NV. Medial prefrontal cortex role in recognition memory in rodents[J]. Behav Brain Res, 2015, 292: 241-51.( 1) 1) |
| [3] | Leiser, SC. Li, Y. Pehrson, AL, et al. Serotonergic Regulation of Prefrontal Cortical Circuitries Involved in Cognitive Processing: A Review of Individual 5-HT Receptor Mechanisms and Concerted Effects of 5-HT Receptors Exemplified by the Multimodal Antidepressant Vortioxetine[J]. ACS Chem Neurosci, 2015, 6(7): 970-86.( 1) 1) |
| [4] | Huot P, Fox SH. The serotonergic system in motor and non-motor manifestations of Parkinson's disease[J]. Exp Brain Res, 2013, 230 (4): 463-76.( 1) 1) |
| [5] | Zhang QJ, Li LB, Niu XL, et al. The pyramidal neurons in the medial prefrontal cortex show decreased response to 5-hydroxytryptamine-3 receptor stimulation in a rodent model of Parkinson's disease[J]. Brain Res, 2011, 1384: 69-79.( 1) 1) |
| [6] | Wang S, Zhang QJ, Liu J, et al. In vivo effects of activation and blockade of 5-HT(2A/2C) receptors in the firing activity of pyramidal neurons of medial prefrontal cortex in a rodent model of Parkinson's disease[J]. Exp Neurol, 2009, 219(1): 239-48.( 2) 2) |
| [7] | Nikiforuk, A. Targeting the Serotonin 5-HT7 Receptor in the Search for Treatments for CNS Disorders: Rationale and Progress to Date[J]. CNS Drugs, 2015, 29(4): 265-75.( 1) 1) |
| [8] | 范玲玲, 王红伟, 胡志红, 等. 5-羟色胺-7受体激动剂对大鼠内侧前额 叶皮层锥体神经元电活动的影响[J]. 南京医科大学学报, 2013, 33 (7): 953-58.( 3) 3) |
| [9] | Hajos M, Gartside SE, Varga V, et al. In vivo inhibition of neuronal activity in the rat ventromedial prefrontal cortex by midbrain-raphe nuclei: role of 5-HT1A receptors[J]. Neuropharmacology, 2003, 45 (1): 72-81.( 1) 1) |
| [10] | Hauser SR, Hedlund PB, Roberts AJ, et al. The 5-HT7 receptor as a potential target for treating drug and alcohol abuse[J]. Front Neurosci, 2015, 8: 448.( 1) 1) |
| [11] | Tsuji M, Takeuchi T, Miyagawa K, et al. Role of brain 5-HT7 receptors as a functional molecule involved in the development of stress adaptation[J]. Nihon Shinkei Seishin Yakurigaku Zasshi, 2012, 32(4): 187-93.( 1) 1) |
| [12] | Bosker FJ, Folgering JH, Gladkevich AV, et al. Antagonism of 5-HT (1A) receptors uncovers an excitatory effect of SSRIs on 5-HT neuronal activity, an action probably mediated by 5-HT(7) receptors[J]. J Neurochem, 2009, 108(5): 1126-35.( 1) 1) |
| [13] | Tokarski K, Zelek-Molik A, Duszynska B, et al. Acute and repeated treatment with the 5-HT7 receptor antagonist SB 269970 induces functional desensitization of 5-HT7 receptors in rat hippocampus[J]. Pharmacol Rep, 2012, 64(2): 256-65.( 1) 1) |
| [14] | Ohmura Y, Yoshida T, Konno K, et al. Serotonin 5-HT7 receptor in the ventral hippocampus modulates the retrieval of fear memory and stress-induced defecation[J]. Int J Neuropsychopharmacol, 2015, pii: pyv131.( 1) 1) |
| [15] | McCreary AC, Jones CA. Antipsychotic medication: the potential role of 5-HT(1A) receptor agonism[J]. Curr Pharm Des, 2010,16 (5): 516-21.( 1) 1) |
| [16] | Hagan JJ, Price GW, Jeffrey P, et al. Characterization of SB- 269970-A, a selective 5-HT(7) receptor antagonist[J]. Br J Pharmacol, 2000, 130(3): 539-48.( 1) 1) |
| [17] | Lanoue AC, Dumitriu A, Myers RH, et al. Decreased glutamic acid decarboxylase mRNA expression in prefrontal cortex in Parkinson's disease[J]. Exp Neurol, 2010, 226(1): 207-17.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36
