2生物与诊断治疗国家地方联合工程研究中心,陕西 西安 710004
2National Local Joint Engineering Research Center of Biological Diagnosis and Biotherapy, Xi'an 710004, China
细胞周期调控中p16INK4a-CDK4/6-pRb 负反馈通路[1]异常是包括乳腺癌[2]在内的多种肿瘤发生的早期公共分子事件和重要环节[3],而p16(也称多肿瘤抑制基因1,MTS1)[3]和RB基因(RB)[4]的缺失、突变和甲基化等被认为是导致该通路异常的关键因子。而高危型HPV E7 蛋白与RB 蛋白的结合并通过p16INK4a-CDK4/6-pRb 负反馈调节通路引起的p16INK4a蛋白代偿性高表达[6-7]已成为HPV相关宫颈高级别病变及宫颈癌诊断的特异性分子靶标[8-9]。但其能否作为非HPV相关肿瘤的分子靶标尚不明确。因此,该研究拟采用免疫组化技术检测p16INK4a蛋白在浸润性乳腺癌中的表达,分析p16INK4a的表达与乳腺癌相关基因的表达、分子分型及转移能力之间的相关性,为乳腺癌的诊断和机制研究提供新的分子靶标和临床证据。
1 资料和方法 1.1 临床资料收集西安交通大学第二附属医院病理科2014年1月~2015 年7月术前未接受放、化疗的手术切除乳腺癌标本132例,其中男性3例,女性129例,年龄29~90岁,平均52.41岁。按照年龄分组,年轻乳腺癌(≤35岁)15例、老年性乳腺癌(≥65)25例、35-65年龄段92例。所有样本由具有诊断资质的病理医师进行病理诊断,并根据Perou[10]和Sorlie等[11]分子分型方法,按照ER、PR、CK5/6、Her-2、Ki67免疫组化结果分为五型,根据CK5/6的表达将三阴性乳腺癌(TNBC)中的Basal like 型与Normal-like 型予以区别,同时以>10%作为ER、PR和ki-67的阳性判定界值。
1.2 试剂和仪器Anti-p16INK4a(clone 6H12)、ER、PR、Ki67、CK5/6鼠单克隆抗体购自中福州迈新生物技术开发有限公司。Anti-Her-2 单克隆抗体和免疫组化染色试剂盒UltraView Universal DAB Detection Kit(Ventana)购自罗氏诊断产品(上海)有限公司。使用的全自动免疫组化仪器为Ventana Bench Mark XT(瑞士,罗氏)。
1.3 HE染色和免疫组化染色方法所有标本均经4%中性甲醛固定,常规脱水,石蜡包埋,4 μm厚切片,HE染色。免疫组化染色采用VentanaBench Mark XT全自动免疫组化染色仪完成,具体方法参照仪器操作流程:(1)石蜡切片4~5 μm 厚,置于65 ℃烤片机中60 min,粘贴标签后置于机器切片盘上;(2)DAB试剂盒、苏木精、返蓝液、一抗等试剂瓶依次放上检测试剂架前准备运行;(3)染色步骤包括消化、抗体孵育、复染等,约4 h完成;(4)切片用含温和清洁剂的清水冲洗,梯度乙醇脱水、二甲苯透明、中性树脂胶封固;(5)以癌旁组织作为内对照,同时设置阴性对照和阳性对照。
1.4 结果判定ER和PR、CK5/6和Her-2免疫组织化学染色结果分别按照胞核型分子和胞膜型分子判读标准判读,p16INK4a免疫组化染色按照质/核型分子判读标准进行判读[12]:(1)0:无着色;(2)1+:≤10%细胞呈现不同程度的细胞质着色;(3)2+:10%~30%的细胞胞质呈现强的棕褐色着色,或≤70%细胞胞质呈现弱或中等强度质着色;(4)3+:>30%细胞胞质呈强的棕褐色着色,或>70%的胞质呈中等强度着色。评分为“0”者判读为阴性(表达缺失),评分为“1”者判读为弱阳性(正常表达),评分为“2+”和“3+”者判读为阳性(表达上调)。
1.5 统计学分析采用Fisher确切概率法和构成比χ2检验进行分析,P<0.05有统计学意义。
2 结果 2.1 乳腺癌的分子分型根据ER、PR、Ki67、CK5/6的表达,按照Perou[10]和Sorlie等[11]分子分型标准,将所有样本分为5型,其中:Luminal A型58例、Luminal B型32例、Her-2型21例、basal-like(BLBC)型12例、Normal-like型9例(表1)。
| 表1 p16INK4a 蛋白在132例乳腺癌样本中的表达 Tab.1 Expression of p16INK4a protein in 132 breast cancer samples |
p16INK4a蛋白在乳腺癌样本中呈质/核型表达,阳性信号同时定位于癌细胞胞质和细胞核内。在132例乳腺癌组织样本中,p16INK4a 蛋白阴性(0)、弱阳性(1+)、阳性(2+)和强阳性(3+)表达样本分别占总数的5.30%(7/132)、11.36%(15/132)、30.30%(40/132)、53.03%(70/132)。而乳腺癌癌旁乳腺组织多以阴性或弱阳性表达,部分病例包绕癌细胞巢的周围间质细胞可见中等阳性的p16INK4a表达(图1)。
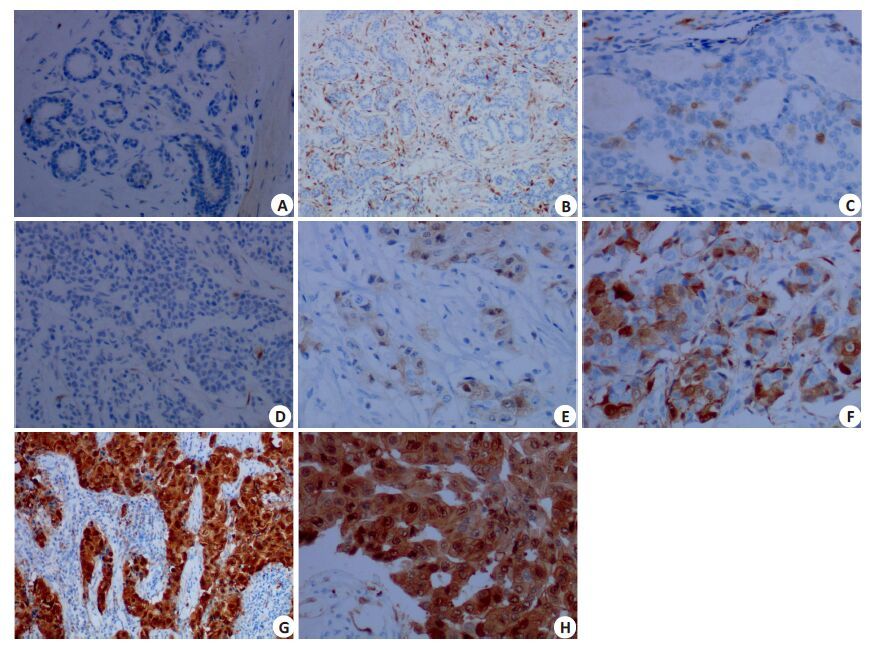
|
图1 p16INK4a在乳腺癌组织中的表达 Fig.1 Expression of p16INK4a in breast cancer tissue detected by immunohistochemistry (Original magnification: A, B, D: ×10; C, E, F, G, H: × 20). A: Negative p16INK4a expression in normal breast tissue; B: p16INK4a expression was negative (0) in mammary gland epithelial tissue but positive (1 + ) in the stromal tissue; C: p16INK4a was weakly positive (1 + ) in ductal hyperplasia epithelial cells; D: Negative p16INK4a expression (0) in invasive breast cancer; E: Weakly positive p16INK4a expression (1 + ) in invasive breast cancer; F: p16INK4a was positive (2 + ) in invasive breast cancer; G, H: Strong positive p16INK4a expression (3+) in invasive breast cancer. |
按照p16INK4a 表达强度,将阴性(0)和弱阳性(1+)病例合并为阴性组(≤1+)、将阳性(2+)和强阳性(3+)病例合并为阳性组(≥2+)后,p16INK4a阴性(≤1+)表达率为16.67%(22/132)、p16INK4a阳性(≥2+)表达率为83.33%(110/132)。按照构成比进行统计分析,发现p16INK4a 蛋白的表达强度除在不同年龄分组中具有统计学差异(P<0.05)之外,与ER、PR、Her-2及分子分型和是否存在转移等因素之间均无统计学差异(P>0.50,表1)。
3 讨论p16基因缺失或/伴CpG岛甲基化导致的p16INK4a失活及RB基因的杂合性缺失导致的p16INK4a-CDK4/6-pRb负反馈调节通路异常被认为是多种肿瘤(包括乳腺癌)发生和演进的重要早期分子事件和重要原因[13-15]。但近来发现除了HPV相关肿瘤,p16INK4a 在多种非HPV相关恶性肿瘤中可出现代偿性高表达。虽然,该研究结果显示浸润性乳腺癌中p16INK4a 蛋白的表达除与年龄分组具有相关性外,与乳腺癌细胞中ER、PR、Her-2的表达及其分子分型、转移能力等因素之间均无相关性。但是,p16INK4a蛋白在浸润性乳腺癌中也同样存在显著的代偿性高表达,其阳性表达率(≥2+)高达83.33%(110/132),而p16INK4a阴性表达(0)和弱阳性表达仅占5.30%(7/132)和11.36%(15/132)。可见,p16INK4A 代偿性高表达也是乳腺癌的重要免疫表型特征,而p16双等位基因缺失或甲基化并不是浸润性乳腺癌细胞周期调控通路异常的主要分子机制。这与此前认为的p16双等位基因缺失或甲基化在乳腺癌细胞周期调控异常中中占主要地位的观点并不一致[16-17]。
如前所述,在细胞周期的p16INK4a-CDK4/6-pRb负反馈调控环路中,p16INK4a 失活会丧失对CDK4/6激酶活性的抑制,使Rb蛋白磷酸化,高磷酸化的pRb随之释放与其结合的E2F,继而活化与S期DNA合成密切相关基因的转录和表达,促使细胞顺利通过G1→S关卡。同样,由于CyclinD1过度表达直接活化CDK4/6激酶也会使细胞通过G1→S关卡。而RB蛋白失活不仅可通过p16INK4a-CDK4/6-pRb负反馈调节通路、还会通过丧失对多梳抑制复合体1(PRC1)的直接招募作用而引起p16INK4a的代偿性高表达[18-19]。
可见,在浸润性乳腺癌中p16INK4a蛋白的缺失和高表达均是肿瘤细胞特征性的免疫表型,反映的是两种不同的细胞周期调控机制:p16INK4a蛋白缺失(“0”)提示p16基因缺失或启动子区的高甲基化是肿瘤细胞周期调控异常的重要机制;而当p16INK4a蛋白代偿性高表达(“2+或3+”)时,提示Rb基因异常可能是肿瘤细胞周期调控异常的重要机制,这也是恶性肿瘤中RB基因与p16INK4a 表达负相关,且在高表达p16INK4a 蛋白的同时维持肿瘤细胞高增值活性的分子机制。甚至,有学者认为p16INK4a 高表达与肿瘤的侵袭性行为和预后不良有关[21-25]。因此,并不能简单地以“上调”或“下调”判读p16INK4a蛋白表达的结果。
显然,作为肿瘤抑制因子和细胞周期负性调控因子,p16INK4a蛋白表达异常是多种肿瘤(包括乳腺癌)细胞周期调控的公共早期分子事件和重要环节,在HPV相关及非HPV相关恶性肿瘤中均具有普遍性。该研究发现,p16INK4a有可能作为乳腺癌诊断的通用性候选分子标志,且采用免疫组化技术检测p16INK4a蛋白的表达,可作为乳腺癌诊断的重要方法,并有可能为乳腺癌的诊断及机制研究提供有价值的信息。此外,有学者尝试采用IHC技术检测p16INK4a 表达诊断黑色素瘤的前哨淋巴结癌转移[26]。而通过检测p16 INK4a蛋白的表达进行高危型HPV相关高级别病变和恶性肿瘤病变(如口腔、肛门及泌尿生殖系统肿瘤)的诊断和鉴别诊断的成果应用,也从另一方面证实了该方法的可行性[27-28]。
总之,p16INK4A代偿性高表达是浸润性乳腺癌中细胞周期调控异常的主要机制,p16INK4A代偿性高表达可作为浸润性乳腺癌的免疫表型特征和癌细胞特异性的分子标志。而且,基于IHC技术的可靠性及普及性,采用免IHC技术检测p16 INK4a 的表达为乳腺癌诊断提供了一种重要方法,也为乳腺癌的机制研究提供有价值的信息。当然,最终确定p16INK4A作为乳腺癌分子靶标的可信性,仍需要采用大样本研究,通过对其特异性、敏感性、阳性预测值、阴性预测值等参数的分析才能最终确定。
| [1] | Semczuk A, Jakowicki JA. Alterations of pRb1-cyclin D1-cdk4/ 6-p16(INK4A) pathway in endometrial carcinogenesis[J]. Cancer Lett, 2004, 203(1): 1-12.( 1) 1) |
| [2] | Howell A, Anderson AS, Clarke RB, et al. Risk determination and prevention of breast cancer[J]. Breast Cancer Res, 2014, 16(5): 446.( 1) 1) |
| [3] | Lapak KM, Burd CE. The molecular balancing act of p16(INK4a) in cancer and aging[J]. Mol Cancer Res, 2014, 12(2): 167-83.( 1) 1) |
| [4] | Witkiewicz AK, Knudsen ES. Retinoblastoma tumor suppressor pathway in breast cancer: prognosis, precision medicine, and therapeutic interventions[J]. Breast Cancer Res, 2014, 16(3): 207.( 1) 1) |
| [5] | Malumbres M. Cyclin-dependent kinases[J]. Genome Biol, 2014, 15(6): 122.( 1) 1) |
| [6] | Schiffman M. Nicolas wentzensen human papillomavirus(HPV) infection and the multi-stage carcinogenesis of cervical cancer[J]. Cancer Epidemiol Biomarkers Prev, 2013, 22(4): 553-60.( 1) 1) |
| [7] | Ivanova TA, Golovina DA, Zavalishina LE, et al. Up-regulation of expression and lack of 5' CpG island hypermethylation of p16 INK4a in HPV-positive cervical carcinomas[J]. BMC Cancer, 2007, 7(5): 47.( 1) 1) |
| [8] | Kisser A, Zechmeister-Koss I. A systematic review of p16/Ki-67 immuno-testing for triage of low grade cervical cytology[J]. BJOG, 2015, 122(1): 64-70.( 1) 1) |
| [9] | Ordi J, Sagasta A, Munmany M, et al. Usefulness of p16/Ki67 immunostaining in the triage of women referred to colposcopy[J]. Cancer Cytopathol, 2014, 122(3): 227-35.( 1) 1) |
| [10] | Perou CM, Sorlie T, Eisen MB, et al. Molecular portraits of human breast tumors[J]. Nature, 2000, 406(6797): 747-52.( 2) 2) |
| [11] | Sorlie T, Tibshirani R, Parker J, et al. Repeated observation of breast tumor subtypes in Independent gene expression data sets[J]. Proc Natl Acad Sci USA, 2003, 100(14): 8418-23.( 2) 2) |
| [12] | 杨军, 康安静, 苏宝山, 等. 免疫组织化学检测结果判读进展[J]. 中华 临床医师杂志: 电子版, 2014, 8(20): 3699-703.( 1) 1) |
| [13] | Lee JJ, Ko E, Cho J, et al. Methylation and immunoexpression of p16(INK4a) tumor suppressor gene in primary breast cancer tissue and their quantitative p16(INK4a) hypermethylation in plasma by Real-Time PCR[J]. Korean J Pathol, 2012, 46(6): 554-61.( 1) 1) |
| [14] | Ertel A, Dean JL, Rui H, et al. RB-pathway disruption in breast cancer: differential association with disease subtypes, diseasespecific prognosis and therapeutic response[J]. Cell Cycle, 2010, 9 (20): 4153-63.( 1) 1) |
| [15] | Witkiewicz AK, Ertel A, Mcfalls J, et al. RB-pathway disruption is associated with improved response to neoadjuvant chemotherapy in breast cancer[J]. Clin Cancer Res, 2012, 18(18): 5110-22.( 1) 1) |
| [16] | Rayess H, Wang MB, Srivatsan ES. Cellular senescence and tumor suppressor gene p16[J]. Int J Cancer, 2012, 130(8): 1715-25.( 1) 1) |
| [17] | Zhou J, Cao J, Lu Z, et al. A 115-bp MethyLight assay for detection of p16 (CDKN2A) methylation as a diagnostic biomarker in human tissues[J]. BMC Med Genet, 2011, 12(8): 67.( 1) 1) |
| [18] | Martin N, Popov N, Aguilo F, et al. Interplay between Homeobox proteins and Polycomb repressive complexes in p16INK4a regulation[J]. EMBO J, 2013, 32(7): 982-95.( 1) 1) |
| [19] | Li JA, Poi MJ, Ming-Daw T. The regulatory mechanisms of tumor suppressor P16INK4A and relevance to cancer[J]. Biochemistry, 2011, 50(25): 5566-82.( 1) 1) |
| [20] | Mills AA. Throwing the cancer Switch: reciprocal roles of polycomb and trithorax proteins[J]. Nat Rev Cancer, 2010, 10(10): 669-82.( 1) 1) |
| [21] | Abou-Bakr AA, Eldweny HI. p16 expression correlates with basallike triple-negative breast carcinoma[J]. Ecancermedicalscience, 2013, 7(6): 317.( 1) 1) |
| [22] | Radisky DC, Santisteban M, Berman HK, et al. p16(INK4a) expression and breast cancer risk in women with atypical hyperplasia[J]. Cancer Prev Res (Phila), 2011, 4(12): 1953-60.( 1) 1) |
| [23] | Bohn OL, Fuertes-Camilo M, Navarro L, et al. p16INK4a expression in basal-like breast carcinoma[J]. Int J Clin Exp Pathol, 2010, 3(6): 600-7.( 1) 1) |
| [24] | Peurala E, Koivunen P, Haapasaari KM, et al. The prognostic significance and value of cyclin D1, CDK4 and p16 in human breast cancer[J]. Breast Cancer Res, 2013, 15(1): R5.( 1) 1) |
| [25] | Shin E, Jung WH, Koo JS. Expression of p16 and pRB in invasive breast cancer[J]. Int J Clin Exp Pathol, 2015, 8(7): 8209-17.( 1) 1) |
| [26] | Fauri J, Ricardi F, Diehl E, et al. P16 protein expression in primary cutaneous melanoma with positive and negative lymph node biopsies: Particular aspects of a study performed at the Hospital de Clinicas de Porto Alegre, Brazil[J]. Can J Plast Surg, 2011, 19(3): 77-81.( 1) 1) |
| [27] | Huang LW, Pan HS, Lin YH, et al. P16 methylation is an early event in cervical carcinogenesis[J]. Int J Gynecol Cancer, 2011, 21 (3): 452-6.( 1) 1) |
| [28] | Gertych A, Joseph AO, Walts AE, et al. Automated detection of dual p16/Ki67 nuclear immunoreactivity in liquid-based Pap tests for improved cervical cancer risk stratification[J]. Ann Biomed Eng, 2012, 40(5): 1192-204.( 1) 1) |
 2016, Vol. 36
2016, Vol. 36