2. 广东省东莞市康华医院,广东 东莞 523000
2. Kanghua Hospital, Dongguan 523000, China
死亡相关蛋白激酶(DAPK)基因在凋亡途径中起重要作用[1],已被证明在多种实体瘤及其细胞系中出现的表达缺失与肿瘤侵袭有关[2-3]。目前研究较多的是DAPK与凋亡的关系[4],但是对白血病细胞生物学行为的影响尚不明确,半胱氨酸天门冬氨酸蛋白酶(caspase)是细胞凋亡的关键分子,尤其是caspase-3是其中的中心环节。一般情况下,caspase-3以无活性的酶原形式存在,活化后可使细胞发生功能障碍,从而导致凋亡不可逆地发生。我们对白血病细胞株DAPK基因的mRNA表达进行了研究,分析其过表达对HL-60细胞凋亡,细胞周期和细胞分化及对caspase-3表达的影响。
1 材料和方法 1.1 主要试剂脂质体LipofectamineTM2000(Invitrogen),pReceiver-M29-DAPK质粒和pReceiver-M29质粒(广州复能公司),鼠抗人DAPK单克隆抗体(Sigma),鼠抗人β-actin单克隆抗体以及兔抗小鼠二抗(北京中杉金桥公司),IMDM培养液和10%胎牛血清(Hyclone),TRIzol试剂和逆转录试剂盒(TaKaRa),Hoechst33342(南京凯基公司),PI染液及瑞氏染液,SYBR greenⅠ荧光定量PCR试剂盒(Invitrogen)。
1.2 方法 1.2.1 细胞培养HL-60、K562、Molt4、U937细胞株(购自中科院上海生物研究所)在含10%胎牛血清IMDM培养液中,于37℃、5% CO2、相对湿度90%的培养箱中培养。实验用细胞均处于对数生长期。
1.2.2 RT-PCR检测DAPK mRNA表达收集各组细胞按TRIzoL试剂说明书提取细胞RNA,逆转录参照逆转录酶说明书。反应引物设计与合成如下,并经GenBank验证。DAPK基因的上游引物序列:5'ATCCTAGACGTGGTCCGGTAT-3'下游引物序列:5'-GTTCTCGCAGCCTGGGTA-3',目的片段大小是402 bp;看家基因GAPDH上游引物序列5'-CGGGAAACTGTGGCGTGAT-3',下游引物序列5'-TGGCAACTGTGAGGAGGG-3'目的片段大小是553 bp。PCR条件:预变性,95℃,5 min;变性,94℃,40 s;复性62℃,30 s;延伸72℃,30 s;循环30次。取6µL产物在2%琼脂糖凝胶电泳,紫外灯下观察,结果以GDS2000凝胶成像分析系统分析,采用quantity-one软件进行半定量分析。
1.2.3 细胞转染(1)将4×106 HL-60细胞接种于6孔板内。每孔1500µL细胞悬液;(2)取Opti-MEMI无血清培养基250µL,稀释pReceiver-M29-DAPK质粒4.0µg,混匀;(3)另取Opti-MEMI无血清培养基250µL,稀释LipofectamineTM 2000 10µL,混匀;(4)将(2)和(3)的两种液体轻轻混合,室温放置20 min。然后加入6孔板内,每孔加500µL。继续培养48 h后收集细胞用于后续试验,空载体pReceiver-M29转染条件同pReceiverM29-DAPK组。并以未转染的HL-60细胞为对照。
1.2.4 Western blotting分析DAPK蛋白的表达提取细胞总蛋白,变性后每孔50µg进行SDS-PAGE电泳,然后电转移至PVDF膜上,用含有5%脱脂牛奶的0.1%TBS-T室温封闭2 h,加一抗4℃孵育过夜,TBS-T洗膜10 min×5次,加HRP连接的兔抗鼠IgG 4℃振摇孵育1 h,TBS-T洗膜10 min×5次,用新鲜配置的DAB显色液显色,成像。
1.2.5 细胞凋亡的观察HL-60细胞经磷酸盐缓冲液重悬,制成细胞涂片,Hoechst33342染片,37℃孵育15 min,蒸馏水洗片,烘干,在倒置荧光显微镜下观察、成像。
1.2.6 细胞周期的观察取1 mL细胞悬液,用75%冰乙醇固定24 h;离心后重悬于1 mL PI染液,加入10μLRNase A(10 mg/mL);4℃避光放置20 min,400目尼龙网过滤;采用流式细胞仪在488 nm激发波长下测DNA含量,结果用MultiCycle软件分析。
1.2.7 实时荧光定量PCR(QRT-PCR)检测转染前后Caspase-3 mRNA的表达通过瑞氏染色法观察HL-60细胞分化后,应用ICycleriQTM荧光实时PCR仪进行PCR反应,同一样本分别进行caspase-3和β2-MG的扩增反应,并设3个复孔及空白对照。Caspase-3上游引物序列:5'-AGAACTGGACTGTGGCATTGAG-3',下游引物序列:5'-GCTTGTCGGCATACTGTTTCAG-3',目的片段大小191bp;内参基因β2-MG上游引物序列:5'-ACCCCCACTGAAAAAGATGA-3',下游引物序列:5'-CATCTTCAAACCTCCATGATG-3',目的片段大小124bp。反应条件:预变性,95℃3min;变性,95℃30s;退火,58℃30s;延伸,72℃40s;循环30个,扩增结束后自动分析融解曲线。读取caspase-3和β2-MG的ct值,用公式2-△Ct计算目的基因caspase-3的相对表达量,△Ct值=目的基因Ct值-内参基因Ct值。
1.3 统计学分析采用SPSS17.0统计软件分析。两样本均数的比较采用Independent-Samples t Test。多组间均数比较采用One-way ANOVA,Post Hoctest方差齐性采用LSD法。P < 0.05为差异有统计学意义。
2 结果 2.1 白血病细胞株DAPK mRNA的表达RT-PCR结果显示DAPK基因在K562、Molt4、U937细胞中表达阳性,而在HL-60细胞则表达阴性(图 1)。
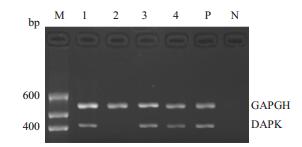
|
图 1 白血病细胞株DAPK mRNA的表达 Figure 1 RT-PCR analysis the DAPK gene mRNA expression in lekumia cells. |
选择HL-60细胞进行pReceiver-M29-DAPK质粒转染,Western blotting分析显示,DAPK蛋白在转染pReceiver-M29-DAPK的HL-60细胞中表达(图 2)。
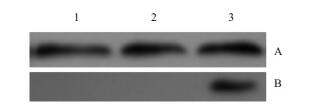
|
图 2 DAPK在HL-60细胞中的表达 Figure 2 Western blotting of the expression of DAPK in HL-60 cells after pReceiver-M29-DAPK transfection for 48 h. |
pReceiver-M29-DAPK转染HL-60细胞48 h后,用Hoechst33342染色发现细胞出现体积变小、核固缩、核裂解、形状不规则,荧光强度增强,核染色质连集于核膜处,呈囊月状或环状等典型凋亡特征。而正常活细胞表现为为胞核呈圆形或椭圆形,体积较大,形状完整,染色均匀。pReceiver-M29-DAPK/ HL-60组凋亡细胞百分率[(9.283±0.701)%]明显高于未转染组[(3.367±0.473)%]和pReceiver-M29/HL-60组[(4.417±0.929)%,P < 0.05]。而未转染组和pReceiver-M29/HL-60组比较无统计学意义(P>0.05,图 3)。

|
图 3 HL-60细胞凋亡的荧光染色结果 Figure 3 Hoechst33342 staining for detecting apoptosis of HL-60 cells transfected with pReceiver-M29-DAPK at 48 h(Hoechst33342, Original magnification:×400). |
PI单染流式细胞术分析pReceiver-M29-DAPK转染HL-60细胞前后周期的改变,结果表明在转染后24 h,48 h,72 h,pReceiver-M29-DAPK/HL-60转染组的G0/G1期,S期,G2/M期细胞与pReceiver-M29/HL-60和对照HL-60比较,经One-way ANOVA统计均无差异(P均>0.05)。
2.5 pReceiver-M29-DAPK转染HL-60细胞前后形态学改变用瑞氏染色法观察pReceiver-M29-DAPK转染HL-60细胞前后形态学改变(图 4),结果显示在转染后24、48、72 h,pReceiver-M29-DAPK/HL-60细胞与pReceiver-M29/HL-60和对照HL-60形态上无改变,细胞常呈椭圆形或圆形,核大而圆,偏于一侧,染色质粗细不等,胞浆丰富,无明显向成熟细胞分化现象。
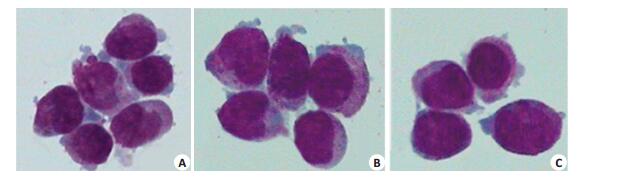
|
图 4 细胞涂片观察pReceiver-M29-DAPK转染后的细胞形态 Figure 4 Morphology of cells transfected with pReceiver-M29-DAPK at 48 h (Wright staining, original magnification:×100). |
经One-way ANOVA和LSD法多重比较,pReceiver-M29-DAPK转染组的caspase-3的表达水平较空载体pReceiver-M29转染组及对照组显著增高(P均< 0.05,表 1)。
| 表 1 各组HL-60细胞QRT-PCR测得caspase-3的表达水平 Table 1 Expression level of caspase-3 transcript (Mean土SD, n=3) |
肿瘤患者的分子流行病学调查,以及肿瘤细胞株的实验研究中均发现,在大部分恶性肿瘤中DAPK基因的表达水平低或不表达。Kissil等[5]研究了人类肿瘤细胞株,发现10种B细胞株衍生的肿瘤中有8种、14种膀胱癌中有6种、5种肾细胞癌有3种、10种肺癌中有4种的DAPK mRNA和蛋白表达都低于检测水平的下限。我们的研究证实DAPK mRNA在不同细胞类型白血病细胞株中表达情况是不相同的。K562、Molt4、U937细胞株DAPK mRNA表达阳性,而HL-60细胞则DAPK表达阴性。这与Wang[6]及MJ[7]的结果类似,提示肿瘤细胞DAPK基因失表达可能抑制细胞凋亡,促进肿瘤转移和生长。
在本研究中,应用DAPK基因真核表达载体,对HL-60细胞株进行瞬时转染后发现,Western blotting检测在160 000出现显色条带,证明DAPK基因成功地导入HL-60细胞,用Hoechst33342染色观察到转染DAPK组细胞呈典型凋亡状,凋亡细胞率也低于DAPK组。用PI法分析细胞周期时,各时期细胞无明显的变化,说明转染DAPK对HL-60细胞周期影响不明显。瑞氏染色观察细胞形态,在DAPK转染前后无明显向成熟细胞分化的现象,说明DAPK基因对细胞分化的影响不明显。Raveh等[8]曾将带有绿色荧光蛋白基因的DAPK基因导入大鼠胚胎肺细胞,发现转染48 h后细胞发生了凋亡,但细胞周期没有发生明显的变化。这与我们和Rohrs[9]的结果类似。有报道DAPK转染的肿瘤细胞的凋亡指数,比DAPK表达阴性的肿瘤细胞要高;DAPK转染表达后,可使肿瘤细胞重新获得对凋亡因素诱导的敏感性,促使细胞凋亡[4, 10]。
Bai等[11]应用脂质体转染的方法pc-DNA3.1-DAPK1转染腺癌细胞系,观察到细胞凋亡,同时caspase-3和caspase-8基因表达上调,caspase-9基因表达无明显变化,但不影响细胞周期和线粒体膜电位,过表达的DAPK诱导腺癌细胞凋亡与caspase-3和caspase-8途径有关。本实验也观察到DAPK基因转染HL-60细胞48 h后,HL-60细胞出现了凋亡,转染DAPK组的细胞的caspase-3 mRNA表达水平均较转染空载体组明显增高。说明caspase-3可能参与了DAPK诱导HL-60细胞凋亡的调控。我们的结果与Bai[11]及Rennier[12]一致。
总之,DAPK基因在急性髓系白血病HL-60细胞株中过表达表现为促进细胞凋亡,不影响细胞周期和细胞分化,caspase-3可能参与了凋亡调控,但是其引起凋亡的具体机制以及其它确切的功能尚不清楚,有待于进一步研究证实。
| [1] |
Katzenellenbogen RA, Baylin SB, Herman JG. Hypermethylation of the DAP-kinase CpG island is a common alteration in B-cell malignancies[J].
Blood,1999, 93 (12) : 4347-53.
( 0) 0)
|
| [2] |
Van der Auwera I, Bovie C, Svensson C, et al. Quantitative methylation profiling in tumor and matched morphologically normal tissues from breast cancer patients[J].
BMC Cancer,2010, 10 (4) : 97-9.
( 0) 0)
|
| [3] |
Qu Y, Danq S, Hou P, et al. Gene methylation in gastric cancer[J].
Clin Chim Acta,2013, 424 : 53-65.
DOI: 10.1016/j.cca.2013.05.002. ( 0) 0)
|
| [4] |
Shiloh R, Bialik S, Kimchi A. The DAPK family: a structurefunction analysis[J].
Apoptosis,2014, 19 (2) : 286-97.
DOI: 10.1007/s10495-013-0924-5. ( 0) 0)
|
| [5] |
Kissil JL, Feinstein E, Cohen O, et al. DAP-kinase loss of expression in various carcinoma and B-cell lymphoma cell lines: possible implications for role as tumor suppressor gene[J].
Oncogene,1997, 15 (4) : 403-7.
DOI: 10.1038/sj.onc.1201172. ( 0) 0)
|
| [6] |
Wang CY, Liu WJ. Effect of 5-aza-2'-deoxycytidine on DAPK gene expression in human HL-60 cells[J].
Zhongguo Shi Yan Xue Ye Xue Za Zhi,2014, 22 (3) : 717-22.
( 0) 0)
|
| [7] |
Pineda de las Infantas MJ, Torres-Rusillo S, Unciti-Broceta JD, et al. Synthesis of 6, 8, 9 poly-substituted purine analogue libraries as pro-apoptotic inducers of human leukemiclymphocytes and DAPK-1 inhibitors[J].
Org Biomol Chem,2015, 13 (18) : 5224-34.
DOI: 10.1039/C5OB00230C. ( 0) 0)
|
| [8] |
Raveh T, Droguett G, Horwitz MS, et al. DAP kinase activates a p19ARF/p53-mediated apoptotic checkpoint to suppress oncogenic transformation[J].
Nat Cell Biol,2001, 3 (1) : 1-7.
DOI: 10.1038/35050500. ( 0) 0)
|
| [9] |
R?hrs S, Romani J, Zaborski M, et al. Hypermethylation of Death-Associated protein kinase 1 differentiates natural killer cell lines from cell lines derived from t-acute lymphoblastic leukemia[J].
Leukemia,2009, 23 (6) : 1174-6.
DOI: 10.1038/leu.2009.5. ( 0) 0)
|
| [10] |
Michie AM, Mccaig AM, Nakagawa R, et al. Death-associated protein kinase (DAPK) and signal transduction: regulation in Cancer[J].
FEBS J,2010, 277 (1) : 74-80.
DOI: 10.1111/j.1742-4658.2009.07414.x. ( 0) 0)
|
| [11] |
Bai T, Tanaka T, Yukawa K. Targeted knockdown of deathassociated protein kinase expression induces TRAIL-mediated apoptosis in human endometrial adenocarcinoma cells[J].
Int J Oncol,2010, 37 (1) : 203-10.
( 0) 0)
|
| [12] |
Rennier K, Ji JY. Shear stress attenuates apoptosis due to TNFα, oxidative stress, and serum depletion via death-associated protein kinase (DAPK) expression[J].
BMC Res Notes,2015, 8 (2) : 85-8.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36