2. 南方医科大学珠江医院口腔科,广东 广州 510280
2. Department of Stomatology, Zhujiang Hospital, Southern Medical University, Guangzhou 510280, China
锌是人体必需的微量元素,含量少但功能非常重要,而锌过量可引起急性肠炎、肾损害、记忆减退等[1]。因此,生活污水中的锌污染必须得到治理。羟基磷灰石(hydroxyapatite, HA)的化学组成与人体骨和牙齿的主要组成基本相似,因其特殊的晶体结构,对铅、锌、镉等多种重金属离子有较好的吸附能力,可用于环保型功效牙膏的研制和生产当中。研究表明,将HA掺入牙膏中,具有缓解牙本质敏感、早期釉质龋再矿化、美白牙齿等功效[2-4]。刷牙后的牙膏废液流入下水道,又可发挥HA吸附生活废水中重金属离子的作用,从而为人们的日常保健行为赋予了环保意义。已有研究表明掺HA牙膏对模拟废液中六价铬离子具有较好的吸附效果[2]。
材料颗粒形貌对HA吸附重金属离子的影响研究还不多[5],值得注意的是,最近一项研究[6]比较了粒径27~30 nm的球形颗粒纳米HA(nano HA, n-HA)和长80 nm、宽30 nm的短棒状n-HA对铅离子的吸附效能差异,结果发现,可能由于存在不同的吸附机制,短棒状颗粒的n-HA相对于球形颗粒n-HA具有更强的铅离子吸附性能。不同粒径、形貌的HA对锌离子的吸附效能影响,目前国内外还未见报道。本研究旨在考察HA的粒径、形貌对其吸附锌离子的影响,以确定HA应用于牙膏的合适粒径,为构建环保型功效牙膏理论奠定基础。实验中锌离子浓度采用10 mg/L(2倍于国家Ⅲ类污水排放标准,在常温常压和中性pH条件下比较不同粒径、形貌的HA及其牙膏对锌离子的吸附率和吸附能力。
1 材料和方法 1.1 仪器与试剂PridigyXP电感耦合等离子发射光谱仪(Leeman公司,美国);cd-63450恒温干燥箱(Heraeus公司,德国);Multifuge X1R离心机(Thermo Scientific Heraeus公司,德国);Quanta 400 FEG场发射扫描电子显微镜(飞利浦FEI公司,荷兰);Tecnai G2 F30场发射透射电子显微镜(FEI公司,美国);双向磁力搅拌器(IKA公司,德国);带能谱S-3700N场发射扫描电子显微镜(Hitachi公司,日本)。
HA(20 nm、30 nm、60 nm、12μm)(北京高德威金属科技开发有限责任公司);六水硝酸锌(分析纯,广州化学试剂厂);普通碳酸钙牙膏(佛山市口腔护理用品工程技术中心提供)。
1.2 方法 1.2.1 样品的表征采用扫描电子显微镜(SEM)和透射电子显微镜(TEM)对HA的粒度、形貌及分散性进行检测。
1.2.2 锌离子溶液的配置电子天平准确称取六水硝酸锌4.577 g,去离子水溶解后,移入100 mL容量瓶中,加去离子水稀释至标线,摇匀。此溶液含锌为10 g/L。吸取1.0 mL锌离子液(10 g/L)置1.0 L容量瓶中,加去离子水至标线,配制成浓度为10 mg/L的锌离子储备溶液。
1.2.3 HA及掺入HA牙膏悬液的配制本实验分9组:20 nm HA组,30 nm HA组,60 nm HA组,12μm HA组,掺入粒径为20 nm、30 nm、60 nm和12μm(ρ(HA)=3%)的HA牙膏组,空白对照牙膏组(普通碳酸钙牙膏)。HA悬液的配制:准确称取粒径为20 nm、30 nm、60 nm和12μm的HA各0.075 g分别置于100 mL烧杯中,用50 mL移液管取双重蒸馏水至标线并倒入烧杯中,超声振荡3次,每次30 s,然后放置磁力搅拌器搅拌,直到形成均匀的悬浊液。实验在持续搅拌的条件下进行,即1.5 g/L的4种粒径的HA悬液。用双重蒸馏水稀释成浓度分别为0.15、0.3、0.45、0.6、0.75、0.9、1.05、1.2 g/L的HA悬液。掺HA牙膏悬液的配制:先准确称取以上四种粒径的HA各0.075 g分别置于烧杯中,再分别称取2.5 g牙膏置于上述4个烧杯中及1个空烧杯中,采用上述同样的方法配制成浓度分别为5、10、15、20、25、30、35、40 g/L的牙膏悬液,此时,含HA的浓度同纯HA悬液的浓度。
1.2.4 锌离子吸附实验取体积为50 mL、初始浓度为10 mg/L的锌离子溶液8份为1组,共9组,每组分别加入1 mL以上系列浓度的纯HA悬液以及HA牙膏悬液。于室温下([25±2)℃],用摇床搅拌3 h(300 r/min),静置24 h。将溶液置于离心机离心(转速3000 r/min,时间10 min,温度25℃)过滤,取滤液15 mL,ICP测定残余重金属离子浓度,计算吸附率,比较不同浓度、不同粒径、形貌的HA及其牙膏吸附锌离子能力的影响。
HA或牙膏对水溶液中重金属离子的去除率计算公式:
| $ P=\left({1-\frac{{{C_1}{V_1}}}{{{C_0}{C_0}}}} \right) \times 100\% $ | (1) |
式中,P为去除率(%),Ct为水样中重离子浓度(mg/L),Vt为反应体系的体积(mL),V0为未反应前重离子溶液的体积(mL),C0为重金属离子溶液的初始浓度(mg/L)。
HA或牙膏对水溶液中重金属离子的吸附能力计算公式:
| $ q=\frac{{{C_0}{V_0}-{C_t}{V_t}}}{m} $ | (2) |
式中,q为吸附能力(mg/g),Ct为重金属离子溶液浓度(mg/L),Vt为反应体系的体积(L),V0为反应前重金属离子溶液的体积(L),C0为重金属离子溶液的初始浓度(mg/L),m为HA或牙膏的质量(g)。
1.2.5 反应沉淀物测定将离心后的反应残留物于恒温干燥箱(120℃)内烘干至粉末状,EDS检测其元素组成。
1.2.6 吸附等温线常使用Langmuir和Freundlish方程来描述吸附平衡,,可用于研究吸附物与被吸附物之间的相互作用。
| $ {\rm{Langmuir等温式:}}\frac{1}{q}=\frac{1}{{{q_{\max }}b}} \cdot \frac{1}{{Ce}} + \frac{1}{{{q_{\max }}}} $ | (3) |
式中,qmax为单分子层饱和吸附量,mg/g;b为Langmuir常数,1/mg。
| $ {\rm{Freundlish等温式:log}}\; q=\frac{1}{n}\log Ce + \lg K $ | (4) |
式中,1/n、K为Freundlish常数。
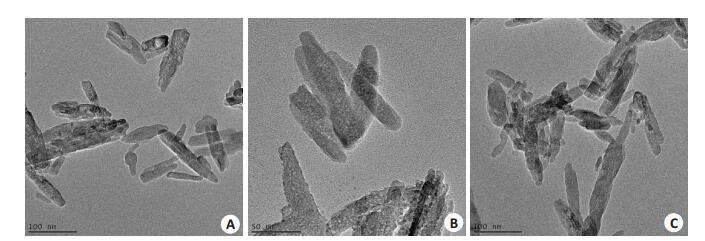
2 结果 2.1 HA的形貌特征图 1显示:未经处理的n-HA(nano-HA,粒径分别为20、30、60 nm的HA)粉末互相叠加在一起,而12μmHA为球形颗粒,界限清晰。n-HA粉末经超声分散后透射电镜高倍镜下形貌清晰可见,分散性较好,20和60 nmHA结晶形貌为针状,而30 nm HA呈短棒状(图 2)。

|
图 1 20nm、30nm、60nm、12μmHA粉末的扫描电镜图像 Figure 1 Scanning electron microscopy of HA particles of 20 nm (A: Original magnification:×100 000), 30 nm (B:×100 000), 60 nm (C:×100 000), and 12μm (D:×4 000). |
|
图 2 n-HA粉末的透射电镜图像 Figure 2 Transmission electron microscopy of HA particles of 20 nm (A), 30 nm (B) and 60 nm (C). |
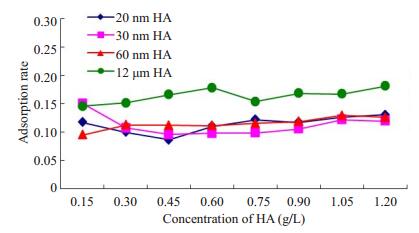
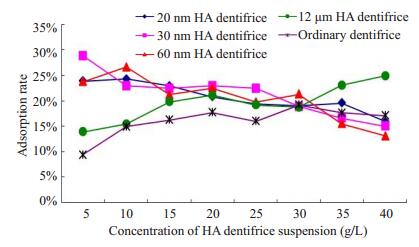
实验研究了20 nm、30 nm、60 nm、12μm的HA及掺入上述粒径的HA牙膏对Zn2+吸附情况。结果如图 3、4中所示,在常温常压、pH值为中性、作用时间为24 h、Zn2+初始浓度为10 mg/L的条件下,随着HA悬液浓度的增加,n-HA组对锌溶液的吸附率先是下降,之后缓慢上升,吸附率变化幅度约为5%左右,且3种粒径n-HA的吸附率相近,平均吸附率分别为11.32%、11.18%、11.47%。12μm HA对锌溶液的吸附随浓度的升高吸附率略有上升,平均吸附率为16.36 %,略高于n-HA(幅度约为5%)。掺n-HA牙膏对Zn2+的吸附随浓度的升高吸附率逐渐下降,平均吸附率为20.81%,较纯n-HA高出约10%,掺12μm HA牙膏对Zn2+的平均吸附率为19.51%,吸附率较纯12μm HA升高约3%。空白牙膏组对锌离子的平均吸附率为16.02%。掺n-HA牙膏的吸附率优于掺12μm HA牙膏和空白牙膏。
|
图 3 不同粒径、形貌的HA对Zn2+的吸附率(静置1d) Figure 3 Adsorption rate of Zn2+ by HA with various particles sizes and morphologies in 1 day. |
|
图 4 掺不同粒径、形貌HA牙膏和空白牙膏对Zn2+吸附率(静置1d) Figure 4 Adsorption rate of Zn2+ by dentifrice incorporating HA of different particle sizes and morphologies and by blank dentifrice in 1 day. |
HA及其牙膏悬液与锌离子溶液反应的沉淀物经EDS检测发现粉末分布有锌元素,进一步证实Zn2+溶液中的锌为HA及其牙膏所吸附沉淀的。
2.4 HA及其牙膏对Zn2+吸附的吸附等温线吸附机制常用于描述水体系中的吸附等温线有Langmuir型和Freundlish型,其形式在许多情况下与实验所用的溶质浓度区段有关,可在一定程度上反映吸附剂与吸附物的特性。采用公式(5)和公式(6)对上述吸附数据进行分析,发现HA对Zn2+的吸附符合Langmuir方程(表 1),而用Freundlish方程拟合,其线性关系不好。掺HA牙膏对Zn2+的吸附行为符合Langmuir和Freundlish两种等温线(各参数见表 2),说明HA及其牙膏对Zn的吸附符合单分子层吸附。从表 1中可见,纯HA对锌离子的最大吸附量均较高,吸附能力顺序为12μm>30nm>60nm>20nm,即12μm球形HA的吸附能力明显优于n-HA,30nm短棒状的HA的吸附能力略优于60nm针状HA,明显优于20nm针状HA。从表 2中可以看出掺HA牙膏的最大吸附量为10.83mg/g~20.92mg/g,均远远低于纯HA,甚至低于空白牙膏组(25.51 mg/g)。
| 表 1 不同粒径、形貌的HA吸附Zn2+的等温线吸附参数 Table 1 Parameters of Langmuir and Freundlish model for HA of different particle sizes and morphologies |
| 表 2 掺不同粒径、形貌HA牙膏吸附Zn2+的等温线吸附参数 Table 2 Parameters of Langmuir and Freundlish model for HA dentifrice of different particle sizes and morphologies |
本实验发现,HA及掺HA牙膏对水溶液中的锌离子具有一定的吸附能力。掺HA牙膏组较纯HA组的吸附率提高了3%~10%,说明HA掺入牙膏后与牙膏本身成分一起对水溶液中锌离子发生了协同吸附作用。掺n-HA牙膏的吸附率优于掺12μmHA牙膏组和空白牙膏组,与本课题组前期报道的研究结论一致[7]。空白牙膏组对Zn2+溶液也有一定的吸附效果,这可能是因为普通牙膏中的基本成分对Zn2+也有一定的吸附能力。
HA的吸附性能主要受其比表面积和表面活性的影响,其中,比表面积增大可以增强表面吸附,而表面活性越高则离子置换越显著,从而提高HA的吸附量,增大HA的比表面积可以通过减小颗粒尺寸至纳米级别来实现[5, 8-9]。本实验发现,纯HA中,12μm球形HA对锌离子的吸附能力最佳,明显优于n-HA,30nm短棒状的HA的吸附能力略优于60nm针状HA,明显优于20nm针状HA,并不如预期中的粒径越小,吸附能力越强,而与孙玉绣[6]的研究结果一致,说明HA对重金属离子的吸附能力不仅与其粒径有关,与HA形貌也有一定关系。
HA加入牙膏后最大吸附量均远远低于纯HA,甚至低于空白牙膏组,这可能是HA颗粒与牙膏中的成分混合应用时发生了团聚,形成大小不一的较大颗粒团簇,无法发挥出纳米材料的优越性[10]。因此,进一步研究将着重解决HA颗粒掺入牙膏后的团聚问题,为环保型功能牙膏的生产提供理论基础。
一般认为,Freundlish方程中的K值越大,吸附能力越强,0.1 < 1/n < 0.5时,容易吸附[11-13],而K值越大,吸附容量越大,从表 2中可以看出:掺HA牙膏对锌离子吸附的1/n介于0.1和0.5之间,最小K=12.03,说明掺HA牙膏对锌离子的吸附容易进行,具有一定的吸附容量。
学者研究发现HA对锌的吸附机制有多种,如离子交换、溶解-沉淀、表面络合等,并随pH变化而不同,pH在6.8左右时,HA对锌的吸附主要是以表面络合和离子交换的方式去除[14-16]。本实验在室温下进行,且不调节pH,pH在6.8左右,可以推测HA对Zn2+的主要吸附机制是表面络合和离子交换,加上牙膏本身对Zn2+的物理吸附和化学沉淀共同起作用。
不同粒径、形貌的HA及其牙膏对模拟废水中的锌离子具备一定的吸附能力。吸附能力不仅受粒径影响,还与HA的形貌有关。掺HA牙膏对锌的吸附符合Langmuir和Freundlish等温模型,而纯HA的吸附仅符合Langmuir等温模型,主要吸附机制有表面络合、离子交换和物理吸附。
| [1] |
Yang Y, Jing XP, Zhang SP, et al. High dose Zinc supplementation induces hippocampal Zinc deficiency and memory impairment with inhibition of BDNF signaling[J].
PLoS One,2013, 8 (1) : e55384.
DOI: 10.1371/journal.pone.0055384. ( 0) 0)
|
| [2] |
Yuan PY, Shen XQ, Liu J, et al. Effects of dentifrice containing hydroxyapatite on dentinal tubule occlusion and aqueous hexavalent Chromium cations sorption: a preliminary study[J].
PLoS One,2012, 7 (12) : e45283.
DOI: 10.1371/journal.pone.0045283. ( 0) 0)
|
| [3] |
Souza BM, Comar LP, Vertuan M, et al. Effect of an experimental paste with hydroxyapatite nanoparticles and fluoride on dental demineralisation and remineralisation in situ[J].
Caries Res,2015, 49 (5) : 499-507.
DOI: 10.1159/000438466. ( 0) 0)
|
| [4] |
Jin J, Xu XH, Lai GY, et al. Efficacy of tooth whitening with different Calcium phosphate-based formulations[J].
Eur J Oral Sci,2013, 121 (4) : 382-8.
DOI: 10.1111/eos.2013.121.issue-4. ( 0) 0)
|
| [5] |
Zhang J, Wang DP, Zhou J, et al. Precise adsorption behavior and mechanism of Ni(II) ions on Nano-Hydroxyapatite[J].
Water Environ Res,2010, 82 (11) : 2279-84.
DOI: 10.2175/106143010X12609736966405. ( 0) 0)
|
| [6] |
孙玉绣, 周松, 杨华. 羟基磷灰石纳米粒子制备及其对Pb2+离子的吸附性能[J].
环境化学,2010, 29 (6) : 1059-62.
( 0) 0)
|
| [7] |
胡诗靖.含不同粒径羟基磷灰石牙膏吸附重金属离子的研究[D].广州:南方医科大学, 2014.
( 0) 0)
|
| [8] |
张鹏, 管红雨, 钟小君. 钛种植体羟基磷灰石和神经生长因子复合涂层的制备及缓释性能研究[J].
广东牙病防治,2014, 22 (5) : 238-40.
( 0) 0)
|
| [9] |
Stoetzel C, Mueller FA, Reinert F, et al. Ion adsorption behaviour of hydroxyapatite with different crystallinities[J].
Colloids Surf B Biointerfaces,2009, 74 (1) : 91-5.
DOI: 10.1016/j.colsurfb.2009.06.031. ( 0) 0)
|
| [10] |
Park M, Lee D, Shin S, et al. Effect of negatively charged cellulose nanofibers on the dispersion of hydroxyapatite nanoparticles for scaffolds in bone tissue engineering[J].
Colloids Surf B Biointerfaces,2015, 130 : 222-8.
DOI: 10.1016/j.colsurfb.2015.04.014. ( 0) 0)
|
| [11] |
Miyaji F, Kono Y, Suyama Y. Formation and structure of zincsubstituted Calcium hydroxyapatite[J].
Mater Res Bull,2005, 40 (2) : 209-20.
DOI: 10.1016/j.materresbull.2004.10.020. ( 0) 0)
|
| [12] |
Wu L, Forsling W, Holmgren A. Surface complexation of Calcium minerals in aqueous solution[J].
J Colloid Interface Sci,2000, 224 (2) : 211-8.
DOI: 10.1006/jcis.1999.6692. ( 0) 0)
|
| [13] |
Xu HY, Yang L, Wang P, et al. Kinetic research on the sorption of aqueous Lead by synthetic carbonate hydroxyapatite[J].
J Environ Manage,2008, 86 (1) : 319-28.
DOI: 10.1016/j.jenvman.2006.12.011. ( 0) 0)
|
| [14] |
Sheha RR. Sorption behavior of Zn(II) ions on synthesized hydroxyapatites[J].
J Colloid Interface Sci,2007, 310 (1) : 18-26.
DOI: 10.1016/j.jcis.2007.01.047. ( 0) 0)
|
| [15] |
尹贻芬.纳米羟基磷灰石的制备和表征及其对重金属离子吸附行为的研究[D].济南:济南大学, 2010.
( 0) 0)
|
| [16] |
Meski S, Ziani S, Khireddine H, et al. Factorial design analysis for sorption of Zinc on hydroxyapatite[J].
J Hazard Mater,2011, 186 (2/ 3) : 1007-17.
( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
