2. 南方医科大学 实验动物中心,广东 广州 510515
2. Laboratory Animal Center, Southern Medical University, Guangzhou 510515, China
缺氧缺血性脑病(HIE)是新生儿围产期脑损伤的主要原因。死亡率从10%~60%不等,25%的幸存者存在神经系统后遗症,如脑瘫、智力迟钝、耳聋和癫痫[1]。MR是检查HIE脑损伤的重要方法,T1WI、T2WI、T2FLAIR序列是HIE的常规扫描序列,可明确显示HIE的病变位置、范围及数目,但在HIE的早期阶段,往往无异常发现[2]。磁共振扩散加权成像(DWI)虽然可以在HIE发病数小时内早期发现病变[3-4],但存在低估病变和有假阴性结果的可能[2]。准确诊断HIE的早期病变对HIE及时治疗和预后评估具有重大意义。ESWAN是基于3D-T2*加权的血管造影,结合了独特的3D T2*多回波采集及特别重建算法的磁敏感加权成像技术。它不仅提供了重T2*加权对比及相位信息,而且提供SWI图像[5]。近年来,ESWAN序列已逐步应用于多种疾病的诊断及研究,应用ESWAN序列可以显示微出血、水肿、钙化及髓静脉异常等病理改变[6]。但目前国内尚无关于建立HIE动物模型应用ESWAN序列观察脑损伤改变的文献报道,本文旨在建立新生西藏小型猪HIE模型基础上,观察新生西藏小型猪HIE模型建立后2 h~5 d内ESWAN序列成像的表现,并与组织病理结果对照,初步探讨ESWAN序列在检测早期HIE病灶的价值。
1 材料和方法 1.1 动物分组及建模健康新生西藏小型猪6只(1~3 d,平均体质量约500 g),由南方医科大学动物中心提供。动物随机分为模型组(4只)和对照组(2只)。动物腹腔注射2%戊巴比妥钠(45 mg/kg)麻醉。通过电热毯及辐射热灯维持肛温在38~40℃。静脉滴注5%葡萄糖生理盐水。把动物仰卧固定在手术台上,消毒颈部皮肤,从颈部切开皮肤,钝性分离双侧颈总动脉,模型组动物行夹闭双侧颈总动脉同时放入缺氧箱内低氧(氧浓度为8%),用KY-2F1型氧分析仪(苏州省建德梅城氧分析仪器厂制造)控制其氧含量为8%,室温34℃。60 min后,复氧(氧浓度为21%)及移除动脉夹再灌注,缝合切口。对照组动物仅进行双侧颈总动脉分离。
1.2 MR扫描及图像后处理应用GE3.0T超导型磁共振扫描仪,采用8通道正交头线圈,SPGR序列,层厚2 mm,FOV 17×17,矩阵256×128,回波数11,翻转角20°,带宽62.5,TE 45 ms,TR 104 ms,完全流动补偿。总扫描时间为3.4~4.8 min。常规MR扫描采用SE序列,T2FLAIR:TR 9602 ms,TE 114.5 ms,层厚2 mm,FOV 20×20:TR 4200 ms,TE139 ms,层厚5 mm,FOV 20×15;DWI:TR 6200 ms,TE 96.3 ms,层厚2.4 mm,FOV 20×16,b=0/1000。模型组动物进行ESWAN扫描的时间点为模型建立后2 h、24 h、3 d、5 d。对照组动物进行ESWAN扫描的时间点为假手术后2 h。常规MR(包括T2WI及T2FLAIR)及DWI扫描于模型建立后24 h进行。应用Functool 4.3_ 5软件处理ESWAN数据。扫描的每一层均得到分别对应11个回波的幅度图和相位图。手工绘制感兴趣区(ROI),测量3次取平均值,在相位图、幅值图、R2*图、T2*图上测量双侧新纹状体区及皮层下白质的相位值、幅度值、T2*值及R2*值。幅度图行最小强度投影(MinIP)用于髓静脉成像。
1.3 组织病理学检查MR扫描并获取数据后,将动物处死并取出脑组织,10%福尔马林磷酸盐缓冲液固定> 72 h,常规脱水、石蜡包埋、HE染色。400倍光镜下观察新纹状体及皮层下周围脑白质的病理学改变。
1.4 统计学分析应用软件SPSS 13.0分析对照组与模型组不同时间点的Phase值、Magnitude值、T2*值和R2*值的差异,比较基于one way ANOVA检验,P < 0.05指示差异有统计学意义。
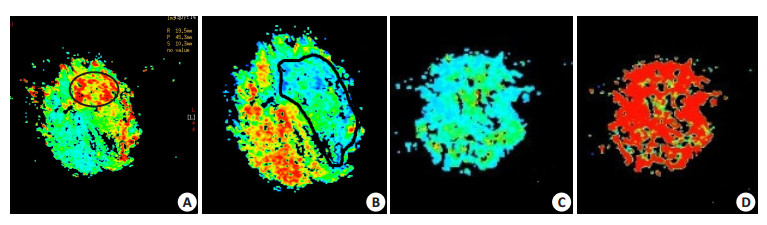
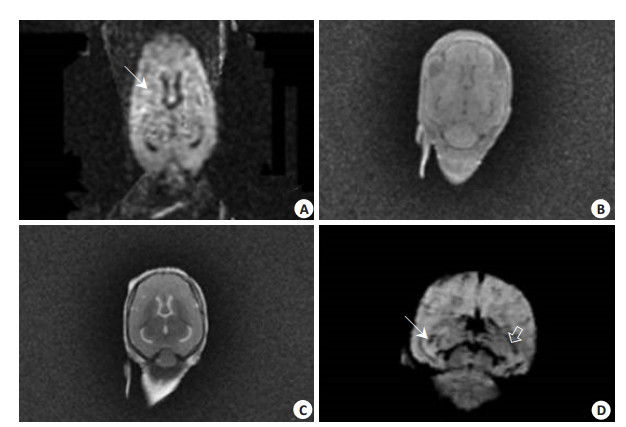
2 结果 2.1 MR表现模型组皮层下白质区和新纹状体区不同时间点相位值与对照组比较,差异无统计学意义(P > 0.05),Phase图可见无明显信号异常,仅见局部信号不均匀。在新纹状体区及皮层下白质区,Magnitude值在HIE模型建立后明显升高,不同时间点与对照组比较差异有统计学意义(P < 0.05)。在新纹状体区,模型建立2 h后,模型组T2*值较对照组明显升高。在第3天值最高,虽然T2*值随后开始减少,但是在第5天仍然高于对照组。与对照组比较,不同时间点差异有统计学意义(P < 0.05)。在皮层下白质区,T2*值于模型建立后2 h略降低随后升高并于24 h达峰值(P < 0.05)。R2*值在皮层下白质区显示一个相反的变化模式,HIE模型建立后,24 h达到最低值(P < 0.05)。新纹状体区,R2*值在模型建立第3天达最低值。与对照组比较,不同时间点差异有统计学意义(P < 0.05,表 1,2)。T2*图显示,新纹状体区24 h内,信号强度增加,而且在第3天信号强度最高,并且在第5天信号强度仍然增高。在皮层下白质区,T2*图显示缺血缺氧模型建立后,信号强度增加,在24 h达到最高的水平(图 1A),在伪彩图上表现为局限性红黄色的信号增高区域。R2*图表现为相反的模式(图 1B)。在新纹状体和皮层下白质区,相位图信号不均匀,幅值图显示异常信号强度增高。信号异常在相位图表现不明显。在我们的实验条件下,新纹状体和皮层下白质都清楚地显示在T2*和幅度图上。经MinIP重建后(SWI)可见双侧侧脑室旁粗大髓静脉及微出血(图 2D)。DWI图像可见双侧新纹状体区及皮层下白质区略高异常信号,以双侧侧脑室旁较为明显(图 2A)。T2WI和T2FLAIR序列没有明显异常信号的变化(图 2B,C)。
| 表 1 白质区phase值,magnitude值,T2*值,R2*值 Table 1 Phase value, magnitude value, T2* value, and R2* value in the white matter(Mean±SD) |
| 表 2 新纹状体区phase值,magnitude值,T2*值,R2*值 Table 2 Phase value, magnitude value, T2* value, R2* value in neostriatum(Mean±SD) |
|
图 1 HIE模型建立后24 h的T2*,R2*图 Figure 1 T2* map and R2* map at 24 h after HIE injury. A, B: Large areas of increased signals in the white matter on T2* map and decreased signals on R2* map; C, D: T2* map and R2* map of the control group. |
|
图 2 SWI、DWI及常规MRI扫描序列表现,SWI对微出血病变的显示优于其它序列 Figure 2 Conventional MRI and SWI, DWI imaging findings. SWI shows better performance in detecting in microbleeding lesions than other sequences. A: DWI showed multiple focal abnormal high signals in the bifrontal subcortical white matter and bilateral neostriatum (↘); B: T2FLAIR showed slightly increased signals; C: T2WI showed no obvious abnormalities; D: SWI showed dilated medulla veins next to the bilateral lateral ventricles (⇩). Focal point-like signal loss was found in the right basal ganglia and thalamus. Arrow indicates microbleeding focus. |
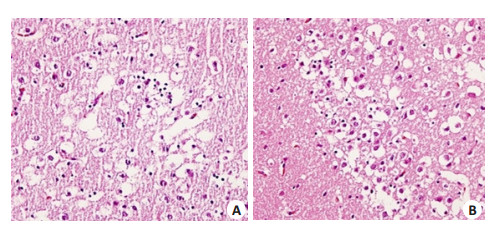
模型组动物病理变化以水肿及静脉淤血为主,偶尔可见局灶性坏死及含铁血黄素沉积。模型组动物皮层下白质区可见神经胶质细胞核固缩、灶性坏死,细胞核溶解,细胞周围间隙极度扩张(图 3A);新纹状体区可见脑组织疏松,细胞外间隙增大呈网状,神经元和神经胶质细胞胞浆明显肿胀,部分细胞核溶解(图 3B)。对照组动物病理学检查未见异常。
|
图 3 HE染色 Figure 3 HE staining of the brain tissue (Original magnification:×400). A: Subcortical white matter showing focal necrosis of glial cells with ruptured nuclei and obvious expansion of the intercellular spaces; B: Neostriatum neurons and neurogliocyte cytoplasmic swelling and vacuolization with rupture of some cell nuclei. |
在HIE模型早期(24 h),常规序列很难发现病变。DWI对于临床轻中度及严重的HIE患儿影像学均可表现为正常及轻度信号升高[7]。本研究模型组动物DWI扫描可见局限性的多发灶状稍高信号,但表现轻微。ESWAN是一种磁敏感成像技术,显著优于传统单一回波的SWI,具有高磁敏感性,高空间分辨率、高信噪比和减少化学位移伪影的特点[6]。ESWAN序列扫描后1次可得到4种对比功能图像,包括相位图、幅值图、R2*mapping、T2*mapping,通过相位掩模与幅值图相乘,厚层最小强度投影(MinIP)重建,还可获得SWI图,以增强血管或微出血的可视化。
T2*值称为自由感应衰减,是在未去除磁场均匀性及周围磁性物质影响下横向磁化矢量自由衰减的产物,对影响磁场均匀度的顺磁性物质(如血液的氧代谢产物、铁等)尤为敏感,去氧血红蛋白、含铁血黄素、二价铁等顺磁性物质增加磁场去相位,导致T2*值的下降[8]。T2*弛豫是组织固有的“真正”T2弛豫和额外的磁场不均匀性的弛豫的结合,即1/T2*=1/T2+1/T2',式中的T2'是磁场非均质性弛豫[9]。R2*是T2*的倒数,较少依赖采集参数,对生理波动引起血氧变化更敏感。本研究初步显示,T2*值及R2*值于HIE模型建立后有明显异常变化,R2*值的变化与T2*值呈相反的模式,模型组动物于模型建立后T2*值升高,R2*值降低,皮层下白质及新纹状体区分别在24及72 h达到峰值,说明模型组动物皮层下白质区及新纹状体区水肿于模型建立2 h后开始出现并持续的进展,皮层下白质区及新纹状体区水肿分别于24及72 h最严重。在随后的时间里,虽然水肿持续存在,但是呈现好转的趋势。病理结果证实,T2*及R2*图像上信号异常区域相应层面脑组织的病理改变主要为水肿。
脑水肿可以分为细胞毒性水肿或白质水肿。前者表现为T2WI及DWI高信号区。然而,鉴于脑含水量通常是在出生时最高,因此T2WI及DWI检查后者与正常高含水量的新生儿无髓鞘白质是很难区分的,本研究发现T2*及R2*值可提供增强的组织对比度,不仅表现在正常组织和出血性病变之间,同样表现在T2*图中正常脑组织和含水量增加的脑组织之间,与Ling等[10]的研究结果一致。一般认为,早期积极治疗脑组织水肿,如限制水摄入量,应用甘露醇脱水,亚低温疗法,可以减轻脑水肿,延迟继发能量衰竭及细胞凋亡。
模型组动物还可见微出血,脑组织的微出血在ESWAN成像上表现为小灶状的信号丢失或低信号,多呈圆点状,条片状低信号影,而在普通MR(包括T1WI,T2WI,T2FLAIR)上显影较淡或者不显影,且ESWAN显示出血灶的数量更多,范围更大,边缘更清晰[11]。模型组动物病变为早期病变,少数细胞坏死在影像学上的表现不明显。
大脑白质的髓静脉引流分为表面组和深层组。深静脉组起源于皮层下脑白质,包含相对较长的静脉通道,向心性地向脑室表面走行,并通过室管膜下静脉引流。深静脉走行于脑室表壁时,管径更粗,数量更少,最后,融合在特定点(主要是侧脑室后角)呈一个典型的扇形模式。ESWAN可利用含氧和去氧血红蛋白的磁敏感性差异,在不使用外源造影剂的情况下显示脑静脉[12]。本研究模型组动物脑组织ESWAN扫描经MinIP重建后的SWI图像均可见不同程度扩张的髓静脉及可能的含铁血黄素沉积,与Arrigoni等[13]的实验结果一致。
实验表明模型组动物在造模后24 h SWI可见微出血灶及髓静脉扩张。PHASE图像是多梯度回波相位图像叠加图像,顺磁性物质,如去氧血红蛋白、含铁血黄素、铁蛋白相对于周围组织表现为负相位。抗磁性物质,如钙化,表现为正相位,本研究中模型组动物新纹状体区及脑白质区,相位值与对照组比较差异无统计学意义,可能与本研究样本量较小,ROI选取范围较大(不仅仅包含微出血的病灶)有关。Ning等[14]的研究结果发现早产儿脑深部灰质核团的相位值和铁含量之间没有相关性,提示广泛区域脑组织相位变化的意义需要进一步研究。
因此,ESWAN序列可提高新生儿缺氧缺血性脑病影像学检查的敏感性及特异性,作为HIE影像检查的补充检查以评价HIE患儿是否有脑出血及脑组织水肿;同时T2*值、R2*值可用于观察新生儿缺氧缺血性脑损伤的发生发展变化。
| [1] |
Akamatsu T, Dai HM, Mizuguchi M, et al. LOX-1 is a novel therapeutic target in neonatal Hypoxic-Ischemic encephalopathy[J].
Am J Pathol,2014, 184 (6) : 1843-52.
DOI: 10.1016/j.ajpath.2014.02.022. ( 0) 0)
|
| [2] |
王凡, 李红. 不同时间窗fMRI诊断新生儿缺氧缺血性脑病的研究进展[J].
放射学实践,2015 (8) : 876-9.
( 0) 0)
|
| [3] |
Tuor UI, Qiao M, Morgunov M, et al. Magnetization transfer and diffusion imaging of acute axonal damage in the cerebral peduncle following hypoxia-ischemia in neonatal rats[J].
Pediatr Res,2013, 73 (3) : 325-31.
DOI: 10.1038/pr.2012.178. ( 0) 0)
|
| [4] |
Cabaj A, Bekiesinska FM, Madzik J. MRI patterns of hypoxicischemic brain injury in preterm and full term infants-classical and less common Mr findings[J].
Pol J Radiol,2012, 77 (3) : 71-6.
DOI: 10.12659/PJR.883379. ( 0) 0)
|
| [5] |
Rumzan R, Wang JJ, Zeng C, et al. Iron deposition in the precentral grey matter in patients with multiple sclerosis: A quantitative study using susceptibility-weighted imaging[J].
Eur J Radiol,2013, 82 (2) : E95-9.
DOI: 10.1016/j.ejrad.2012.09.006. ( 0) 0)
|
| [6] |
Guo LF, Geng J, Qiu MH, et al. Quantification of phase values of cerebral microbleeds in hypertensive patients using ESWAN MRI[J].
Clin Neuroradiol,2013, 23 (3) : 197-205.
DOI: 10.1007/s00062-012-0196-4. ( 0) 0)
|
| [7] |
Lodygensky GA, West T, Moravec MD, et al. Diffusion characteristics associated with neuronal injury and glial activation following Hypoxia-Ischemia in the immature brain[J].
Magnetic Resonance in Medicine,2011, 66 (3) : 839-45.
DOI: 10.1002/mrm.22869. ( 0) 0)
|
| [8] |
刘晓丹, 王颖, 凌雪英, 等. ESWAN序列在小血管病性血管性认知障碍非痴呆型中的应用研究[J].
临床放射学杂志,2012, 31 (8) : 1064-71.
( 0) 0)
|
| [9] |
Mamisch TC, Hughes T, Mosher TJ, et al. T2 star relaxation times for assessment of articular cartilage at 3 T: a feasibility study[J].
Skeletal Radiol,2012, 41 (3) : 287-92.
DOI: 10.1007/s00256-011-1171-x. ( 0) 0)
|
| [10] |
Ling XE, Huang L, Liu GS, et al. Prospective evaluation of term neonate brain damage following preceding hypoxic sentinel events using enhanced T(2)* weighted angiography (eSWAN)[J].
Int J Neurosci,2013, 123 (12) : 837-46.
DOI: 10.3109/00207454.2013.804820. ( 0) 0)
|
| [11] |
任文, 姜兴岳, 谢庆芝, 等. SWI对新生儿缺氧缺血性脑病中出血性病灶的诊断价值[J].
实用放射学杂志,2015 (4) : 630-3.
( 0) 0)
|
| [12] |
Doneda C, Righini A, Parazzini C, et al. Prenatal Mr imaging detection of deep medullary vein involvement in fetal brain damage[J].
AJNR Am J Neuroradiol,2011, 32 (8) : E146-9.
DOI: 10.3174/ajnr.A2249. ( 0) 0)
|
| [13] |
Arrigoni F, Parazzini C, Righini A, et al. Deep medullary vein involvement in neonates with brain damage: an Mr imaging study[J].
AJNR Am J Neuroradiol,2011, 32 (11) : 2030-6.
DOI: 10.3174/ajnr.A2687. ( 0) 0)
|
| [14] |
Ning N, Zhang L, Gao J, et al. Assessment of Iron deposition and white matter maturation in infant brains by using enhanced T2 star weighted angiography(ESWAN): R2*versus phase values[J].
PLoS One,2014, 9 (2) : e89888-90.
DOI: 10.1371/journal.pone.0089888. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
