Fluoro-JadeB(FJB)作为一种阴离子荧光配体染料,对变性的神经元具有高度亲和力,能特异性标记中枢神经系统中变性神经元[1-2]以及激活的胶质细胞[3-4]。与以往的组织化学染色方法相比,FJB染色具有快速、简单、经济、重复性好等优势[5-6]。因此,FJB染色可作为研究神经系统退行性疾病以及检验药物神经保护作用的一种方法。由于FJB染色不能用于变性神经细胞的探测与定位,也不能进一步探讨目的蛋白与变性神经元之间的相互作用关系,故不能广泛用于研究变性神经元的发生发展机制。为了解目的蛋白与变性神经元的共定位表达以及他们之间的相互关系,本文通过实验探讨FJB染色结合目的蛋白免疫荧光染色的方法,探讨不同染色步骤对FJB染色结合蛋白免疫荧光方法的影响,寻找FJB染色结合目的蛋白免疫荧光染色的最佳方法。本研究结果将为探讨神经系统退行性疾病变性神经元的定位以及与目的蛋白相互作用提供一种良好的研究手段,也可拓展FJB染色的应用范围。
1 材料和方法 1.1 材料实验动物为成年雄性SD大鼠,体质量280~320g,购于南方医科大学实验动物中心。主要试剂为FJB(Millipore),目的蛋白Cathepsin B抗体(anti-CathB)(Millipore)。实验主要仪器为冰冻切片机(Leica);荧光显微镜(Leica)。
1.2 大脑缺血动物模型制作SD大鼠术前12h禁食,异氟烷(5%异氟烷混于100%O2诱导,2%维持)麻醉,取眼-耳连线中点作与之垂直的切口,逐层暴露至颅骨。在颧弓和颞骨鳞部结合处前下方约1~2mm处,开一个直径约为5mm的小颅窗,此时透过硬脑膜就可见一条较直且少分支的小血管,即大脑中动脉,该动脉几乎垂直于嗅束向上而行,在显微镜下用虹膜钩小心撕开硬脑膜,分离血管周围的软脑膜和蛛网膜组织,使血管游离,在大脑左侧中动脉与大脑上静脉(SCV)交叉上方,用双极电凝凝闭大脑中动脉(MCA)皮层支[7-9]。术后腹腔内注射青霉素钠盐4万单位预防感染。
1.3 动物分组本实验根据研究需要,将Fluoro-Jade B(FJB)染色与蛋白的免疫荧光双标或多标。采用随机数字表法将大鼠分为两组:第1组对大鼠脑缺血切片先行FJB染色,在此基础上通过漂片法进一步复合蛋白免疫荧光,具体见1.4。第2组对大鼠脑缺血切片先做免疫荧光,然后贴片进行FJB染色,具体见1.5。
1.4 Fluoro-Jade B染色MCAO术后第5天,大鼠通过10%水合氯醛深度麻醉后,经升主动脉灌注生理盐水,继以4%多聚甲醛磷酸盐缓冲液(pH值7.4)快速灌注,迅速开颅取脑,冠状切成厚约5.0mm的组织块,4%多聚甲醛磷酸盐缓冲液(pH值7.4)继续固定24h,依次在10%、20%、30%蔗糖溶液中脱水至沉底后,冰冻切片,片厚30μm。切片首先浸入100%乙醇混合液3min,转入70%乙醇1min,然后PBS溶液漂洗1min;继而转入0.06%高锰酸钾溶液15min[10],后PBS溶液漂洗1min×3次;将0.0001%FJB染液(含0.1%的乙酸)均匀滴加到处理后的脑切片上,室温下反应30min,反应时应尽量避免强光照射;反应后的切片在蒸馏水中漂洗3次,每次1min;如还需与蛋白免疫荧光染色双标,就直接进入免疫荧光染色步骤,此步骤方法用于FJB+CathB组。如不需双标,可贴片晾干,透明(二甲苯7min),用中性树胶(DPX)封片。荧光显微镜下采用绿色滤色片观察并采集图像。
1.5 免疫荧光将大鼠脑片予磷酸盐缓冲液(PBS,0.01 mol/L,pH值为7.4)漂洗脑片5 min×3次;每孔加入约150µL正常非特异山羊血清封闭液,室温下振荡孵育1 h;加一抗,每孔约200µL。本实验目的蛋白一抗包括CathB(1∶100),一抗稀释液为5%的牛血清白蛋白(BSA)、0.2%的Tritonx-100溶于PBS中,室温下振荡孵育1 h,后放入4℃冰箱振荡孵育过夜14 h,次日于室温下振荡孵育1 h,PBS漂洗5 min×6次;每孔加入约150µL荧光二抗(抗兔CY3 1∶100),避光室温振荡孵育2 h后,PBS漂洗5 min×5次[11]。如还需与FJB染色免疫双标,可将做完免疫荧光的脑片贴于载玻片上晾干,再进行FJB染色,该方法用于CathB+FJB组。最后用水性封片剂封片,在荧光显微镜下观察并采集图像。
2 结果 2.1 大脑皮层缺血梗死后导致皮层半暗带神经元变性在荧光显微镜下观察FJB染色切片(图 1),大鼠大脑皮层梗死后5 d,皮层半暗带见大量绿色荧光着色的变性神经元,高倍镜下可清楚地显示变性神经元胞体和突起;此外变性神经元呈固缩状,形态不规则。
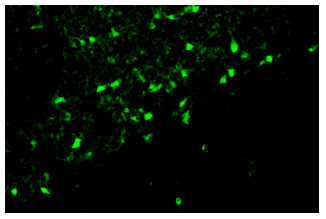
|
图 1 大鼠大脑皮层缺血梗死后5d Fluoro-Jade B染色 Figure 1 FJB staining in the ipsilateral cortical ischemic penumbra at 5 days after focal cortical infarction in adult rats (Original magnification:×200). |
在FJB+CathB组,FJB染色的脑切片上梗死皮层半暗带可清楚地观察到大量散在被染成黄绿色荧光的FJB阳性细胞和红色免疫荧光的CathB阳性细胞,图像的背景较浅;荧光多标也显示FJB与CathB阳性细胞部分重叠。而在CathB+FJB组中,虽然可见FJB阳性细胞,但蓝色DAPI以及红色CathB阳性细胞模糊,细胞形态不清晰(图 2)。
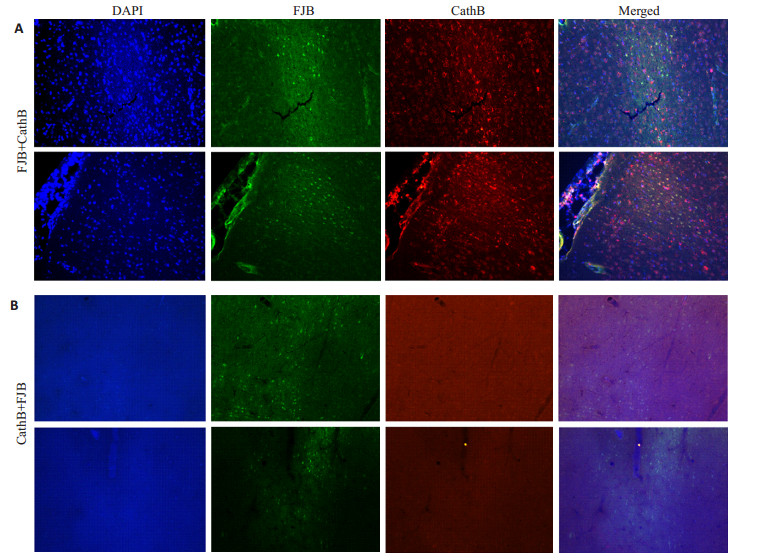
|
图 2 两种FJB染色结合免疫荧光多标方法的比较 Figure 2 Effect of the two methods for combining Fluoro-Jade B staining with immunofluorescent staining of the infarct tissue of rats(Original magnification:×40). A: Representative images of fluorescent double-staining of the FJB-positive cells and CathB (green); B: Representative images of fluorescent double-staining of CathB (green) and FJB-positive cells. |
在FJB+CathB组中,我们观察到大鼠大脑皮层缺血半暗带区红色免疫荧光的CathB阳性细胞荧光强度明显高于正常部位,且高表达CathB的阳性细胞与FJB阳性细胞重叠;提示大脑皮层缺血半暗带的CathB可能参与到神经元变性的发生发展中(图 3)。
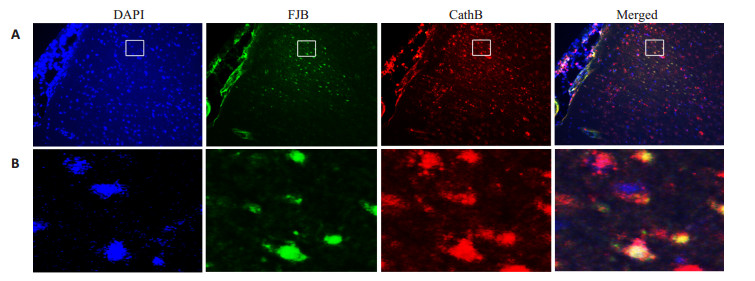
|
图 3 大鼠大脑皮层缺血半暗带变性神经元CathB蛋白免疫荧光增强 Figure 3 CathB was up-regulated in FJB-positive cells in the ischemic penumbra after focal cortical infarction in adult rats. A: Fluorescent double-staining of CathB-(green) and the FJB-positive cells (Original magnification:×40); B: Fluorescent double-staining of CathB-(green) and FJB-positive cells in the ischemic penumbra of cortical(Original magnification:×400). |
大鼠大脑皮层梗死是一种常用的局部脑缺血模型,皮层梗死后引起半暗带神经元变性或死亡,及时给予治疗对于半暗带变性神经元的转归具有重要作用。FJB与以前的FJ染料以及新近发展的FJC染料的性质相近[12],属于第二代阴离子荧光染料,可标记正发生变性的神经元,是一种研究神经系统退行性疾病神经元变性以及检验神经保护药物的标志物[13-15]。与传统的检测神经元变性的组织化学方法比,FJB染色对于神经元变性的检测更加敏感和准确,操作方法也更加简单。更重要的,我们的实验结果证实FJB染色能与目的蛋白免疫荧光复合多标,这为探讨神经系统退行性疾病变性神经元的定位以及与目的分子相互作用提供了一种很好的研究手段。
本实验结果显示,在大鼠大脑皮层梗死模型中,FJB+CathB组可以清晰地观察到皮层半暗带变性的神经元以及目的蛋白CathB阳性细胞,其中FJB和CathB阳性细胞清晰,染色背景浅;而CathB+FJB组中FJB以及目的蛋白CathB阳性细胞都不清晰,多标荧光染色效果不佳,不利于后续的实验研究。本实验证实脑组织切片先予FJB染色再与目的蛋白免疫荧光多标可行,这与国外的一些研究也相吻合[16-18];同时,我们的研究结果提示FJB染色复合免疫荧光染色步骤的顺序会影响目的蛋白免疫荧光的效果。在CathB+FJB组中,目的蛋白的荧光效果明显不如FJB+CathB组,可能的原因是FJB染色过程会影响目的蛋白CathB的免疫荧光效果,所以先行FJB染色再复合蛋白免疫荧光有利于FJB染色复合蛋白免疫荧光多标。
在本实验结果中,我们还观察到半暗带区CathB免疫荧光强度明显高于正常部位,且CathB荧光强的神经细胞与FJB染色的变性神经元重叠。FJB染色与目的蛋白CathB免疫双标染色结果提示,大鼠大脑皮层缺血半暗带CathB表达增强可能导致半暗带区神经元发生变性,而CathB过高表达则导致神经元发生死亡。我们的研究结果证实FJB染色复合目的蛋白免疫荧光为探讨变性神经元与目的分子之间的相互作用关系提供了一种很好的研究手段。
综上所述,FJB染色技术复合目的蛋白免疫荧光染色方法可行,能用于变性神经细胞的探测与定位;此外,在探讨目的蛋白与变性神经元之间的相互作用中具有一定的应用价值,是一种可靠、简单、重复性好的检测手段。因此,在神经科学相关的研究中,FJB染色复合目的蛋白免疫荧光染色技术是一种值得推荐的免疫双标或多标方法。
| [1] |
Schmued LC, Albertson C, Slikker W. Fluoro-Jade: a novel fluorochrome for the sensitive and reliable histochemical localization of neuronal degeneration[J].
Brain Res,1997, 751 (1) : 37-46.
DOI: 10.1016/S0006-8993(96)01387-X. ( 0) 0)
|
| [2] |
Schmued LC, Hopkins KJ. Fluoro-Jade B: a high affinity fluorescent marker for the localization of neuronal degeneration[J].
Brain Res,2000, 874 (2) : 123-30.
DOI: 10.1016/S0006-8993(00)02513-0. ( 0) 0)
|
| [3] |
Anderson KJ, Fugaccia I, Scheff SW. Fluoro-Jade B stains quiescent and reactive astrocytes in the rodent spinal cord[J].
J Neurotrauma,2003, 20 (11) : 1223-31.
DOI: 10.1089/089771503770802899. ( 0) 0)
|
| [4] |
Damjanac M, Bilan AR, Barrier LA, et al. Fluoro-Jade (R) B staining as useful tool to identify activated microglia and astrocytes in a mouse transgenic model of alzheimer's disease[J].
Brain Res,2007, 1128 (1) : 40-9.
( 0) 0)
|
| [5] |
Ballok DA, Millward JM, Sakic B. Neurodegeneration in autoimmune MRL-lpr mice as revealed by Fluoro Jade B staining[J].
Brain Res,2003, 964 (2) : 200-10.
DOI: 10.1016/S0006-8993(02)03980-X. ( 0) 0)
|
| [6] |
Yu DK, Yoo KY, Shin BN, et al. Neuronal damage in hippocampal subregions induced by various durations of transient cerebral ischemia in gerbils using Fluoro-Jade B histofluorescence[J].
Brain Res,2012, 1437 (9) : 50-7.
( 0) 0)
|
| [7] |
侯清华, 解龙昌, 曾进胜, 等. 组织蛋白酶B抑制剂Ca-074ME对皮层脑梗死的保护作用[J].
实用医学杂志,2012, 28 (1) : 55-8.
( 0) 0)
|
| [8] |
Zhang J, Zhang Y, Li J, et al. Autophagosomes accumulation is associated withβ-amyloid deposits and secondary damage in the thalamus after focal cortical infarction in hypertensive rats[J].
J Neurochem,2012, 120 (4) : 564-73.
DOI: 10.1111/jnc.2012.120.issue-4. ( 0) 0)
|
| [9] |
Xing S, Zhang J, Dang C, et al. Cerebrolysin reduces amyloid-βdeposits, apoptosis and autophagy in the thalamus and improves functional recovery after cortical infarction[J].
J Neurol Sci,2014, 337 (1/2) : 104-11.
( 0) 0)
|
| [10] |
Zhu TN, Zhan LX, Liang DH, et al. Hypoxia-Inducible factor 1 alpha mediates neuroprotection of hypoxic postconditioning against global cerebral ischemia[J].
J Neuropathol Exp Neurol,2014, 73 (10) : 975-86.
DOI: 10.1097/NEN.0000000000000118. ( 0) 0)
|
| [11] |
Zhan LX, Yan HX, Zhou HR, et al. Hypoxic preconditioning attenuates neuronal cell death by preventing MEK/ERK signaling pathway activation after transient global cerebral ischemia in adult rats[J].
Mol Neurobiol,2013, 48 (1) : 109-19.
DOI: 10.1007/s12035-013-8436-4. ( 0) 0)
|
| [12] |
Schmued LC, Stowers CC, Scallet AC, et al. Fluoro-Jade C results in ultra high resolution and contrast labeling of degenerating neurons[J].
Brain Res,2005, 1035 (1) : 24-31.
DOI: 10.1016/j.brainres.2004.11.054. ( 0) 0)
|
| [13] |
Gu Q, Schmued LC, Sarkar S, et al. One-step labeling of degenerative neurons in unfixed brain tissue samples using FluoroJade C[J].
J Neurosci Methods,2012, 208 (1) : 40-3.
DOI: 10.1016/j.jneumeth.2012.04.012. ( 0) 0)
|
| [14] |
Liu F, Schafer DP, Mccullough LD. TTC, fluoro-Jade B and NeuN staining confirm evolving phases of infarction induced by middle cerebral artery occlusion[J].
J Neurosci Methods,2009, 179 (1) : 1-8.
DOI: 10.1016/j.jneumeth.2008.12.028. ( 0) 0)
|
| [15] |
袁磊, 龚济钦, 张海霞, 等. KA1亚受体在内质网应激致海马神经元死亡中的作用[J].
南方医科大学学报,2015 (2) : 191-5.
( 0) 0)
|
| [16] |
Schuppel K, Brauer K, Hartig W, et al. Perineuronal nets of extracellular matrix around hippocampal interneurons resist destruction by activated microglia in trimethyltin-treated rats[J].
Brain Res,2002, 958 (2) : 448-53.
DOI: 10.1016/S0006-8993(02)03569-2. ( 0) 0)
|
| [17] |
Ohk TG, Yoo KY, Park SM, et al. Neuronal damage using FluoroJade B histofluorescence and gliosis in the striatum after various durations of transient cerebral ischemia in gerbils[J].
Neurochem Res,2012, 37 (4) : 826-34.
DOI: 10.1007/s11064-011-0678-9. ( 0) 0)
|
| [18] |
Mehta SL, Kumari S, Mendelev N, et al. Selenium preserves mitochondrial function, stimulates mitochondrial biogenesis, and reduces infarct volume after focal cerebral ischemia[J].
BMC Neurosci,2012, 13 (1) : 79.
DOI: 10.1186/1471-2202-13-79. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
