2. 广州市萝岗区中医医院外科,广东 广州 510530 ;
3. 广东省梅州市人民医院泌尿外科,广东 梅州 514021 ;
4. 暨南大学附属第一医院泌尿外科,广东 广州 510630
2. Department of Surgery, Traditional Chinese Medicine Hospital of Luogang District, Guangzhou 510530, China ;
3. Department of Urology, Meizhou People's Hospital, Meizhou 514021, China ;
4.
前列腺癌是老年男性常见疾病,发病年龄在55岁前处于较低水平,55岁后逐渐升高,发病率随着年龄的增长而增长。近年来我国前列腺癌的发病率呈明显上升趋势[1]。前列腺癌中晚期主要治疗方法是内分泌治疗,癌患者易产生激素抵抗,导致患者病情恶化[2],研究前列腺癌新的治疗药物具有重要的意义,而近年来,天然药物在肿瘤的治疗过程中发挥的重要的作用,如紫杉醇,苦参碱等都具有较好的抗肿瘤作用[3-4],寻找抗肿瘤作用靶点及信号转导分子机制明确的天然药物具有重要的意义。
龙葵素(Solanine)也叫马铃薯毒素,分子式为C45H73NO15,是一种糖苷生物碱[5],通过胆固醇生物合成途径产生[6],广泛存在于茄科植物(番茄、茄子和马铃薯)中,其结构与人类的甾体激素如雄激素、雌激素、孕激素等性激素相类似。在人类饮食中,龙葵素毒性水平尚未确定,有研究表明龙葵素是通过抑制胆碱酯酶的活性引起食物中毒反应[7]。尽管人们普遍认为龙葵素是有毒的,但是与其他甾类生物碱一样,龙葵素具有重要的药用价值。国内外研究表明龙葵素具有消炎、抗过敏、抗糖尿病和抗菌活性[8-11]。近年来,龙葵素抗肿瘤作用日益引起人们的重视。本课题组前期研究结果表明龙葵素能够抑制前列腺癌LnCaP和Du145细胞增殖,但关于龙葵素在体内抑制肿瘤增殖的具体信号调控机制尚不明了。本研究通过裸鼠体内成瘤实验探讨龙葵素在体内抑制前列腺癌生长的细胞周期的信号通路变化,进一步阐明其抑制前列腺癌增殖的作用及分子机理,为龙葵素治疗前列腺癌提供临床应用依据。
1 材料和方法 1.1 实验材料龙葵素(美国,sigma),Balb/c雄性裸鼠(广东省实验动物中心),前列腺癌细胞系Du145(暨南大学附属第一医院临床实验中心惠赠),CyclinD1,CyclinD2,CDK4,CDK6,GAPDH抗体(美国,CST),HRP标记羊抗兔IgG(碧云天生物技术),Tunel凋亡检测试剂盒(美国,promega)。
1.2 裸鼠皮下实体瘤模型的建立人前列腺癌细胞株Du145常规传代培养,0.25%蛋白酶消化成单细胞悬液,PBS洗3次,调整细胞浓度为3×107个/mL,经台盼蓝染色,对活细胞计数后,测定细胞活力在95%以上,取0.2 mL接种于裸鼠右侧腋下皮下组织内,建立Du145人前列腺癌实体瘤动物模型。
1.3 实验动物的分组和药物处理选取肿瘤大小一致(肿瘤直径5 mm)的裸鼠随机分成两组,分别为人前列腺癌细胞株Du145空白对照组和实验组,每组6只,每3 d瘤内给药1次,空白对照组注射0.2 mL生理盐水,实验组注射50μg/mL龙葵素0.2 mL,每3 d测量并记录肿瘤的长径和短径,并根据肿瘤重量计算抑瘤率。3周后称裸鼠体质量,然后颈椎脱臼法处死裸鼠,小心剥离肿瘤组织,测量肿瘤的重量,并依据公式计算抑瘤率,
抑瘤率=(对照组平均瘤质量-治疗组平均瘤质量)/对照组平均瘤质量×100%
1.4 荧光定量PCR检测肿瘤组织中细胞周期G1/S相关因子mRNA的变化液氮碾磨肿瘤组织样品,使用Trizol法提取组织总RNA,检测RNA的纯度之后按照PrimeScriptTM RT reagent Kit逆转录试剂盒操作步骤对RNA进行逆转录,定量PCR使用SYBR Green染料法,按照SYBR Premix Ex Taq荧光定量试剂盒说明书进行PCR体系配制,反应体系在LightCycler®480实时PCR系统进行,采用两步法进行PCR反应。使用SDS软件自动得出的Ct值计算出相对表达量。
1.5 免疫印迹检测肿瘤组织中细胞周期G1/S相关因子的变化液氮碾磨肿瘤组织样品,加入组织蛋白裂解液裂解组织蛋白,匀浆液于4℃10 000 g离心15 min,取上清即为蛋白样品。使用BCA蛋白测定试剂盒对上清液的总蛋白进行蛋白定量,从每个样品中取总蛋白(30μg)加入电泳上样缓冲液,100℃煮沸5 min后于12% SDS-PAGE电泳分离蛋白质,电泳后将蛋白转移至PVDF膜,5%脱脂奶粉室温封闭1 h,加入1∶300稀释的一抗,4℃孵育过夜。第2天用TBST洗膜3次,每次5 min,加入1∶5000稀释的HRP标记的二抗,室温孵育1 h,TBST洗膜6次,每次5 min,加入ECL化学发光液显色,用Bio-rad凝胶成像系统拍照,用ImageJ2x软件进行灰度值分析。
1.6 Tunel检测组织细胞凋亡取小块组织样品脱水包埋后制备成5μm石蜡切片,脱蜡水化之后将切片浸入4%多聚甲醛溶液,室温固定15 min,PBS洗涤2次,每次5 min,20μg/mL的蛋白酶K溶液室温孵育切片8~10 min,PBS洗涤5 min,加入50μL的rTdT孵育缓冲液(内含平衡缓冲液,核苷混合物和rTdT酶)37℃避光孵育1 h,将切片浸入2×SSC,室温放置15 min以终止反应,用荧光显微镜检测定位凋亡细胞的绿色荧光(荧光素-12-dUTP)。
1.7 统计分析采用SPSS20.0软件对实验数据进行分析,数据表示为Mean±SD中的至少重复3次(SD)。使用T检验进行统计分析(2组的比较),P < 0.05认为差异有统计学意义。
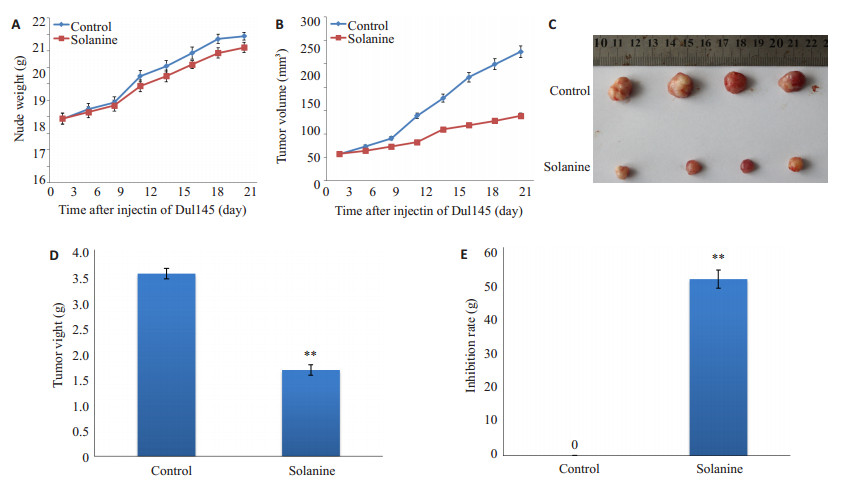
2 结果 2.1 龙葵素抑制前列腺癌肿瘤的生长皮下接种人前列腺癌Du145细胞的裸鼠在2周后开始出现肉眼可见的直径约5~10 mm左右的皮下肿瘤,表明Du145人前列腺癌实体瘤小鼠模型均建造成功。实验过程中,实验组和对照组裸鼠体质量均无显著差异,给药第9天开始,龙葵素实验组裸鼠皮下移植瘤的生长开始受到抑制。实验结束时,剥离各组瘤体发现,瘤体表面有包膜完整包裹,与周围组织界限清晰,易剥离,与空白对照组相比,龙葵素处理组肿瘤体积明显小于空白对照组。与空白对照组相比,龙葵素处理组裸
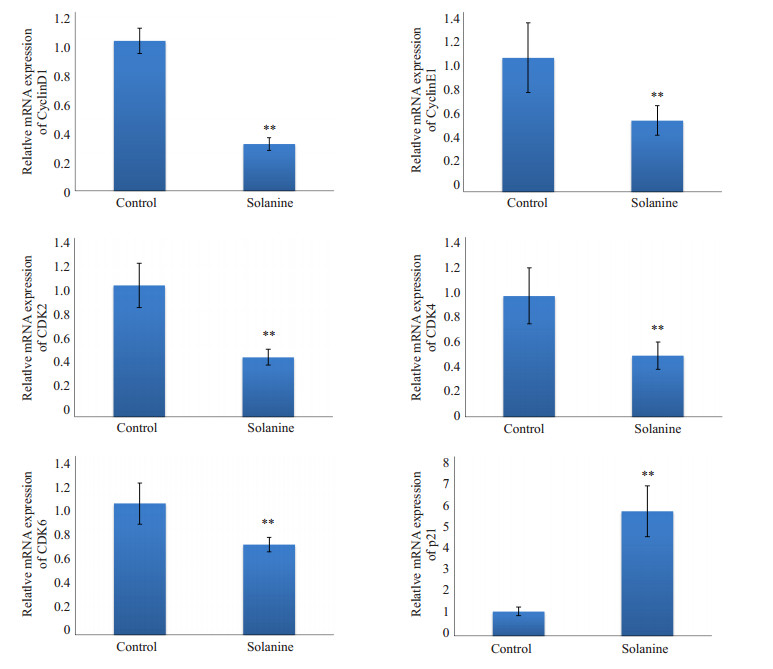
2.2 龙葵对人前列腺癌G1/S期调控因子的影响为了探索龙葵素抑制前列腺癌肿瘤的生长的分子机制,通过Q-PCR检测了龙葵素处理后,人前列腺癌实体瘤细胞周期调控基因的表达水平,研究结果表明,同生理盐水处理的空白组相比,龙葵素能显著抑制人前列腺癌细胞CyclinD1、CyclinE1、CDK2、CDK4和CDK6基因的mRNA表达水平,显著升高p21 mRNA的表达水平(P < 0.05,图 2)。
|
图 1 龙葵素对裸鼠皮下种植的人前列腺癌细胞瘤的影响 Figure 1 Effects of solanine on growth of human prostate cancer tumor in nude mice. A: Changes in body weight of nude mice; B: Changes in tumor volume; C: Changes in tumor growth; D: Changes in tumor weight. E: Tumor inhibition rate. **P < 0.05. |
|
图 2 荧光定量PCR检测龙葵素对人前列腺癌周期调控因子mRNA影响 Figure 2 Effects of solanine on mRNA expression of cell cycle-related proteins detected by real-time PCR. **P < 0.05. |
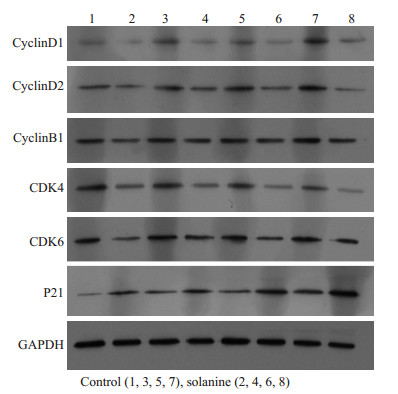
为了进一步探索龙葵素抑制前列腺癌肿瘤生长的分子信号通路,通过免疫印迹检测了龙葵素处理后,人前列腺癌实体瘤细胞周期通路相关蛋白的表达水平,免疫印迹结果表明,同生理盐水处理的空白组相比,龙葵素能显著抑制人前列腺癌细胞CyclinD1,CyclinE1,CDK2,CDK4,CDK6蛋白的表达水平,显著升高P21蛋白的表达水平(P < 0.01,图 3)。
|
图 3 免疫印迹检测龙葵对人前列腺癌组织周期相关蛋白的影响 Figure 3 Effects of solanine on expression of cell cycle-related proteins detected by Western blottin |
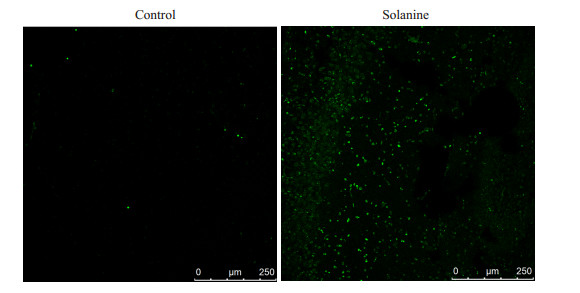
为了探讨龙葵素抑制前列腺癌肿瘤生长与肿瘤细胞凋亡的关系,通过Tunel法检测了龙葵素处理后,人前列腺癌实体瘤细胞的凋亡水平。Tunel原位凋亡检测结果表明,龙葵素处理的实验组和肿瘤组织的细胞凋亡水平明显高于生理盐水对照组(P < 0.01,图 4)。
|
图 4 Tunel检测龙葵素对人前列腺癌组织细胞凋亡的影响 Figure 4 Effects of solanine on apoptosis of tumors detected by TUNEL assay. |
近年来我国前列腺癌的发病率呈明显上升趋势,中晚期主要治疗方法是内分泌治疗,癌患易产生激素抵抗,病情恶化,研究前列腺癌新的治疗药物具有重要的意义。研究表明,龙葵素对人前列腺癌细胞、肝癌细胞、乳腺癌细胞及人黑色素瘤细胞有较好的抑制作用[12-13]。本研究小组前期体外细胞实验结果表明,龙葵碱可能通过诱导人前列腺癌细胞LNCaP和Du145凋亡而产生抑制增殖作用。对于龙葵素在体内对前列腺癌的影响研究很少,作用机制更需深入探讨,本研究采用高度恶性的转移前列腺癌细胞株Du145作为动物体内实验的模型,研究龙葵素对前列腺癌细胞的裸鼠体内成瘤能力影响及其作用机制。
本研究建立前列腺癌实体瘤动物模型,通过裸鼠皮下瘤内给药发现龙葵素能抑制裸鼠瘤体生长,通过实时荧光定量PCR和免疫印迹结果可以发现,龙葵素对前列腺癌细胞周期蛋白的表达有显著影响,同时结合Tunel检测结果,发现龙葵素能够促进肿瘤组织的凋亡,提示龙葵素在体内可能通过抑制肿瘤细胞周期促进肿瘤组织的细胞凋亡,抑制前列腺癌细胞的裸鼠体内成瘤能力。
细胞增殖是细胞生命活动的基本特征之一,也是生物有机体的重要特点。真核细胞通过复杂的细胞周期调控系统控制细胞的分裂,从而维持有机体的正常代谢和增殖。细胞周期调控的异常与肿瘤的发生及发展密切相关。细胞周期的调控是由一系列重要的信号分子和周期蛋白家族来完成的,这些调节因子发生突变或者表达水平发生改变,将导致细胞周期调控的改变,使细胞增殖能力增强分化减弱,丧失细胞原有的功能,最终发展成肿瘤细胞[14-15]。
细胞周期调节主要包括G1/S和G2/M两个检测点,其中G1/S过渡是周期进展的关键, 大多数与细胞增殖有关的基因事件均发生于G1期[16-17]。细胞从G1期进入S期依赖于CDKs(cyclin dependent kinases)的活化,CDKs在整个细胞周期的表达比较稳定,其活性的调节主靠cyclins的周期性表达,cyclins与相应的CDk结合后激活CDKs,cyclin D、cyclinE分别与CDK4/6或CDK2结合形成的蛋白复合物激活后,促使细胞从G1向S期过渡,CDK抑制物(CDKI)P21是G1/S过渡中主要的负反馈调节物质,作用于G1晚期,P21表达增强可阻滞细胞G1/S期进展[18-19]。本研究通过实时荧光定量PCR和免疫印迹检测龙葵素对前列腺癌组织细胞周期蛋白、依赖性激酶和激酶抑制剂p21表达的影响,结果显示与对照组比较,龙葵素能显著抑制前列腺癌组织细胞周期蛋白CyclinD1, CyclinE1和周期蛋白依赖性激酶CDK4,CDK6的表达水平,显著升高P21的表达水平,表明龙葵素能够影响G1/S检测点调控信号,阻滞细胞G1/S期进展,抑制前列腺癌细胞的分裂增殖,抑制肿瘤细胞的裸鼠体内成瘤能力。
龙葵素是如何影响细胞周期G1/S检测点调控信号还有待进一步研究。国外有人在研究细菌生物碱staurosporine诱导PC12细胞凋亡机制中发现,staurosporine能引起胞内Ca2+水平的上升和ROS堆积[20]。龙葵素可能是通过诱导ROS的堆积导致细胞DNA损伤,从而诱导p21表达水平增高,抑制c-myc的表达,从而阻滞细胞G1/S期进展。细胞的死亡有两种形式,一种是病理性死亡,称为坏死;另外一种是生理性死亡或程序性死亡,称凋亡。细胞凋亡的途径有3种:死亡受体途径、线粒体途径和内质网途径。肿瘤细胞的无限生长是肿瘤细胞凋亡受到抑制的结果[21]。本研究通过Tunel原位凋亡检测表明,龙葵素能够诱导人前列腺癌裸鼠瘤体组织凋亡。细胞凋亡的过程极为复杂,龙葵素是通过何种方式调控细胞周期蛋白CyclinD、CyclinE、细胞周期蛋白依赖性激酶CDK4/6或CDK2的表达以及龙葵素激活细胞凋亡的具体途径,则仍需进一步的实验研究证明。
总之,本研究表明龙葵素可通过调控细胞周期G1/ S关卡促进组织细胞凋亡抑制前列腺癌细胞裸鼠体内成瘤能力,同时探讨了龙葵素体内抗前列腺癌的作用机制,为龙葵素应用于临床前列腺癌的治疗提供了实验基础。
| [1] |
Ye D, Zhu Y. Epidemiology of prostate cancer in China: an overview and clinical implication[J].
Chin J Surg,2015, 53 (4) : 249-52.
( 0) 0)
|
| [2] |
Sun S, Bai Y, Yang H, et al. Investigation on lower urinary tract symptoms (LUTS) in elderly patients with prostate cancer (PC) received endocrine therapy[J].
Arch Gerontol Geriatr,2015, 60 (3) : 535-7.
DOI: 10.1016/j.archger.2014.10.014. ( 0) 0)
|
| [3] |
Lin YH, Chen BY, Lai WT, et al. The Akt inhibitor MK-2206 enhances the cytotoxicity of paclitaxel (Taxol) and cisplatin in ovarian cancer cells[J].
Naunyn Schmiedebergs Arch Pharmacol,2015, 388 (1) : 19-31.
DOI: 10.1007/s00210-014-1032-y. ( 0) 0)
|
| [4] |
Wu C, Huang W, Guo Y, et al. Oxymatrine inhibits the proliferation of prostate cancer cells in vitro and in vivo[J].
Mol Med Rep,2015, 11 (6) : 4129-34.
( 0) 0)
|
| [5] |
Gao SY, Wang QJ, Ji YB. Effect of solanine on the membrane potential of mitochondria in HepG2 cells and[Ca2+]in the cells[J].
World J Gastroenterol,2006, 12 (21) : 59-67.
( 0) 0)
|
| [6] |
Morales F, Capuano E, Fogliano V. Mitigation strategies to reduce acrylamide formation in fried potato products[J].
Ann NY Acad Sci,2008, 1126 (4) : 89-100.
( 0) 0)
|
| [7] |
Harris H, Whittaker M. Differential inhibition of the serum cholinesterase phenotypes by solanine and solanidine[J].
Ann human genet,1962, 26 (7) : 73-6.
( 0) 0)
|
| [8] |
Golubeva SN. Experiences in the diagnosis of food allergy and it's treatment with solanine[J].
Vestn otorinolaringol,1966, 28 (6) : 23-7.
( 0) 0)
|
| [9] |
Xu GH, Shen J, Sun P, et al. Anti-inflammatory effects of potato extract on a rat model of cigarette smoke-induced chronic obstructive pulmonary disease[J].
Food nutrition res,2015, 59 (10) : 279-88.
( 0) 0)
|
| [10] |
Adamski Z, Adamski Z, Marciniak P, et al. Potato leaf extract and its component, alpha-solanine, exert similar impacts on development and oxidative stress in Galleria mellonella L[J].
Arch Insect Biochem Physiol,2014, 87 (1) : 26-39.
DOI: 10.1002/arch.v87.1. ( 0) 0)
|
| [11] |
Buyukguzel E, Buyukguzel K, Erdem M, et al. The influence of dietary alpha-solanine on the waxmoth Galleria mellonella L[J].
Arch Insect Biochem Physiol,2013, 83 (1) : 15-24.
DOI: 10.1002/arch.2013.83.issue-1. ( 0) 0)
|
| [12] |
Shen KH, Liao AC, Hung JH, et al. alpha-Solanine inhibits invasion of human prostate cancer cell by suppressing epithelialmesenchymal transition and MMPs expression[J].
Molecules,2014, 19 (8) : 11896-914.
DOI: 10.3390/molecules190811896. ( 0) 0)
|
| [13] |
Mohsenikia M, Alizadeh AM, Khodayari S, et al. The protective and therapeutic effects of alpha-solanine on mice breast cancer[J].
Eur J Pharmacol,2013, 718 (1-3) : 1-9.
DOI: 10.1016/j.ejphar.2013.09.015. ( 0) 0)
|
| [14] |
Abreu Velez AM, Howard MS. Tumor-suppressor Genes, Cell Cycle Regulatory Checkpoints, and the Skin[J].
N Am J Med Sci,2015, 7 (5) : 176-88.
DOI: 10.4103/1947-2714.157476. ( 0) 0)
|
| [15] |
Yang Y, Zhao Y, Ai X, et al. Formononetin suppresses the proliferation of human non-small cell lung cancer through induction of cell cycle arrest and apoptosis[J].
Int J Clin Exp Pathol,2014, 7 (14) : 8453-61.
( 0) 0)
|
| [16] |
Wu Z, Liu B, E C, et al. Resveratrol inhibits the proliferation of human melanoma cells by inducing G1/S cell cycle arrest and apoptosis[J].
Mol Med Rep,2015, 11 (1) : 400-4.
( 0) 0)
|
| [17] |
Zhang M, Sun G, Shen A, et al. Patrinia scabiosaefolia inhibits the proliferation of colorectal cancer in vitro and in vivo via G1/S cell cycle arrest[J].
Oncol Rep,2015, 33 (2) : 856-60.
( 0) 0)
|
| [18] |
Satyanarayana A, Hilton MB, Kaldis P. p21 Inhibits Cdk1 in the absence of Cdk2 to maintain the G1/S phase DNA damage checkpoint[J].
Mol Biol Cell,2008, 19 (1) : 65-77.
DOI: 10.1091/mbc.E07-06-0525. ( 0) 0)
|
| [19] |
Hall JR, Bereman MS, Nepomuceno AI, et al. C/EBPalpha regulates CRL4(Cdt2)-mediated degradation of p21 in response to UVB-induced DNA damage to control the G1/S checkpoint[J].
Cell Cycle,2014, 13 (22) : 3602-10.
DOI: 10.4161/15384101.2014.962957. ( 0) 0)
|
| [20] |
Kruman I, Guo Q, Mattson MP. Calcium and reactive oxygen species mediate staurosporine-induced mitochondrial dysfunction and apoptosis in PC12 cells[J].
J Neurosci Res,1998, 51 (3) : 293-308.
DOI: 10.1002/(ISSN)1097-4547. ( 0) 0)
|
| [21] |
Ko H, Kim JM, Kim SJ, et al. Induction of apoptosis by genipin inhibits cell proliferation in AGS human gastric cancer cells via Egr1/p21 signaling pathway[J].
Bioorg Med Chem Lett,2015, 25 (19) : 4191-6.
DOI: 10.1016/j.bmcl.2015.08.005. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
