睡眠占据着人类生命的三分之一,是一项非常重要的生理需求。它对于维护人类身心健康起着重要的作用,比如,睡眠参与机体新陈代谢、内分泌和免疫系统平衡的调节[1-3],还参与认知和学习记忆能力的强化[4-5],以及情绪的调节[6]等。睡眠剥夺是指由于环境因素或自身原因引起的睡眠时间减少或者缺失。当遭遇严重自然灾害、战争或者重大事故等情况时,人们常常出现睡眠障碍,以及疲惫、焦虑、惊恐和沮丧等心理问题,甚至在得到短暂休息之后上述症状仍然无法得到好转[7-8]。而经历这些痛苦和压力出现情绪调节异常的人们,往往忽视睡眠在其中所起的重要作用。虽有研究发现睡眠剥夺会增加罹患抑郁症的风险[9],但是其机制目前并不清楚。快速动眼睡眠(REMS)是睡眠的基本状态之一,本实验通过连续剥夺5 d小鼠的快速动眼睡眠,观察这种长时间睡眠剥夺后小鼠运动能力、抑郁样行为和杏仁核单胺氧化酶A(MAOA)的变化,以探讨连续长时间快速动眼睡眠剥夺对机体的影响。
1 资料和方法 1.1 实验动物120只健康C57BL/6J小鼠(SPF级,雄性,8周龄,25~28 g)由南方医科大学实验动物中心提供,许可证号:SCXK(粤)2011-2015。实验过程中室内温度控制在22±1℃,上午8:00开灯,昼夜周期为12 h。动物可自由进食饮水。
1.2 主要试剂MAOA抗体购自Santa Cruz公司;GAPDH抗体由SIGMA提供;山羊抗兔IgG/辣根酶标记、山羊抗小鼠IgG/辣根酶标记购自北京中山金桥生物技术有限公司提供;DEPC水、Trizol、RT试剂盒、定量PCR试剂盒均由Takara提供。
1.3 主要仪器及设备蛋白电泳仪、凝胶成像仪均购自Bio-Rad提供;紫外分光光度计由日本岛津公司提供;PCR仪购自Eppendorf;定量PCR仪由Agilent提供。
1.4 方法 1.4.1 快速动眼睡眠剥夺(REMSD)C57BL/6J小鼠适应实验室环境1周后,经体质量和旷场实验初筛出体质量和行为得分近的小鼠120只,随机分成3组(每组40只):空白对照(Baseline)组、大平台对照(Control)组和快速动眼睡眠剥夺(REMSD)组。Baseline组在整个实验过程中于正常鼠笼饲养且不做任何处理。Control组被置于含有6个正方体大平台(边长6 cm)的鼠笼中;REMSD组动物被置于含有12个圆柱体平台(直径1.5 cm,高7 cm)的鼠笼中,两组均加水至台下1 cm。Control组和REMSD组小鼠都能够在平台之间自由移动、进食和饮水。REMSD组小鼠站立在小平台上,当它进入快速动眼睡眠时,由于全身肌肉松弛而掉入水中,由于对水环境的恐惧,小鼠会迅速爬上平台,由此便完全剥夺了小鼠的快速动眼睡眠;Control组小鼠睡觉时不会掉落水中。本实验REMSD时间为5 d,从第1天的12:00至第6天的12:00。所有动物在睡眠剥夺结束后回到原鼠笼饲养。
1.4.2 行为学检测上述3组小鼠,每组30只,再分成3个小组,分别编号为第1小组、第2小组和第3小组,每小组10只。睡眠剥夺结束后24、48、72 h分别对每组的第1小组、第2小组和第3小组进行行为学检测。首先进行旷场实验,每小组小鼠每隔72 h测一次运动能力,直到结果提示各组小鼠运动能力无差异以后,开始加入强迫游泳实验。强迫游泳实验安排在上述旷场实验休息24 h后进行,直到睡眠剥夺后第14天。另外,每组剩下的10只小鼠,在睡眠剥夺结束96 h后(此时3组运动能力已无差异),进行糖水偏好实验。
旷场实验(OFT)使用白色敞箱(70 cm×70 cm×40 cm)进行。开始前1 h将待检测小鼠放入实验房间适应。检测时,将小鼠放入敞箱中心位置,记录小鼠30 min内经过的总路程。每只小鼠结束实验后放回原笼,清除敞箱里粪便和尿液,并用75%酒精擦拭,以消除残留气味对下一只实验小鼠的影响。
强迫游泳实验(FST)采用水深20 cm,水温23℃的有机玻璃缸(直径14 cm,高40 cm)进行。开始前1 h将小鼠放入实验房间适应环境。实验时将小鼠放入缸中,小鼠在玻璃缸中游泳6 min,记录后4 min小鼠累计不动时间(Immobility time)。不动时间指小鼠呈现不挣扎、漂浮状态,或者仅有肢体的细小运动以保持头部浮于水面的时间。
糖水偏好实验(SPT)从睡眠剥夺结束后第4天开始,每笼使用两个100 mL带弯嘴的玻璃瓶分别盛50 mL 1%蔗糖溶液或者纯水。实验前,小鼠需单笼双瓶饮水适应4 d,且每隔24 h交换水瓶位置,适应的前2 d两瓶都装糖水,后2 d两瓶都装纯水。禁食禁水24 h后,正式开始实验。实验第1天给予小鼠1瓶纯水1瓶糖水,测量24 h水瓶重量变化以计算液体消耗量;第2天,交换纯水和糖水位置,再次测量。计算每天的糖水偏好率[糖水偏好率=糖水消耗量(/糖水消耗量+纯水消耗量)×100%],取两天的平均值。
1.4.3 Western blotting和Real-time PCR检测每组随机取3只小鼠,于所有行为实验结束后立刻处死,取脑,于冰上分离出两侧杏仁核,样品保存于-80℃冰箱,分别用于Western blotting和Real-time PCR检测。Western blotting检测所需的各组样品于冰上提取总蛋白后,BCA法进行总蛋白定量,计算出每份样品所需总蛋白体积并制样。取每孔20μg蛋白样品经10% SDS-PAGE胶分离后湿转至PVDF膜,室温封闭1 h后,加入相应一抗,4℃孵育过夜。TBST洗膜3次后,加入对应二抗,室温孵育1 h,洗膜后使用ECL显色系统检测目的蛋白。
Real-time PCR检测所需的各组样品以Trizol法低温下提取组织RNA,紫外分光光度仪测定RNA浓度,各取500 ng RNA,进行逆转录反应,得到cDNA样品,利用特异性引物和Real-time PCR反应,检测目的基因表达情况(表 1)。
| 表 1 Real-time PCR的引物 Table 1 Primers for real-time PCR |
数据均应用SPSS13.0软件进行统计学处理,采用均数±标准差表示。两组间比较使用t检验,两组以上组间比较使用One-way ANOVA检验进行分析。当P<0.05时认为差异有统计学意义。
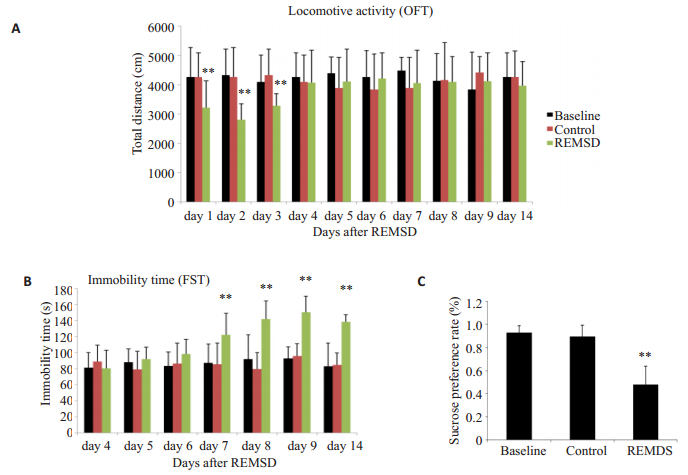
2 结果 2.1 快速动眼睡眠剥夺导致迟发性抑郁样行为(1)30 min旷场实验结果显示快速动眼睡眠剥夺5 d后的1~3 d内,REMSD组小鼠运动能力与Baseline组和Control组相比明显降低(P<0.01,图 1A),而在第4天以后运动能力恢复到正常水平;(2)强迫游泳实验结果显示快速动眼睡眠剥夺后4~6 d REMSD组小鼠的不动时间与Baseline组和Control组并无差异,第7~14天REMSD组小鼠的不动时间明显高于另外两组(P<0.01,图 1B);(3)糖水偏好实验结果显示快速动眼睡眠剥夺后第8~9天REMSD组小鼠的糖水偏好率较Baseline组和Control组明显降低,差异显著(P<0.01,图 1C)。
|
图 1 快速动眼睡眠剥夺对小鼠运动能力和抑郁样行为的影响 Figure 1 Effect of REMSD on locomotor ability and the depression-like behavior in mice. A: Total distance in 30 min in open field test after REMSD; B: Immobility time of the mice after REMSD in FST test; C: Sucrose preference rate of mice on days 8 and 9 after REMSD. Data are presented as Mean±SD. **P < 0.01 vs control (n=10 in each group). |
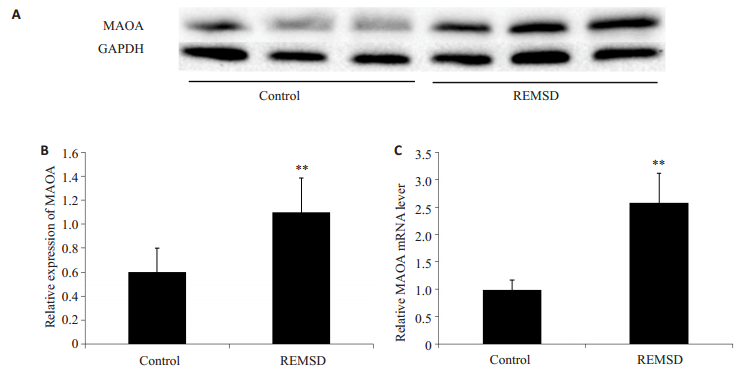
当小鼠睡眠剥夺结束14 d之后,取杏仁核进行Western blot(图 2A-B)和Real-time PCR(图 2C)检测,结果发现该部位的MAOA在REMSD组较Control组明显增多(t=4.949,P=0.008);而MAOA mRNA也显著增加(t=-9.467,P=0.001)。
|
图 2 快速动眼睡眠剥夺对小鼠杏仁核MAOA表达的影响 Figure 2 Effect of REMSD on expression of MAOA in the amygdale. A, B: Western blot of MAOA protein; C: Real-time PCR of MAOA mRNA level relative toβ-Actin mRNA. Data are presented as Mean±SD. **P < 0.01 vs control (n=3 in each group). |
睡眠包括两个基本状态,即非快速动眼睡眠和快速动眼睡眠,前者的主要作用是恢复体力,调节激素分泌;后者的主要作用是巩固记忆,调节情绪,对恢复大脑高级功能非常重要[10-11]。快速动眼睡眠剥夺会给大脑带来一系列的不良影响,其中包括增加炎症反应,扰乱递质系统功能,抑制神经营养因子分泌和突触可塑性,以及破坏神经内分泌系统平衡等[12-16],上述病理生理变化都与抑郁症的发生有着密切联系[16-17]。在对抑郁患者的研究中还发现,患者的快速动眼睡眠时间缩短,呈现出睡眠碎片化的变化[18-19]。
目前很多研究认为,短时间睡眠剥夺可以改善抑郁患者或抑郁动物的抑郁症状[20],但是这些研究所剥夺睡眠的时间基本在72 h以内,而且患者恢复睡眠后,抑郁症状立即再次出现,部分患者甚至比睡眠剥夺前更加严重[21]。关于更长时间的异相睡眠剥夺,如72、96 h或更长时间的研究多为睡眠限制(即只剥夺每天固定时间的异相睡眠,而不是剥夺全部),并且多集中于氧化应激和学习、记忆等领域[22-24],对睡眠剥夺尤其是连续长时间选择性REM睡眠剥夺与抑郁症的相互关系尚不明确。
我们连续5 d剥夺小鼠快速动眼睡眠,模拟了人类在战争、地震、洪水等特殊环境下被剥夺快速动眼睡眠的状态。经历上述特殊情况的人们往往会发生创伤后应激障碍(PTSD)。有研究发现创伤后应激障碍合并抑郁症发病率高达75%,这种抑郁症状呈现出延迟的特点,且经历严重创伤事件的PTSD患者出现睡眠障碍的现象同样非常普遍[25-26]。还有研究发现氟西汀、帕罗西汀和文拉法辛等抗抑郁药对PTSD同样有效,且能够缓解患者的睡眠障碍[27]。但是,目前对3者之间的关系并不清楚。在本实验中我们发现,睡眠剥夺结束后的3 d内,小鼠的运动能力明显受损,而从第4天开始基本恢复。这一结果与人类经历长时间睡眠剥夺后需要足够时间休息才能消除全身无力的现象相类似。有意思的是,REMSD组小鼠在睡眠剥夺结束后7 d开始在强迫游泳实验和糖水偏好实验中均表现出迟发性的抑郁样行为。这种表现在动物实验中极易被忽视,所以到目前为止未有类似报道。该发现对于研究睡眠剥夺、PTSD和抑郁症之间关系是一个有益提示。
杏仁核的单胺类递质与抑郁症关系密切。杏仁核位于颞叶背内侧部,是边缘系统的重要部分,其主要作用是产生情绪和调节情绪,损坏杏仁核会导致缺乏对恐惧事件的辨识和反应[28-29]。有研究发现杏仁核中5-HT和多巴胺依赖的突触可塑性被抑制与抑郁症有关[28],且许多抗抑郁药物可以通过抑制分解或再摄取调节杏仁核神经元突触间单胺类递质的水平来达到治疗抑郁症的效果[30]。而杏仁核神经元产生的MAOA是单胺类递质代谢的关键酶。在本实验中,我们发现小鼠经过5 d快速动眼睡眠剥夺后第7~14天小鼠表现出抑郁样行为,同时杏仁核中MAOA和MAOA mRNA较对照组明显增加。因而我们猜测可能是杏仁核中MAOA的表达增加打破大脑中递质平衡,造成大脑功能异常,从而导致小鼠抑郁样行为。以此推测,PTSD患者经历严重创伤情况下出现的延迟性抑郁症状,可能不仅与其痛苦经历有关,而且与睡眠剥夺有着密切关系,但是导致这种现象的具体机制尚需进一步研究。
本实验首次发现了连续5 d快速动眼睡眠剥夺可以导致小鼠迟发性抑郁样行为,还发现该现象很可能与杏仁核MAOA表达水平变化有关,为更好地研究快速动眼睡眠剥夺与PTSD合并抑郁症之间的关系提供一个有效模型,也为探究迟发性抑郁样行为的发生机制提供了实验依据。
| [1] |
Seetho IW, Wilding JP. Sleep-disordered breathing, type 2 diabetes and the metabolic syndrome[J].
Chron Respir Dis,2014, 11 (4) : 257-75.
DOI: 10.1177/1479972314552806. ( 0) 0)
|
| [2] |
Morgan D, Tsai SC. Sleep and the endocrine system[J].
Crit Care Clin,2015, 31 (3) : 403-18.
DOI: 10.1016/j.ccc.2015.03.004. ( 0) 0)
|
| [3] |
Ibarra-Coronado EG, Pantaleón-Martínez AM, VelazquézMoctezuma J, et al. The bidirectional relationship between sleep and immunity against infections[J].
J immunol res,2015, 8 (12) : 678164.
( 0) 0)
|
| [4] |
Muehlhan M, Marxen M, Landsiedel J, et al. The effect of body posture on cognitive performance: a question of sleep quality[J].
Front Hum Neurosci,2014, 8 (7) : 171.
( 0) 0)
|
| [5] |
Euston DR, Neuroscience SH. Memories--getting wired during sleep[J].
Science,2014, 344 (6188) : 1087-8.
DOI: 10.1126/science.1255649. ( 0) 0)
|
| [6] |
Kimura M, Curzi ML, Romanowsi CP. REM sleep alteration and depression[J].
Arch Ital Biol,2015, 152 (2/3) : 111-7.
( 0) 0)
|
| [7] |
Tempesta D, Curcio G, De Gennaro L, et al. Long-term impact of earthquakes on sleep quality[J].
PLoS One,2013, 8 (2) : e55936.
DOI: 10.1371/journal.pone.0055936. ( 0) 0)
|
| [8] |
Geng F, Fan F, Mo L, et al. Sleep problems among adolescent survivors following the 2008 Wenchuan earthquake in China: a cohort study[J].
J Clin Psychiatry,2013, 74 (1) : 67-74.
DOI: 10.4088/JCP.12m07872. ( 0) 0)
|
| [9] |
Pan XF, Wen Y, Zhao Y, et al. Prevalence of depressive symptoms and its correlates among medical students in China: a National survey in 33 universities[J].
Psychol Health Med,2015, 32 (5) : 1-8.
( 0) 0)
|
| [10] |
Engle-Friedman M. The effects of sleep loss on capacity and effort[J].
Sleep Sci (Sa?o Paulo, Brazil),2014, 7 (4) : 213-24.
( 0) 0)
|
| [11] |
Sinha S, Jhaveri R, Banga A. Sleep disturbances and behavioral disturbances in children and adolescents[J].
Psychiatr Clin North Am,2015, 38 (4) : 705-21.
DOI: 10.1016/j.psc.2015.07.009. ( 0) 0)
|
| [12] |
Hurtado-Alvarado G, Pavón L, Castillo-García SA, et al. Sleep loss as a factor to induce cellular and molecular inflammatory variations[J].
Clin Dev Immunol,2013, 25 (6) : 801341.
( 0) 0)
|
| [13] |
Gómez-González B, Domínguez-Salazar E, Hurtado-Alvarado G, et al. Role of sleep in the regulation of the immune system and the pituitary hormones[J].
Ann NY Acad Sci,2012, 1261 (4) : 97-106.
( 0) 0)
|
| [14] |
Schmitt K, Holsboer-Trachsler E, Eckert A. BDNF in sleep, insomnia, and sleep deprivation[J].
Ann Med,2016, 48 (1/2) : 42-51.
( 0) 0)
|
| [15] |
Hajali V, Sheibani V, Ghazvini H, et al. Effect of castration on the susceptibility of male rats to the sleep deprivation-induced impairment of behavioral and synaptic plasticity[J].
Neurobiol Learn Mem,2015, 123 (9) : 140-8.
( 0) 0)
|
| [16] |
Maletic V, Robinson M, Oakes T, et al. Neurobiology of depression: an integrated view of key findings[J].
Int J Clin Pract,2007, 61 (12) : 2030-40.
DOI: 10.1111/ijcp.2007.61.issue-12. ( 0) 0)
|
| [17] |
Pavón L, Sandoval-López G, Eugenia Hernández M, et al. Th2 cytokine response in Major Depressive Disorder patients before treatment[J].
J Neuroimmunol,2006, 172 (1/2) : 156-65.
( 0) 0)
|
| [18] |
Shahsavand-Ananloo E, Berenji F, Sadeghniiat K, et al. Comparing effects of citalopram with fluoxetine on sleep quality in patients with major depressive disorder[J].
Eur Rev Med Pharmacol Sci,2013, 17 (9) : 1155-61.
( 0) 0)
|
| [19] |
Arana-Lechuga Y, Nuñez-Ortiz R, Terán-Pérez G, et al. Sleep-EEG patterns of school children suffering from symptoms of depression compared to healthy controls[J].
World J Biol Psychiatry,2008, 9 (2) : 115-20.
DOI: 10.1080/15622970701216665. ( 0) 0)
|
| [20] |
Wirz-Justice A, Terman M, Oren DA, et al. Brightening depression[J].
Science,2004, 303 (5657) : 467-9.
( 0) 0)
|
| [21] |
Berger M, Riemann D. Symposium: normal and abnormal REM sleep regulation: REM sleep in depression-an overview[J].
J Sleep Res,1993, 2 (4) : 211-23.
DOI: 10.1111/jsr.1993.2.issue-4. ( 0) 0)
|
| [22] |
Chang HM, Liao WC, Sheu JN, et al. Sleep deprivation impairs Ca2 + expression in the hippocampus: Ionic imaging analysis for cognitive deficiency with TOF-SIMS[J].
Microsc Microanal,2012, 18 (3) : 425-35.
DOI: 10.1017/S1431927612000086. ( 0) 0)
|
| [23] |
Chen C, Hardy M, Zhang J, et al. Altered NMDA receptor trafficking contributes to sleep deprivation-induced hippocampal synaptic and cognitive impairments[J].
Biochem Biophys Res Commun,2006, 340 (2) : 435-40.
DOI: 10.1016/j.bbrc.2005.12.021. ( 0) 0)
|
| [24] |
Scott JP, Mcnaughton LR, Polman RC. Effects of sleep deprivation and exercise on cognitive, motor performance and mood[J].
Physiol Behav,2006, 87 (2) : 396-408.
DOI: 10.1016/j.physbeh.2005.11.009. ( 0) 0)
|
| [25] |
Goenjian AK, Pynoos RS, Steinberg AM, et al. Psychiatric comorbidity in children after the 1988 earthquake in Armenia[J].
J Am Acad Child Adolesc Psychiatry,1995, 34 (9) : 1174-84.
DOI: 10.1097/00004583-199509000-00015. ( 0) 0)
|
| [26] |
Başoğlu M, Kiliç C, Salcioğlu E, et al. Prevalence of posttraumatic stress disorder and comorbid depression in earthquake survivors in Turkey: an epidemiological study[J].
J Trauma Stress,2004, 17 (2) : 133-41.
DOI: 10.1023/B:JOTS.0000022619.31615.e8. ( 0) 0)
|
| [27] |
Sijbrandij M, Kleiboer A, Bisson JI, et al. Pharmacological prevention of post-traumatic stress disorder and acute stress disorder: a systematic review and meta-analysis[J].
The lancet. Psychiatry,2015, 2 (5) : 413-21.
DOI: 10.1016/S2215-0366(14)00121-7. ( 0) 0)
|
| [28] |
Jenkins LM, Kassel MT, Gabriel LB, et al. Amygdala and dorsomedial hyperactivity to emotional faces in youth with remitted Major Depression[J].
Soc Cogn Affect Neurosci,2016, 11 (5) : 736-45.
DOI: 10.1093/scan/nsv152. ( 0) 0)
|
| [29] |
Kwon OB, Lee JH, Kim HJ, et al. Dopamine regulation of amygdala inhibitory circuits for expression of learned fear[J].
Neuron,2015, 88 (2) : 378-89.
DOI: 10.1016/j.neuron.2015.09.001. ( 0) 0)
|
| [30] |
Peciña M, Bohnert AS, Sikora M, et al. Association between Placebo-Activated neural systems and antidepressant responses: neurochemistry of placebo effects in major depression[J].
JAMA Psychiatry,2015, 72 (11) : 1087-94.
DOI: 10.1001/jamapsychiatry.2015.1335. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
