“二次打击学说”是非酒精性脂肪性肝病(NAFLD)的重要发病机制。其中“第一次打击”指的是脂肪在肝细胞内的沉积,而“第二次打击”则通过氧化应激反应及炎症因子释放导致肝细胞炎症及坏死[1]。氧化应激反应是指细胞功能失调导致的活性氧(reactive oxygen species, ROS)及其代谢产物产生增多[2],其中ROS的生成包括线粒体及NOX途径[3]。近来研究发现,炎症因子IL-1β可由炎症小体的激活产生[4]。目前普遍认为,NAFLD的发生发展可能由血浆中的游离脂肪酸,尤其是饱和脂肪酸的过度堆积导致,其中棕榈酸(palmitic acid, PA)是饱和脂肪酸家族的重要成员之一。目前有研究表明,棕榈酸可通过损伤线粒体氧化呼吸链的正常功能[5],导致细胞发生氧化应激反应。另一方面,已有研究证实PA激活NOX4参与了肝细胞的胰岛素抵抗[6]以及内皮细胞的损伤[7]和功能失调[8],且通过促进IL-8释放导致肝细胞的炎症反应[9]。而棕榈酸在肝细胞中的过度堆积在NAFLD的发展过程中能否通过激活NOX4导致氧化应激反应,又能否通过氧化应激反应激活炎症小体使肝细胞炎症因子IL-1β产生增加,目前尚缺乏相关研究探讨。本实验采用AML12小鼠正常肝细胞系观察棕榈酸对肝细胞氧化应激及炎症小体的影响,以探讨氧化应激及炎症小体对肝细胞脂肪变性的作用,并为NAFLD的治疗提供新思路。
1 材料和方法 1.1 材料AML12小鼠肝细胞系购于ATCC细胞库。DMEM高糖培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),棕榈酸(PA,美国Sigma公司),N-乙酰半胱氨酸(NAC,美国Sigma公司),NOX4,NLRP3,ASC,caspase-1,单克隆抗体(美国Santa Cruz公司),GADPH抗体,辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG(北京中杉金桥生物技术有限公司),DCFH-DA活性氧检测试剂盒(南京建成生物工程研究所),MitoSOX线粒体超氧化物荧光指示剂(美国Introvigen公司),Mitotracker Deep Red线粒体荧光探针(美国Introvigen公司),TRITC标记荧光二抗(德国Earthox公司),ELISA试剂盒(RayBio Rat IL-1βELISA Kit)。
1.2 方法 1.2.1 细胞培养AML12细胞培养于含10%FBS的DMEM培养基中,置于37℃,5% CO2饱和湿度培养箱常规培养。实验时,将处于对数生长期的细胞用0.25%含EDTA的胰酶消化并吹打成细胞悬液,根据实验需要铺板处理。
1.2.2 实验分组及处理为了探讨不同浓度的PA对AML12细胞的影响,将AML12分为以下各浓度处理组:空白对照组组,0.15 mmol/L PA组,0.25 mmol/L PA组,0.4 mmol/L PA组。为了探讨活性氧对炎症小体的调节作用,将AML12细胞分为以下3组进行干预:空白对照组,PA组,PA+NAC组,其中PA为0.25 mmol/L,活性氧清除剂NAC(N-乙酰半胱氨酸)为10 mmol/L[10-11],NAC预处理细胞1 h后,再加入PA处理24 h。
1.2.3 检测指标及方法 1.2.3.1 细胞油红O染色将细胞种于铺有10 mm×10 mm的盖玻片上,予药物处理后,弃去原有培养基,用4%多聚甲醛固定20 min后,予油红O染色30 min,苏木素染色5 min后蒸馏水清洗,甘油明胶封片,在光学显微镜下观察。
1.2.3.2 细胞ROS检测将细胞种植于96孔板中,使每孔细胞数量为104,每组至少重复3个复孔,予药物刺激24 h后,吸去培养基,用PBS洗3次;将DCFH-DA以1:1000的比例稀释于DMEM中,以每孔200μL加入96孔板中,37℃孵育30 min;将探针吸去,用PBS洗3次;使用多功能酶标仪(SpectraMax M3)检测,使用488 nm激发波长,525 nm发射波长,记录A值。
1.2.3.3 流式细胞术检测细胞线粒体ROS用无血清DMEM培养液稀释MitoSOX荧光探针储存液,使其工作浓度为5μmol/L。将细胞铺于6孔板中,用相应刺激处理细胞24 h后,吸去原有培养基,加入稀释好的MitoSOX荧光探针,37℃细胞培养箱内孵育20 min。将细胞消化成悬液,PBS洗涤3次,将细胞悬液加入流式管内,用流式细胞仪以激发波长510 nm,发射波长580 nm检测细胞荧光强度。
1.2.3.4 免疫荧光共聚焦检测蛋白在细胞内的定位及表达将细胞在10 mm×10 mm的盖玻片上黏附生长,分组刺激24 h后,移去原有培养基,用稀释5000倍的Mitotracker Deep Red荧光探针于37℃孵育20 min后,用4%多聚甲醛固定15 min再用0.5% TritonX-100孵育5 min。5% BSA封闭1h后用1%BSA稀释的NOX4抗体(1:50)孵育,4℃过夜。次日用PBS洗细胞3次,每次5 in,37℃孵育TRITC标记抗山羊二抗(1:100)2 h,DAPI染色后用抗荧光淬灭封片剂封片。激光共聚焦显微镜观察胞内定位。
1.2.3.5 Western Blotting检测蛋白在细胞中的表达将细胞铺于6孔板中,予相应药物刺激,刺激结束后吸去培养基,用PBS润洗3次后,每孔加入200μL蛋白抽提剂(每1 mL蛋白质裂解液中加10μL PMSF),用细胞刮将抽提剂均匀分布于板底部,冰上静置20 min后,收集裂解液并在4℃离心机中12 000 g离心30 min,取出上清液,用BCA法测定蛋白浓度,后按蛋白体积:5×loading buffer体积比4:1混合两者,在100℃沸水中煮5 min,以每孔30μg蛋白的量上样于12%SDS-PAGE进行电泳,电泳完毕后将蛋白转至PVDF膜,后用5%脱脂牛奶封闭1 h,然后根据所检测目的蛋白的相对分子质量将PVDF膜分别加入NLRP3抗体(1:500)、ASC抗体(1:500)、caspase-1抗体(1:1000)或GADPH抗体(1:5000)中,上述抗体用一抗稀释液稀释,于4℃孵育过夜。次日取出膜,用TBST清洗3次,每次10 min,再用相应HRP标记的二抗室温下孵育1.5 h,显影,记录结果。
1.2.3.6 IL-1β含量的检测将细胞种植于6孔板中,贴壁后予相应药物刺激,并保证每个孔的培养基体积一致,均为2 mL,刺激结束后吸取培养基,2000 r/min离心5 min,取出上清液,用酶联免疫吸附法(ELISA)检测IL-1β的浓度。
1.2.4 统计分析结果以Mean±SE表示,数据采用SPSS20.0软件进行分析,组间比较采用独立样本t检验,显著性检验标准为P<0.05。
2 结果 2.1 棕榈酸对激活肝细胞炎症小体的浓度效应用不同浓度的棕榈酸刺激肝细胞24 h后,Western Blotting检测肝细胞中炎症小体各组分的表达,发现0.25 mmol/L的棕榈酸刺激肝细胞,可使NLRP3、ASC及caspase-1的表达最多(图 1),故下述实验选用0.25 mmol/L的PA进行。
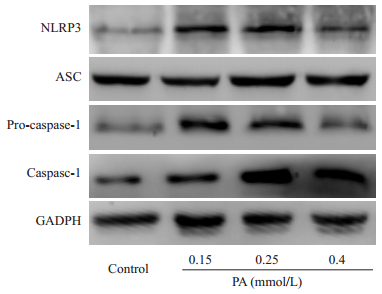
|
图 1 棕榈酸对肝细胞炎症小体的激活作用具有一定的浓度依赖性 Figure 1 Dose-dependent effect of PA in activating inflammasomes in hepatocytes. |
将肝细胞进行油红O染色后,显微镜下观察,发现PA组的肝细胞胞质中可见大量明显的被染成红色的脂滴,而空白对照组未见脂滴沉积(图 2)。
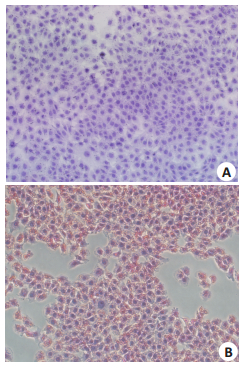
|
图 2 棕榈酸导致脂滴在肝细胞中沉积 Figure 2 PA treatment induces lipid accumulation in hepatocytes (Original magnification:×200). A: Control group; B: PA treatment group. |
用DCFH-DA探针标记后检测可知,PA处理后的肝细胞总ROS表达较空白对照组显著升高(12463.09±2.72 vs 6691.23±2.45,P=0.00),差异有统计学意义(图 3A),而用MitoSOX荧光探针检测亦发现PA处理后的肝细胞,其线粒体来源的ROS表达较空白对照组显著升高(64.98±0.94 vs 45.04±0.92,P=0.00),差异具有统计学意义(图 3B)。
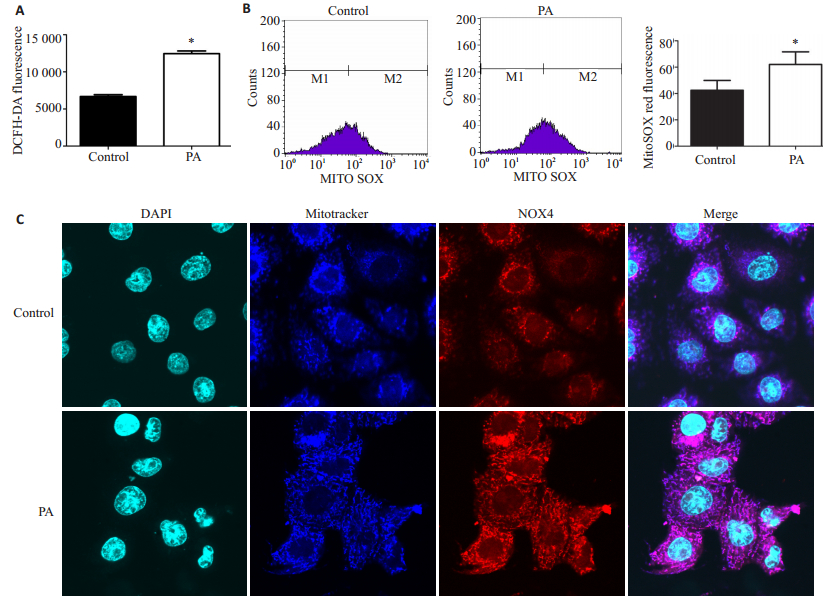
|
图 3 棕榈酸可导致细胞活性氧产生增加 Figure 3 PA induces ROS production in hepatocytes. A: Hepatocellular ROS expression detected by DCFH-DA probe; B: Mitochondrion-derived ROS detected by MitoSOX fluorescence probe; C: Expression and location of NOX4 and mitochondria observed by confocal microscopy. *P < 0.05 vs control group. |
激光共聚焦结果表明,肝细胞线粒体及NOX4均定位于细胞质中,且线粒体与NOX4存在共定位的现象,而PA处理后的肝细胞NOX4荧光强度较空白对照组显著增加(图 3C)。进一步用Western Blotting检测提示,PA处理后的肝细胞,其蛋白中NOX4的表达较空白对照组增加(图 4A)。
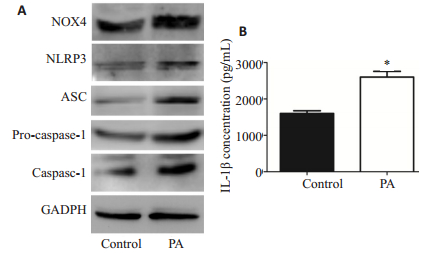
|
图 4 棕榈酸可诱导NOX4、炎症小体各组分及IL-1β表达 Figure 4 PA treatment increases expressions of NOX4, inflammasomes and IL-1β. A: NOX4 and inflammasomes expression in hepatocytes detected by western blotting; B: Expression of IL-1βdetected by ELISA. *P < 0.05 vs control group. |
Western Blotting检测提示,经PA处理24 h后的小鼠肝细胞,其炎症小体各组分,包括NLRP3、ASC、pro-caspase-1及caspase-1的表达均较空白对照组增加(图 4A),且ELISA检测亦显示炎症小体激活的下游炎症因子IL-1β形成及分泌增加(1603.52±1.32 vs 2629.33±2.57,P=0.00,图 4B)。
2.6 抗氧化剂NAC对肝细胞ROS及炎症小体的影响DCFH-DA探针标记后检测可知,PA+NAC处理组的肝细胞总ROS表达较PA组显著降低(7782.15±2.87 vs 5445.6±1.17,P=0.00)(图 5A),而Western Blotting检测提示,PA+NAC组的肝细胞炎症小体各组分的的表达均较PA组显著减少(图 5B)。
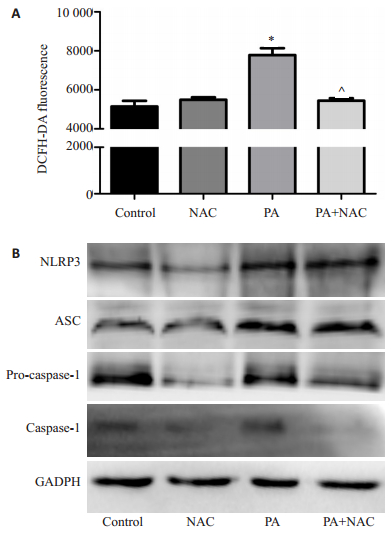
|
图 5 NAC可抑制棕榈酸导致的肝细胞活性氧产生及炎症小体激活 Figure 5 NAC inhibits the production of ROS and activation of inflammasomes induced by PA in hepatocytes. A: Hepatocellular ROS expression detected by DCFH-DA probe; B: Inflammasomes expression detected by Western blotting. *P < 0.05 vs control group; ^P < 0.05 vs PA treatment group. |
棕榈酸作为一种长链饱和脂肪酸,是血脂是重要的组成成分,参与了NAFLD的发生[12]。在正常情况下,线粒体可以通过脂肪酸β-氧化将细胞内过量的脂肪酸分解,并产生ATP供能,同时,电子呼吸链也会产生一定量的ROS [13-14]。而ROS的过量产生则会引起线粒体结构和功能的损伤,使电子呼吸链功能受损,进一步使细胞氧化应激反应增强,并导致脂肪酸分解功能障碍,使脂肪酸沉积于细胞质中[15]。本研究我们亦发现,在PA的作用下,肝细胞中可见明显的脂肪颗粒沉积,且细胞总ROS及线粒体来源的ROS产生显著增加,证实了PA可引起线粒体氧化应激反应并导致肝细胞脂肪变性。
另一方面,NOX家族的激活也是细胞ROS产生的重要来源,其中,NOX4是NOX复合体中的活性组分,它在成纤维细胞[16]及肾小球系膜细胞[17]中的激活可以引起ROS的产生增加,且在乳腺癌细胞[18]及血管内皮细胞[19]中能调节线粒体DNA的复制及修复,并参与线粒体ROS的产生。在肝脏中,NOX4可参与四氯化碳诱导的肝星状细胞的增殖,促进肝脏纤维化[20]。而我们在研究中发现,棕榈酸的沉积可引起肝细胞中NOX4表达增加,且NOX4定位于细胞质中,与线粒体存在共定位现象。说明NOX4亦参与了棕榈酸诱导的肝细胞氧化应激反应,且可能与线粒体共同参与调节肝细胞中ROS的产生。
NAFLD的发展过程中,由单纯性脂肪肝进展为NASH的过程需要炎症因子的参与。研究表明,棕榈酸可通过激活NF-κB及JNK/AP-1以促进IL-8的分泌[21],引起肝细胞的炎症反应,促进NASH的发生。近年来,关于炎症小体的研究逐渐成为热点,研究发现炎症小体参与了包括慢性丙型肝炎、肝脏缺血-再灌注损伤以及药物引起的肝损伤的病理过程[22]。既往研究表明[23],棕榈酸在作用于内皮细胞时,可通过引起细胞氧化应激反应激活炎症小体。本实验发现,在肝细胞中,棕榈酸亦可引起炎症小体各组分,包括NLRP3、ASC及caspase-1的表达增加,并促进其下游的IL-1β分泌增加,且抗氧化剂NAC可有效抑制炎症小体的表达。提示棕榈酸在引起肝细胞脂肪变性的同时,可以通过激活炎症小体的途径导致肝细胞的炎症反应,且氧化应激反应与炎症小体的激活直接相关。
综合上述结果,我们可以认为,在肝细胞脂肪变性的发生过程中,饱和脂肪酸的过度沉积会作为“第一次打击”,引起下游的线粒体功能损伤并激活NOX4的表达,使细胞发生氧化应激反应,ROS产生增加,继而进一步抑制细胞生理功能,影响正常的脂肪代谢过程,加剧脂肪沉积。而另一方面,棕榈酸可以引起肝细胞炎症小体的激活及炎症因子的释放,导致细胞的炎症反应。上述过程均可作为NAFLD发生的“第二次打击”,促进NAFLD的发展,故寻求阻断上述病理过程的有效药物,是抑制NAFLD发生发展的重要方法和潜在新思路。
| [1] |
Day CP, James OF. Steatohepatitis: a tale of two "hits"?[J].
Gastroenterology,1998, 114 (4) : 842-5.
DOI: 10.1016/S0016-5085(98)70599-2. ( 0) 0)
|
| [2] |
Li S, Tan HY, Wang N, et al. The role of oxidative stress and antioxidants in liver diseases[J].
Int J Mol Sci,2015, 16 (11) : 26087-124.
DOI: 10.3390/ijms161125942. ( 0) 0)
|
| [3] |
Shen GX. Oxidative stress and diabetic cardiovascular disorders: roles of mitochondria and NADPH oxidase[J].
Can J Physiol Pharmacol,2010, 88 (3) : 241-8.
DOI: 10.1139/Y10-018. ( 0) 0)
|
| [4] |
Stienstra R, Van Diepen JA, Tack CJ, et al. Inflammasome is a central player in the induction of obesity and insulin resistance[J].
Proc Natl Acad Sci USA,2011, 108 (37) : 15324-9.
DOI: 10.1073/pnas.1100255108. ( 0) 0)
|
| [5] |
Win S, Tin AT, Le BH, et al. Sab (Sh3bp5) dependence of JNK mediated inhibition of mitochondrial respiration in palmitic acid induced hepatocyte lipotoxicity[J].
J Hepatol,2015, 62 (6) : 1367-74.
DOI: 10.1016/j.jhep.2015.01.032. ( 0) 0)
|
| [6] |
Oh JM, Choi JM, Lee JY, et al. Role of NADPH oxidase-4 in saturated fatty acid-induced insulin resistance in SK-Hep-1 cells[J].
Food Chem Toxicol,2014, 63 : 128-35.
DOI: 10.1016/j.fct.2013.10.049. ( 0) 0)
|
| [7] |
Maloney E, Sweet IR, Hockenbery DM, et al. Activation of NF-kappa B by Palmitate in Endothelial Cells A Key Role for NADPH Oxidase-Derived Superoxide in Response to TLR4 Activation[J].
Arterioscler Thromb Vasc Biol,2009, 29 (9) : 1370-5.
DOI: 10.1161/ATVBAHA.109.188813. ( 0) 0)
|
| [8] |
Zhang M, Wang CM, Li J, et al. Berberine protects against palmitate-induced endothelial dysfunction: involvements of upregulation of AMPK and eNOS and downregulation of NOX4[J].
Mediators Inflamm,2013 : 260464.
( 0) 0)
|
| [9] |
Ganji SH, Kashyap ML, Kamanna VS. Niacin inhibits fat accumulation, oxidative stress, and inflammatory cytokine IL-8 in cultured hepatocytes: Impact on non-alcoholic fatty liver disease[J].
Metabolism,2015, 64 (9) : 982-90.
DOI: 10.1016/j.metabol.2015.05.002. ( 0) 0)
|
| [10] |
Kastl L, Sauer SW, Ruppert T, et al. TNF-alpha mediates mitochondrial uncoupling and enhances ROS-dependent cell migration via NF-kappaB activation in liver cells[J].
FEBS Lett,2014, 588 (1) : 175-83.
DOI: 10.1016/j.febslet.2013.11.033. ( 0) 0)
|
| [11] |
Yan SM, Zhang HX, Wang JS, et al. Perfluorooctanoic acid exposure induces endoplasmic reticulum stress in the liver and its effects are ameliorated by 4-phenylbutyrate[J].
Free Rad Biol Med,2015, 87 : 300-11.
DOI: 10.1016/j.freeradbiomed.2015.06.043. ( 0) 0)
|
| [12] |
Ricchi M, Odoardi MR, Carulli L, et al. Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes[J].
J Gastroenterol Hepatol,2009, 24 (5) : 830-40.
DOI: 10.1111/jgh.2009.24.issue-5. ( 0) 0)
|
| [13] |
Rao MS, Reddy JK. Peroxisomal beta-oxidation and steatohepatitis[J].
Semin Liver Dis,2001, 21 (1) : 43-55.
DOI: 10.1055/s-2001-12928. ( 0) 0)
|
| [14] |
Angulo P, Lindor KD. Non-alcoholic fatty liver disease[J].
J Gastroenterol Hepatol,2002, 17 (Suppl) : 186-90.
( 0) 0)
|
| [15] |
Pessayre D, Berson A, Fromenty B, et al. Mitochondria in steatohepatitis[J].
Semin Liver Dis,2001, 21 (1) : 57-69.
DOI: 10.1055/s-2001-12929. ( 0) 0)
|
| [16] |
Cucoranu I, Clempus R, Dikalova A, et al. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts[J].
Circ Res,2005, 97 (9) : 900-7.
DOI: 10.1161/01.RES.0000187457.24338.3D. ( 0) 0)
|
| [17] |
Gorin Y, Ricono JM, Kim NH, et al. Nox4 mediates angiotensinⅡ-induced activation of Akt/protein kinase B in mesangial cells[J].
Am J Physiol Renal Physiol,2003, 285 (2) : F219-29.
DOI: 10.1152/ajprenal.00414.2002. ( 0) 0)
|
| [18] |
Graham KA, Kulawiec M, Owens KM, et al. NADPH oxidase 4 is an oncoprotein localized to mitochondria[J].
Cancer Biol Ther,2010, 10 (3) : 223-31.
DOI: 10.4161/cbt.10.3.12207. ( 0) 0)
|
| [19] |
Doughan AK, Harrison DG, Dikalov SI. Molecular mechanisms of angiotensinⅡ-mediated mitochondrial dysfunction: linking mitochondrial oxidative damage and vascular endothelial dysfunction[J].
Circ Res,2008, 102 (4) : 488-96.
DOI: 10.1161/CIRCRESAHA.107.162800. ( 0) 0)
|
| [20] |
Lan T, Kisseleva T, Brenner DA. Deficiency of NOX1 or NOX4 prevents liver inflammation and fibrosis in mice through inhibition of hepatic stellate cell activation[J].
PLoS One,2015, 10 (7) : e0129743.
DOI: 10.1371/journal.pone.0129743. ( 0) 0)
|
| [21] |
Joshi-Barve S, Barve SS, Amancherla KA, et al. Palmitic acid induces production of proinflammatory cytokine interleukin-8 from hepatocytes[J].
Hepatology,2007, 46 (3) : 823-30.
DOI: 10.1002/hep.v46:3. ( 0) 0)
|
| [22] |
Szabo G, Petrasek J. Inflammasome activation and function in liver disease[J].
Nat Rev Gastroenterol Hepatol,2015, 12 (7) : 387-400.
DOI: 10.1038/nrgastro.2015.94. ( 0) 0)
|
| [23] |
Wu JJ, Xu XS, Li Y, et al. Quercetin, luteolin and epigallocatechin gallate alleviate TXNIP and NLRP3-mediated inflammation and apoptosis with regulation of AMPK in endothelial cells[J].
Eur J Pharmacol,2014, 745 : 59-68.
DOI: 10.1016/j.ejphar.2014.09.046. ( 0) 0)
|
 2016, Vol. 36
2016, Vol. 36
